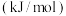名校
解题方法
1 . 海洋资源的利用具有广阔的前景。利用空气吹出法从海水中提取溴的流程如图:
(1)“吸收塔”中发生反应的离子方程式为_______ 。
(2)“蒸馏塔”具有将溴单质与水溶液分离的作用,其温度应控制在_____ (填序号)。
A.40∼50℃ B.60∼70℃ C.100℃以上
(3)物质A_____ (填化学式)可以循环利用。
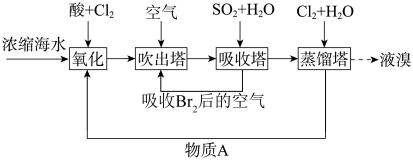
(4)探究“氧化”的适宜条件,测得不同条件下溶液中被氧化的 的百分含量如图:
的百分含量如图: 表示加入氯元素与海水中溴元素物质的量之比。
表示加入氯元素与海水中溴元素物质的量之比。
①结合实际生产,“氧化”的适宜条件为______ 。
②海水中溴元素的浓度是64mg/L,经该方法处理后1m3海水最终得到38.4gBr2,则该实验海水中溴元素的提取率为______ 。
③吸收后的空气进行循环利用,吹出时,吹出塔中 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示,当
流量的关系如图所示,当 流量过大,
流量过大, 吹出率反而下降,其原因:
吹出率反而下降,其原因:______ 。
(1)“吸收塔”中发生反应的离子方程式为
(2)“蒸馏塔”具有将溴单质与水溶液分离的作用,其温度应控制在
A.40∼50℃ B.60∼70℃ C.100℃以上
(3)物质A
(4)探究“氧化”的适宜条件,测得不同条件下溶液中被氧化的
 的百分含量如图:
的百分含量如图: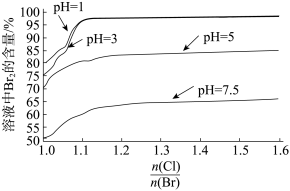
 表示加入氯元素与海水中溴元素物质的量之比。
表示加入氯元素与海水中溴元素物质的量之比。①结合实际生产,“氧化”的适宜条件为
②海水中溴元素的浓度是64mg/L,经该方法处理后1m3海水最终得到38.4gBr2,则该实验海水中溴元素的提取率为
③吸收后的空气进行循环利用,吹出时,吹出塔中
 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示,当
流量的关系如图所示,当 流量过大,
流量过大, 吹出率反而下降,其原因:
吹出率反而下降,其原因:
您最近一年使用:0次
解题方法
2 . 利用零价铁(Fe)耦合过硫酸盐( )和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基
)和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基 和HO·产生的机理如图所示。
和HO·产生的机理如图所示。 的结构式是
的结构式是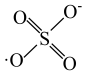 ,则
,则 的结构式是
的结构式是___________ 。
(2)过程ⅰ中反应的离子方程式是___________ 。
(3)过程ⅱ会导致溶液酸性增强,其中硫元素在反应前后均为+6价。该过程参与反应的物质还有(填化学式)___________ 。
(4)探究零价铁和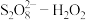 混合氧化剂体系降解水样中有机化合物M的能力。
混合氧化剂体系降解水样中有机化合物M的能力。
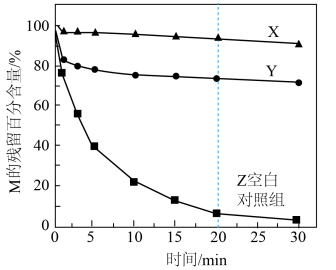
Ⅰ.通过加入甲醇或叔丁醇探究不同自由基降解M的能力。测得M的残留百分含量随时间变化如图所示。 ,叔丁醇只消耗HO·
,叔丁醇只消耗HO·
a.X中加入的是___________ (填“甲醇”或“叔丁醇")。
b.0~20min,Z中降解M的自由基主要是HO·,判断依据是___________ 。
Ⅱ.探究混合氧化剂中 的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的
的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的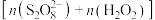 相同,其他条件不变。在相同时间内测得的实验数据如图所示。
相同,其他条件不变。在相同时间内测得的实验数据如图所示。
a.从①到④,TOC去除率升高的原因是___________ 。
b.从④到⑦,TOC去除率下降的原因是___________ 。
 )和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基
)和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基 和HO·产生的机理如图所示。
和HO·产生的机理如图所示。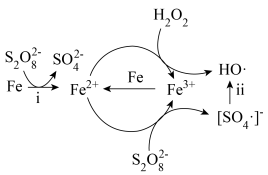
 的结构式是
的结构式是 ,则
,则 的结构式是
的结构式是(2)过程ⅰ中反应的离子方程式是
(3)过程ⅱ会导致溶液酸性增强,其中硫元素在反应前后均为+6价。该过程参与反应的物质还有(填化学式)
(4)探究零价铁和
 混合氧化剂体系降解水样中有机化合物M的能力。
混合氧化剂体系降解水样中有机化合物M的能力。Ⅰ.通过加入甲醇或叔丁醇探究不同自由基降解M的能力。测得M的残留百分含量随时间变化如图所示。
 ,叔丁醇只消耗HO·
,叔丁醇只消耗HO·a.X中加入的是
b.0~20min,Z中降解M的自由基主要是HO·,判断依据是
Ⅱ.探究混合氧化剂中
 的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的
的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的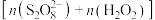 相同,其他条件不变。在相同时间内测得的实验数据如图所示。
相同,其他条件不变。在相同时间内测得的实验数据如图所示。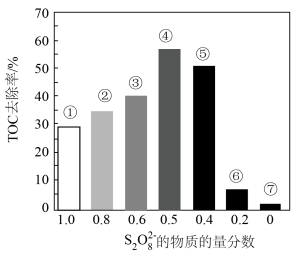
a.从①到④,TOC去除率升高的原因是
b.从④到⑦,TOC去除率下降的原因是
您最近一年使用:0次
3 . 我国科学家设计的化学链重整联合CO2捕集制H2系统如下图所示:
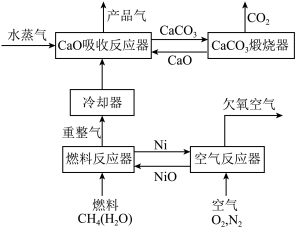
(1)空气反应器中发生___________ 反应(填“吸热”或“放热”)。
(2)重整气中有H2、CO、CO2、CH4和H2O,燃料反应器中CH4和NiO反应的化学方程式有___________ 。
(3)CaO吸收反应器中还发生蒸汽变换反应(CO与水蒸气或CH4与水蒸气反应)
①1 mol CH4和水蒸气生成CO2和H2吸收热量165 kJ,1 mol CH4和水蒸气生成CO和H2吸收热量206 kJ,CO(g) + H2O (g) =H2(g) + CO2(g) ΔH =___________ 。
② 反应温度对H2产率(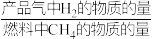 )、CO2捕集率(
)、CO2捕集率( )及产品气组成的影响如下图所示:
)及产品气组成的影响如下图所示:
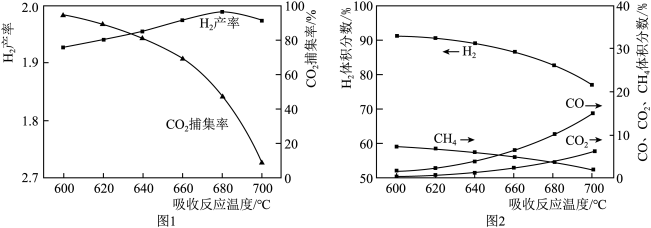
结合化学方程式说明图1中温度升高CO2捕集率降低的原因___________ ;解释图2中温度升高H2体积分数降低的原因___________ 。
(4)燃料反应器和吸收反应器中加入水蒸气的作用___________ 。

(1)空气反应器中发生
(2)重整气中有H2、CO、CO2、CH4和H2O,燃料反应器中CH4和NiO反应的化学方程式有
(3)CaO吸收反应器中还发生蒸汽变换反应(CO与水蒸气或CH4与水蒸气反应)
①1 mol CH4和水蒸气生成CO2和H2吸收热量165 kJ,1 mol CH4和水蒸气生成CO和H2吸收热量206 kJ,CO(g) + H2O (g) =H2(g) + CO2(g) ΔH =
② 反应温度对H2产率(
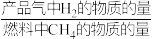 )、CO2捕集率(
)、CO2捕集率( )及产品气组成的影响如下图所示:
)及产品气组成的影响如下图所示:
结合化学方程式说明图1中温度升高CO2捕集率降低的原因
(4)燃料反应器和吸收反应器中加入水蒸气的作用
您最近一年使用:0次
4 . 历史上诺贝尔化学奖曾经3次颁给研究合成氨的化学家。合成氨的原理为  。回答下列问题。
。回答下列问题。
(1)t℃时,向填充有催化剂、体积为2L 的刚性容器中充入一定量的 和N2合成氨,实验中测得 c(NH3)随时间的变化如表所示:
和N2合成氨,实验中测得 c(NH3)随时间的变化如表所示:
5~15min内 N2的平均反应速率  =
=___________ 
下列情况能说明反应达到平衡状态的是________ (填标号)。
A.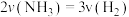 B. 混合气体的相对分子质量不再变化
B. 混合气体的相对分子质量不再变化
C. N2体积分数不再变化 D. 混合气体的密度保持不变
(2)如表列出了在不同温度和压强下,反应达到平衡时) 的百分含量
的百分含量  。
。
①从表中数据得出,最优的条件是___________ 。
②工业上通常选择在400~500℃和10~30MPa条件下合成氨, 原因是___________ 。
 。回答下列问题。
。回答下列问题。(1)t℃时,向填充有催化剂、体积为2L 的刚性容器中充入一定量的
 和N2合成氨,实验中测得 c(NH3)随时间的变化如表所示:
和N2合成氨,实验中测得 c(NH3)随时间的变化如表所示:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L⁻¹ | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 =
=
下列情况能说明反应达到平衡状态的是
A.
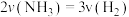 B. 混合气体的相对分子质量不再变化
B. 混合气体的相对分子质量不再变化C. N2体积分数不再变化 D. 混合气体的密度保持不变
(2)如表列出了在不同温度和压强下,反应达到平衡时)
 的百分含量
的百分含量  。
。压强/MPa 温度/℃ | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.5 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
②工业上通常选择在400~500℃和10~30MPa条件下合成氨, 原因是
您最近一年使用:0次
解题方法
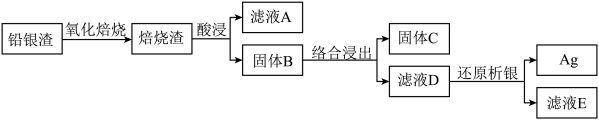
5 . 从铅银渣(含Pb、Ag、Cu等金属元素)中提取银的流程如下: 形成[Ag(SO3)2]3−。
形成[Ag(SO3)2]3−。
(1)“酸浸”时,使用H2SO4、NaCl和NaNO3的混合液作为浸出剂。
①加入NaNO3的作用___________ 。
②固体B含有___________ 。
(2)用氨水和水合肼(N2H4·H2O)进行“络合浸出”和“还原析银”。
①氨水“络合浸出”的化学方程式是___________ 。
②将水合肼“还原析银”反应的离子方程式补充完整:___________ 。
□ ___________+ N2H4·H2O =N2↑ + H2O + □ ___________ + □ ___________ + □ NH3↑
(3)用Na2SO3和甲醛进行“络合浸出”和“还原析银”。
①亚硫酸钠“络合浸出”时,银浸出率和溶液pH、浸出时间的关系分别如下图所示,解释银浸出率随溶液pH增大先升高后降低的原因___________ ;分析浸出时间超过4 h,银浸出率降低的原因___________ 。___________ 。
 形成[Ag(SO3)2]3−。
形成[Ag(SO3)2]3−。(1)“酸浸”时,使用H2SO4、NaCl和NaNO3的混合液作为浸出剂。
①加入NaNO3的作用
②固体B含有
(2)用氨水和水合肼(N2H4·H2O)进行“络合浸出”和“还原析银”。
①氨水“络合浸出”的化学方程式是
②将水合肼“还原析银”反应的离子方程式补充完整:
□ ___________+ N2H4·H2O =N2↑ + H2O + □ ___________ + □ ___________ + □ NH3↑
(3)用Na2SO3和甲醛进行“络合浸出”和“还原析银”。
①亚硫酸钠“络合浸出”时,银浸出率和溶液pH、浸出时间的关系分别如下图所示,解释银浸出率随溶液pH增大先升高后降低的原因

您最近一年使用:0次
2024-04-01更新
|
308次组卷
|
4卷引用:北京市石景山区2024届高三期中考试(一模)化学试卷
北京市石景山区2024届高三期中考试(一模)化学试卷北京市西城区2024届高三下学期第三次模拟测试化学试题(已下线)提升练07 工艺流程综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)压轴题11?无机化工流程综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
解题方法
6 . 将 作为弱氧化剂用于乙烷脱氢制备乙烯,具有避免乙烷深度氧化、
作为弱氧化剂用于乙烷脱氢制备乙烯,具有避免乙烷深度氧化、 资源化利用等显著优势。
资源化利用等显著优势。
(1)①查阅资料,计算 氧化
氧化 脱氢反应的反应热
脱氢反应的反应热
i.查阅______ 的燃烧热数据(填化学式)。
ii.查阅水的汽化热:
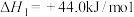 。
。
利用上述数据,得如下热化学方程式:
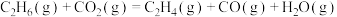
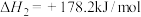
②检验产物有乙烯生成的操作和现象______ 。
(2)结合键能数据分析 氧化
氧化 脱氢反应的挑战和难点
脱氢反应的挑战和难点______ 。
(3)推测 催化
催化 氧化
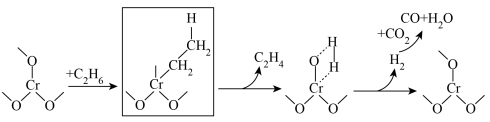
氧化 脱氢反应过程示意图如下,补全示意图中画框部分(示意图中未使用键线式)。
脱氢反应过程示意图如下,补全示意图中画框部分(示意图中未使用键线式)。
(4)分析投料体积比对反应的影响(650℃,0.1MPa,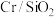 催化剂)
催化剂)
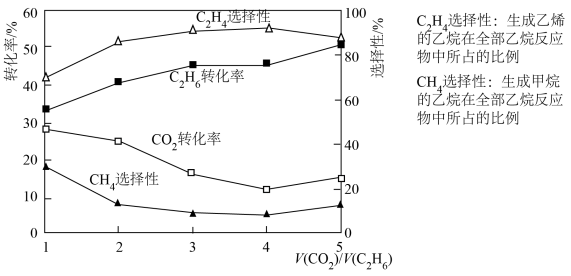
①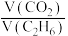 从1提高到5,
从1提高到5, 转化率从33.3%增加到50.5%,简述
转化率从33.3%增加到50.5%,简述 转化率增加的原因
转化率增加的原因______ 。(体积比为3和4时乙烷转化率基本相同)
②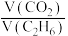 从4提高到5,副反应的化学方程式可能是
从4提高到5,副反应的化学方程式可能是______ 。
 作为弱氧化剂用于乙烷脱氢制备乙烯,具有避免乙烷深度氧化、
作为弱氧化剂用于乙烷脱氢制备乙烯,具有避免乙烷深度氧化、 资源化利用等显著优势。
资源化利用等显著优势。(1)①查阅资料,计算
 氧化
氧化 脱氢反应的反应热
脱氢反应的反应热i.查阅
ii.查阅水的汽化热:

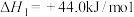 。
。利用上述数据,得如下热化学方程式:
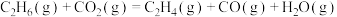
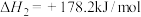
②检验产物有乙烯生成的操作和现象
(2)结合键能数据分析
 氧化
氧化 脱氢反应的挑战和难点
脱氢反应的挑战和难点键 |
|
|
|
键能 | 347.7 | 413.4 | 745 |
(3)推测
 催化
催化 氧化
氧化 脱氢反应过程示意图如下,补全示意图中画框部分(示意图中未使用键线式)。
脱氢反应过程示意图如下,补全示意图中画框部分(示意图中未使用键线式)。
(4)分析投料体积比对反应的影响(650℃,0.1MPa,
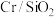 催化剂)
催化剂)
①
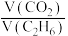 从1提高到5,
从1提高到5, 转化率从33.3%增加到50.5%,简述
转化率从33.3%增加到50.5%,简述 转化率增加的原因
转化率增加的原因②
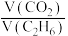 从4提高到5,副反应的化学方程式可能是
从4提高到5,副反应的化学方程式可能是
您最近一年使用:0次
名校
7 . 二氧化碳是主要的温室气体,也是一种工业原料。将其固定及利用,有利于缓解温室效应带来的环境问题。
(1)用二氧化碳合成甲醇。
已知:2H2(g)+O2(g)=2H2O(g) ∆H=-484kJ/mol
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H=-1348kJ/mol
在催化剂作用下,CO2(g)和H2(g)反应生成CH3OH(g)和H2O(g),该反应的热化学方程式是___________ 。
(2)用二氧化碳与环氧丙烷(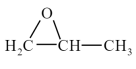 )反应合成可降解塑料PPC,同时也能生成副产物CPC,其化学反应过程中的能量变化如下图所示:在不同温度和压强下,PPC的选择性(产物中PPC的质量与产物总质量的比值)和总产率(产物总质量与反应物投料总质量的比值)如下表所示。
)反应合成可降解塑料PPC,同时也能生成副产物CPC,其化学反应过程中的能量变化如下图所示:在不同温度和压强下,PPC的选择性(产物中PPC的质量与产物总质量的比值)和总产率(产物总质量与反应物投料总质量的比值)如下表所示。
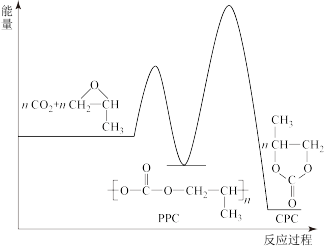
①通过表中数据ⅰ、ⅱ、ⅲ可以得出的结论是___________ 。在25℃时,实际生产中反应压强为1.5MPa,而不是2.0MPa,理由是___________ 。
②通过表中数据ⅱ、ⅳ、ⅴ可知温度升高会使PPC的选择性下降,结合上图说明其原因可能是___________ 。
(1)用二氧化碳合成甲醇。
已知:2H2(g)+O2(g)=2H2O(g) ∆H=-484kJ/mol
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H=-1348kJ/mol
在催化剂作用下,CO2(g)和H2(g)反应生成CH3OH(g)和H2O(g),该反应的热化学方程式是
(2)用二氧化碳与环氧丙烷(
 )反应合成可降解塑料PPC,同时也能生成副产物CPC,其化学反应过程中的能量变化如下图所示:在不同温度和压强下,PPC的选择性(产物中PPC的质量与产物总质量的比值)和总产率(产物总质量与反应物投料总质量的比值)如下表所示。
)反应合成可降解塑料PPC,同时也能生成副产物CPC,其化学反应过程中的能量变化如下图所示:在不同温度和压强下,PPC的选择性(产物中PPC的质量与产物总质量的比值)和总产率(产物总质量与反应物投料总质量的比值)如下表所示。
| 序号 | 温度/℃ | 压强/MPa | 总产率/% | PPC的选择性/% |
| ⅰ | 25 | 0.5 | 90 | 92.1 |
| ⅱ | 25 | 1.5 | 94.9 | >99 |
| ⅲ | 25 | 2.0 | 95.4 | >99 |
| ⅳ | 40 | 1.5 | 95.6 | 96.2 |
| ⅴ | 60 | 1.5 | 99 | 76 |
②通过表中数据ⅱ、ⅳ、ⅴ可知温度升高会使PPC的选择性下降,结合上图说明其原因可能是
您最近一年使用:0次
名校
8 . 合成氨是人类科技发展史上的一项重大突破。
(1)在一定条件下,N2(g)和H2(g)反应生成0.2 mol NH3(g),放出9.24kJ的热量,写出该可逆反应的热化学方程式:___________ 。从平衡视角合成氨应该选择常温条件,但实际工业生产却选择500℃左右的高温,可能的原因是___________ 。
(2)将N2和H2通入体积为2L的恒温恒容密闭容器中,5min后达到化学平衡,测得NH3的浓度为0.2mol/L,这段时间内用N2的浓度变化表示的化学反应速率为___________ 。
(3)理论上,为了增大平衡时H2的转化率,可采取的措施是___________ (写出一条)。
(4)如图是某压强下N2和H2按物质的量之比1:3投料进行反应,反应混合物中NH3的物质的量分数随温度的变化曲线。I是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线,下列说法正确的是___________ 。

A.图中a点,容器内n(N2):n(NH3)=1:4
B.图中b点,V正<V逆
C.400-530℃,Ⅱ中NH3的物质的量分数随温度升高而增大,原因是升温化学反应速率加快
(1)在一定条件下,N2(g)和H2(g)反应生成0.2 mol NH3(g),放出9.24kJ的热量,写出该可逆反应的热化学方程式:
(2)将N2和H2通入体积为2L的恒温恒容密闭容器中,5min后达到化学平衡,测得NH3的浓度为0.2mol/L,这段时间内用N2的浓度变化表示的化学反应速率为
(3)理论上,为了增大平衡时H2的转化率,可采取的措施是
(4)如图是某压强下N2和H2按物质的量之比1:3投料进行反应,反应混合物中NH3的物质的量分数随温度的变化曲线。I是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线,下列说法正确的是

A.图中a点,容器内n(N2):n(NH3)=1:4
B.图中b点,V正<V逆
C.400-530℃,Ⅱ中NH3的物质的量分数随温度升高而增大,原因是升温化学反应速率加快
您最近一年使用:0次
2023-12-04更新
|
42次组卷
|
2卷引用:北京市八一学校2023-2024学年高二上学期期中测试化学试题
解题方法
9 . 研究CO2的回收和综合利用对航天建设有重要意义。
Ⅰ.载人航天器中,利用萨巴蒂尔反应可将航天员呼出的CO2转化为 H2O,再通过电解H2O 获得 O2,实现O2的再生,同时还能制备CH4。已知:
反应①:CO2(g)+4H2(g)=CH4(g)+2H2O(l) ∆H = −252.9kJ/mol
反应②:2H2O(l)=2H2(g)+O2(g) ∆H = +571.6kJ/mol
请回答下列问题:
(1)反应①属于___________ (填“吸热”或“放热”)反应。
(2)利用 CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
已知2CH4(g)=C2H4(g)+2H2(g) ΔH =+167kJ/mol,则a=___________ 。
Ⅱ.回收利用CO2是目前解决长期载人航天舱内(如空间站)供氧问题的有效途径,科研人员研究出其物质转化途径如下图:
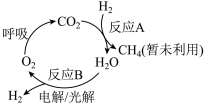
(3)反应A为CO2(g)+4H2(g) CH4(g)+2H2O(g),是回收利用CO2的关键步骤。
CH4(g)+2H2O(g),是回收利用CO2的关键步骤。
已知:2H2(g) + O2(g) = 2H2O(g) ΔH = −483.6 kJ·mol−1
CH4(g) + 2O2(g) = 2H2O(g) + CO2(g) ΔH = −802.3 kJ·mol−1
反应A的ΔH =___________ kJ·mol−1
(4)将原料气按n(CO2):n(H2)=1:4置于恒容密闭容器中发生反应A,在相同时间内测得H2O的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
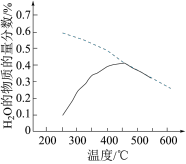
①理论上,能提高CO2平衡转化率的措施有___________ (写出一条即可)。
②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高CO2的转化效率,原因是___________ 。
(5)下列关于空间站内物质和能量变化的说法中,不正确 的是___________ (填字母)。
a.反应B的能量变化是电能→化学能或光能→化学能
b.物质转化中O、H原子的利用率均为100%
c.不用Na2O2作供氧剂的原因可能是Na2O2不易实现循环利用
(6)用CO2(g)+2H2(g) C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是___________ 。
Ⅰ.载人航天器中,利用萨巴蒂尔反应可将航天员呼出的CO2转化为 H2O,再通过电解H2O 获得 O2,实现O2的再生,同时还能制备CH4。已知:
反应①:CO2(g)+4H2(g)=CH4(g)+2H2O(l) ∆H = −252.9kJ/mol
反应②:2H2O(l)=2H2(g)+O2(g) ∆H = +571.6kJ/mol
请回答下列问题:
(1)反应①属于
(2)利用 CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
| 化学键 | H-H | C=C | C-C | C-H |
| E(kJ/mol) | 436 | a | 348 | 413 |
Ⅱ.回收利用CO2是目前解决长期载人航天舱内(如空间站)供氧问题的有效途径,科研人员研究出其物质转化途径如下图:

(3)反应A为CO2(g)+4H2(g)
 CH4(g)+2H2O(g),是回收利用CO2的关键步骤。
CH4(g)+2H2O(g),是回收利用CO2的关键步骤。已知:2H2(g) + O2(g) = 2H2O(g) ΔH = −483.6 kJ·mol−1
CH4(g) + 2O2(g) = 2H2O(g) + CO2(g) ΔH = −802.3 kJ·mol−1
反应A的ΔH =
(4)将原料气按n(CO2):n(H2)=1:4置于恒容密闭容器中发生反应A,在相同时间内测得H2O的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。

①理论上,能提高CO2平衡转化率的措施有
②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高CO2的转化效率,原因是
(5)下列关于空间站内物质和能量变化的说法中,
a.反应B的能量变化是电能→化学能或光能→化学能
b.物质转化中O、H原子的利用率均为100%
c.不用Na2O2作供氧剂的原因可能是Na2O2不易实现循环利用
(6)用CO2(g)+2H2(g)
 C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
您最近一年使用:0次
名校
解题方法
10 . 有催化剂的条件下,将 和
和 混合加热可制备
混合加热可制备 。主要的反应有:
。主要的反应有:
Ⅰ.
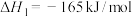
Ⅱ.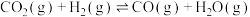

Ⅲ.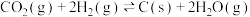
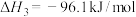
(1) 、
、 、
、 的沸点由高到低的顺序是
的沸点由高到低的顺序是__________ 。
(2)由燃烧热求 。已知
。已知 (g)和CO(g)的燃烧热分别为-285.8kJ/mol、-283kJ/mol。
(g)和CO(g)的燃烧热分别为-285.8kJ/mol、-283kJ/mol。
①要计算 至少还需要一个过程的热效应(该热效应记为
至少还需要一个过程的热效应(该热效应记为 ),则此过程的热化学方程式是
),则此过程的热化学方程式是___________ 。
②
____________ (用含有 的代数式表示)。
的代数式表示)。
(3) 的电子式是
的电子式是__________ ,其中C=O键的键能是799kJ/mol, 中O—H键的键能是463kJ/mol。则,H—H键的键能与C—H的键能相差
中O—H键的键能是463kJ/mol。则,H—H键的键能与C—H的键能相差__________ kJ/mol。
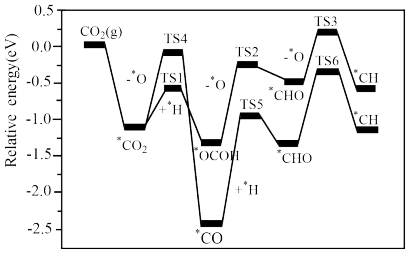
(4) 甲烷化反应的机理大体可归结为两种,如图表示了两种途径每步反应的能量变化(TSx代表过渡态,*表示吸附在催化剂表面的物料),其中速率较快的途径中的决速步的化学方程式是
甲烷化反应的机理大体可归结为两种,如图表示了两种途径每步反应的能量变化(TSx代表过渡态,*表示吸附在催化剂表面的物料),其中速率较快的途径中的决速步的化学方程式是___________________ 。
(5)将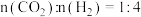 混合气持续以一定的流速通过含催化剂的恒容反应器,测定
混合气持续以一定的流速通过含催化剂的恒容反应器,测定 的转化率和
的转化率和 的选择性随温度的变化关系如图所示。温度高于500℃后,
的选择性随温度的变化关系如图所示。温度高于500℃后, 的转化率几乎保持不变但
的转化率几乎保持不变但 的选择性下降的可能原因是
的选择性下降的可能原因是________________________ 。

(6)不同压强下,保持相同的投料比,测定反应体系中 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如图所示。
的平衡产率随温度的变化关系如图所示。
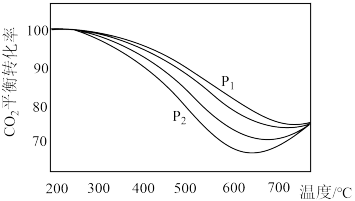
 时曲线出现拐点的温度高于
时曲线出现拐点的温度高于 时的,原因是
时的,原因是___________________________ 。
 和
和 混合加热可制备
混合加热可制备 。主要的反应有:
。主要的反应有:Ⅰ.

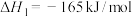
Ⅱ.
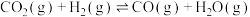

Ⅲ.
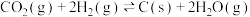
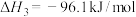
(1)
 、
、 、
、 的沸点由高到低的顺序是
的沸点由高到低的顺序是(2)由燃烧热求
 。已知
。已知 (g)和CO(g)的燃烧热分别为-285.8kJ/mol、-283kJ/mol。
(g)和CO(g)的燃烧热分别为-285.8kJ/mol、-283kJ/mol。①要计算
 至少还需要一个过程的热效应(该热效应记为
至少还需要一个过程的热效应(该热效应记为 ),则此过程的热化学方程式是
),则此过程的热化学方程式是②

 的代数式表示)。
的代数式表示)。(3)
 的电子式是
的电子式是 中O—H键的键能是463kJ/mol。则,H—H键的键能与C—H的键能相差
中O—H键的键能是463kJ/mol。则,H—H键的键能与C—H的键能相差(4)
 甲烷化反应的机理大体可归结为两种,如图表示了两种途径每步反应的能量变化(TSx代表过渡态,*表示吸附在催化剂表面的物料),其中速率较快的途径中的决速步的化学方程式是
甲烷化反应的机理大体可归结为两种,如图表示了两种途径每步反应的能量变化(TSx代表过渡态,*表示吸附在催化剂表面的物料),其中速率较快的途径中的决速步的化学方程式是
(5)将
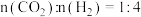 混合气持续以一定的流速通过含催化剂的恒容反应器,测定
混合气持续以一定的流速通过含催化剂的恒容反应器,测定 的转化率和
的转化率和 的选择性随温度的变化关系如图所示。温度高于500℃后,
的选择性随温度的变化关系如图所示。温度高于500℃后, 的转化率几乎保持不变但
的转化率几乎保持不变但 的选择性下降的可能原因是
的选择性下降的可能原因是
(6)不同压强下,保持相同的投料比,测定反应体系中
 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如图所示。
的平衡产率随温度的变化关系如图所示。
 时曲线出现拐点的温度高于
时曲线出现拐点的温度高于 时的,原因是
时的,原因是
您最近一年使用:0次