1 . 下图为工业合成氨的流程图。图中为提高原料转化率而采取的措施是
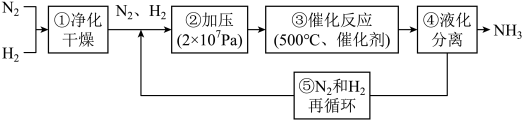
| A.①②③ | B.①③⑤ | C.②④⑤ | D.②③④ |
您最近一年使用:0次
2024-03-23更新
|
59次组卷
|
2卷引用:宁夏石嘴山市第三中学2023-2024学年高一下学期4月期中考试化学试题
解题方法
2 . Ⅰ.习近平总书记十分重视生态环境保护,多次对生态文明建设作出重要指示,其中研究 、
、 、CO等气体的无害化处理对治埋大气污染、建设生态文明具有重要意义。
、CO等气体的无害化处理对治埋大气污染、建设生态文明具有重要意义。
(1)处理含CO、 烟道气的一种方法是将其在催化剂作用下转化为单质S。已知:
烟道气的一种方法是将其在催化剂作用下转化为单质S。已知:
①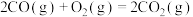
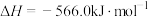
②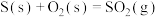

则CO与 反应生成S的热化学方程式是
反应生成S的热化学方程式是_______ 。
(2)在一绝热体系且容积固定的密闭容器中,用 催化还原
催化还原 也可以消除氮氧化物的污染,其中发生化学反应之一为:
也可以消除氮氧化物的污染,其中发生化学反应之一为: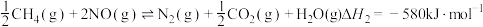 ,能说明上反应达到平衡状态的是
,能说明上反应达到平衡状态的是_______ 。
a.平均摩尔质量不变 b. 和
和 的体积比保持不变
的体积比保持不变
c.体系压强保持不变 d.每生成1mol 同时生成2molNO
同时生成2molNO
Ⅱ.运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(3)生产氢气:将水蒸气通过红热的炭即产生水煤气;
 ,
,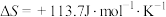 ,该反应在(填“高温”或“低温”或“任何温度”)
,该反应在(填“高温”或“低温”或“任何温度”)_______ 下,才能自发进行。
(4)合成氨工业中的主要反应是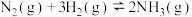
 ,从温度和压强的角度回答:要加快合成氨的反应速率应选择
,从温度和压强的角度回答:要加快合成氨的反应速率应选择_______ ;要提高氨的产率应选择_______ 。
 、
、 、CO等气体的无害化处理对治埋大气污染、建设生态文明具有重要意义。
、CO等气体的无害化处理对治埋大气污染、建设生态文明具有重要意义。(1)处理含CO、
 烟道气的一种方法是将其在催化剂作用下转化为单质S。已知:
烟道气的一种方法是将其在催化剂作用下转化为单质S。已知:①
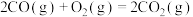
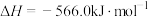
②
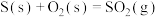

则CO与
 反应生成S的热化学方程式是
反应生成S的热化学方程式是(2)在一绝热体系且容积固定的密闭容器中,用
 催化还原
催化还原 也可以消除氮氧化物的污染,其中发生化学反应之一为:
也可以消除氮氧化物的污染,其中发生化学反应之一为: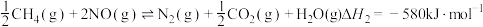 ,能说明上反应达到平衡状态的是
,能说明上反应达到平衡状态的是a.平均摩尔质量不变 b.
 和
和 的体积比保持不变
的体积比保持不变c.体系压强保持不变 d.每生成1mol
 同时生成2molNO
同时生成2molNOⅡ.运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(3)生产氢气:将水蒸气通过红热的炭即产生水煤气;

 ,
,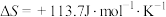 ,该反应在(填“高温”或“低温”或“任何温度”)
,该反应在(填“高温”或“低温”或“任何温度”)(4)合成氨工业中的主要反应是
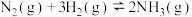
 ,从温度和压强的角度回答:要加快合成氨的反应速率应选择
,从温度和压强的角度回答:要加快合成氨的反应速率应选择
您最近一年使用:0次
3 . 下列事实不能用勒夏特列原理解释的是
| A.100℃时,纯水的pH≈6 |
| B.实验室常用排饱和食盐水的方法收集氯气 |
| C.实验室用过氧化氢制取氧气时,常常加入MnO2固体 |
| D.工业上采用高压条件合成氨气 |
您最近一年使用:0次
名校
解题方法
4 . 氨是制造化肥的重要原料,如图为工业合成氨的流程图,下列说法错误的是
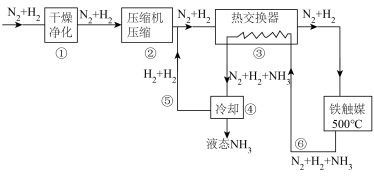

| A.工业上制氮气一般用分离液态空气法 |
| B.步骤③的作用是充分利用热量,减少能耗 |
C.步骤①中“净化” 混合气体可以防止催化剂中毒 混合气体可以防止催化剂中毒 |
| D.步骤③中温度选择500℃,主要是考虑平衡时反应物的转化率 |
您最近一年使用:0次
2023-11-17更新
|
126次组卷
|
2卷引用:宁夏育才中学2023-2024学年高二上学期1月期末化学试题
名校
5 . 二氧化氯(ClO2)具有强氧化性,是优良的饮用水消毒剂。ClO2常温下为黄绿色气体,熔点-59℃,沸点11℃,极易溶于水且不与水反应,浓的ClO2受热时易爆炸。我国广泛使用的方法是用干燥的Cl2与NaClO2固体反应制取ClO2,实验室模拟制备ClO2装置如图所示:
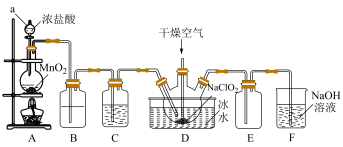
(1)仪器a的名称是:___________ ,装置A中反应的离子方程式为:___________ 。
(2)装置B中盛装的试剂是___________ ,装置C中试剂的作用是:___________ 。
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②___________ 。
(4)装置E为ClO2的收集装置,应将其置于___________ 水浴中(填“热”或“冰”)。
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:___________ 。
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若___________ (填“实验现象”),则假设1成立。

(1)仪器a的名称是:
(2)装置B中盛装的试剂是
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②
(4)装置E为ClO2的收集装置,应将其置于
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若
您最近一年使用:0次
2023-11-06更新
|
629次组卷
|
2卷引用:宁夏银川市第二中学2023-2024学年高一上学期期中考试化学试题
名校
6 . 氨是一种重要的基础化工产品。
(1)合成氨的原料气( 及少量
及少量 的混合气)在进入合成塔前需除去
的混合气)在进入合成塔前需除去 ,原因是
,原因是___________ 。
原料气中的 常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
反应Ⅰ:
反应Ⅱ: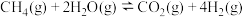
反应Ⅲ:
一定条件下,向体积为V的恒容容器中充入 甲烷和
甲烷和 水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则
水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则 的物质的量为
的物质的量为________  ,写出反应Ⅲ的平衡常数
,写出反应Ⅲ的平衡常数
___________ 。
(2) 与
与 作用分别生成
作用分别生成 的反应均为放热反应。工业尾气中的
的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的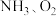 和
和 的混合气体以一定流速经过装有催化剂的反应管,
的混合气体以一定流速经过装有催化剂的反应管, 的转化率、
的转化率、 的选择性[
的选择性[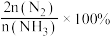 ]与温度的关系如图。
]与温度的关系如图。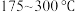 范围内升高温度,出口处氮氧化物的量
范围内升高温度,出口处氮氧化物的量________ (填“增大”或“减小), 的平衡转化率
的平衡转化率________ (填“增大”或“减小”)。
②为能更有效除去尾气中的 ,保护环境,应选择的最佳温度为
,保护环境,应选择的最佳温度为________ (填序号)。
A. B.
B. C.
C.
(3)氨气也可与氨的氧化物反应生成氮气,该反应可用于处理氮的氧化物。例如: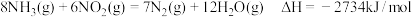 ,将
,将 和
和 以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中
以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中 含量,从而确定
含量,从而确定 的转化率,结果如图所示:
的转化率,结果如图所示:___________ (填“是”或“不是”)平衡状态,原因是___________ 。
(1)合成氨的原料气(
 及少量
及少量 的混合气)在进入合成塔前需除去
的混合气)在进入合成塔前需除去 ,原因是
,原因是原料气中的
 常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
常用甲烷水蒸气重整反应制备,涉及的主要反应如下:反应Ⅰ:

反应Ⅱ:
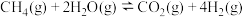
反应Ⅲ:

一定条件下,向体积为V的恒容容器中充入
 甲烷和
甲烷和 水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则
水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则 的物质的量为
的物质的量为 ,写出反应Ⅲ的平衡常数
,写出反应Ⅲ的平衡常数
(2)
 与
与 作用分别生成
作用分别生成 的反应均为放热反应。工业尾气中的
的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的 和
和 的混合气体以一定流速经过装有催化剂的反应管,
的混合气体以一定流速经过装有催化剂的反应管, 的转化率、
的转化率、 的选择性[
的选择性[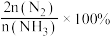 ]与温度的关系如图。
]与温度的关系如图。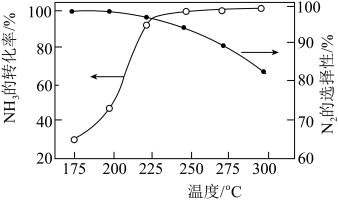
 范围内升高温度,出口处氮氧化物的量
范围内升高温度,出口处氮氧化物的量 的平衡转化率
的平衡转化率②为能更有效除去尾气中的
 ,保护环境,应选择的最佳温度为
,保护环境,应选择的最佳温度为A.
 B.
B. C.
C.
(3)氨气也可与氨的氧化物反应生成氮气,该反应可用于处理氮的氧化物。例如:
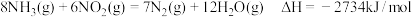 ,将
,将 和
和 以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中
以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中 含量,从而确定
含量,从而确定 的转化率,结果如图所示:
的转化率,结果如图所示: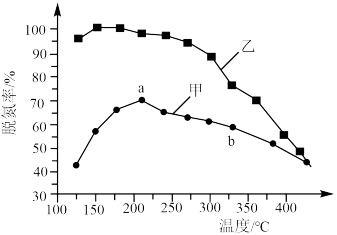
您最近一年使用:0次
2023-10-06更新
|
145次组卷
|
2卷引用:2024届宁夏石嘴山市大武口区石嘴山市第三中学高三下学期三模考试理综试题-高中化学
名校
解题方法
7 . 铬元素及其化合物在生产、生活中具有广泛的用途。醋酸亚铬水合物{[Cr(CH3COO)2]2⋅2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价络(二价铬不稳定,极易被氧气氧化)
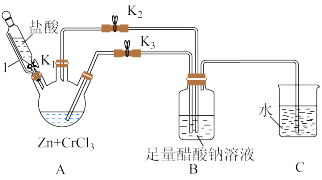
(1)仪器1的名称是___________ ,该装置的优点是 ___________ 。
(2)本实验中所用的溶液,配制用的蒸馏水都需事先煮沸,同时还要与C装置相连___________ 。
(3)本实验中锌粒要过量,其原因除了锌与CrCl3充分反应得到CrCl2外,另一个作用是___________ 。
(4)实验中,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应___________ 阀门K2、___________ 阀门K3(填“打开”或“关闭”)。
(5)为洗涤[Cr(CH3COO)2]2⋅2H2O产品,下列方法中最适合的是 ___________。
(6)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质6.34g,实验后得干燥纯净的[Cr(CH3COO)2]2⋅2H2O5.64g,请计算该实验所得产品的产率___________ 。

(1)仪器1的名称是
(2)本实验中所用的溶液,配制用的蒸馏水都需事先煮沸,同时还要与C装置相连
(3)本实验中锌粒要过量,其原因除了锌与CrCl3充分反应得到CrCl2外,另一个作用是
(4)实验中,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应
(5)为洗涤[Cr(CH3COO)2]2⋅2H2O产品,下列方法中最适合的是 ___________。
| A.先用盐酸洗,后用冷水洗 |
| B.先用冷水洗,后用乙醇洗 |
| C.先用冷水洗,后用乙醚洗 |
| D.先用乙醇洗涤,后用乙醚洗 |
(6)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质6.34g,实验后得干燥纯净的[Cr(CH3COO)2]2⋅2H2O5.64g,请计算该实验所得产品的产率
您最近一年使用:0次
名校
8 . 哈伯工业合成氨的流程如图,为提高原料平衡转化率采取的措施是
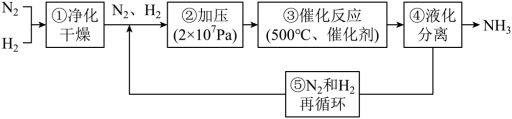

| A.①②③④⑤ | B.②③④⑤ | C.②④⑤ | D.②③④ |
您最近一年使用:0次
2022-10-21更新
|
176次组卷
|
18卷引用:宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题
宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题安徽省宣城市2018-2019学年高二下学期期末考试化学试题山西省长治市第二中学2019-2020学年高二上学期12月月考化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第四节 化学反应的调控 方法帮山东省淄博市沂源县第二中学2020-2021学年高二下学期期中考试化学试题江西省九江市第一中学2021-2022学年高二上学期第一次月考化学试题山西省长治市第二中学校2021-2022学年高二上学期第一次月考化学试题(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省齐齐哈尔市第八中学2022-2023学年高二上学期10月月考化学试题重庆市南川中学2022-2023学年高二上学期第一学月考试化学试题山西省太原市2019-2020学年高二上学期期中测评化学试题天津市部分区2022-2023 学年高三上学期1月期末考试化学试题广东省湛江市第二十一中学2022-2023学年高二上学期期中考试化学试题第二章 化学反应速率与化学平衡 第四节 化学反应的调控河南省濮阳市第一高级中学2023-2024学年高二上学期9月月考化学试题四川省内江市威远中学校2023-2024学年高二上学期期中考试化学试题四川省内江市威远中学校2023-2024学年高二上学期第二次月考(期中)化学试卷湖北省武汉市重点中学5G联合体2023-2024学年高二上学期期中考试化学试题
名校
解题方法
9 . 中科院天津工业生物所利用光伏发电,将电解水获得的H2与CO2反应合成甲醇,再由甲醇经若干酶促反应合成淀粉,首次在实验室实现二氧化碳到淀粉的从头合成。回答下列问题:
(1)该研究成果的重大意义是____ 。(答出一点即可)
(2)已知:在一定温度和压强下,由最稳定单质生成1mol化合物的焓变称为该物质的摩尔生成焓。某些化合物的摩尔生成焓如表所示。
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
①反应I的焓变ΔH1=____ kJ∙mol-1。
②保持温度T不变,在一刚性密闭容器中,充入一定量的CO2和H2,同时发生反应I和II,起始及达平衡时,容器内各气体的物质的量如表所示。
已知起始时总压强为1.5pkPa,平衡时体系总压强为pkPa,则表中n1=____ ,反应I的平衡常数Kp=____ 。(含p的式子表示)
(3)取物质的量浓度为amol∙L-1的甲醇,选择不同的工程酶组块作为催化剂反应10h,测得实验数据如表所示。
①根据表中数据选取最佳的反应条件____ 。
②已知温度升高,反应生成的淀粉量先增加后急剧减少,其可能原因是____ 。
③实验4可用淀粉的质量浓度表示反应速率为____ g∙L-1∙h-1。淀粉的产率为____ 。(用含a的式子表示)
(1)该研究成果的重大意义是
(2)已知:在一定温度和压强下,由最稳定单质生成1mol化合物的焓变称为该物质的摩尔生成焓。某些化合物的摩尔生成焓如表所示。
| 化合物 | CO2(g) | CH3OH(g) | H2O(g) |
| 摩尔生成焓/(kJ∙mol-1) | -395 | -200 | -242 |
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1反应II:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2①反应I的焓变ΔH1=
②保持温度T不变,在一刚性密闭容器中,充入一定量的CO2和H2,同时发生反应I和II,起始及达平衡时,容器内各气体的物质的量如表所示。
| CO2 | H2 | CH3OH | CO | H2O | |
| 起始量/mol | 4.0 | 8.0 | 0 | 0 | 0 |
| 平衡量/mol | n1 | 3.0 |
(3)取物质的量浓度为amol∙L-1的甲醇,选择不同的工程酶组块作为催化剂反应10h,测得实验数据如表所示。
| 实验序号 | 温度/K | 不同工程酶的组块 | 淀粉/(g∙L-1) |
| 1 | T1 | agp-M1 | 0.21 |
| 2 | T1 | agp-M2 | 0.38 |
| 3 | T2 | agp-M2 | 1.82 |
| 4 | T2 | agp-M3 | 1.24 |
②已知温度升高,反应生成的淀粉量先增加后急剧减少,其可能原因是
③实验4可用淀粉的质量浓度表示反应速率为
您最近一年使用:0次
2022-05-23更新
|
200次组卷
|
2卷引用:宁夏回族自治区银川一中2022届高三三模理科综合化学试题
名校
10 . Ⅰ 氮及其化合物的转化过程如图1所示,其中图2为反应①过程中能量变化的曲线图。
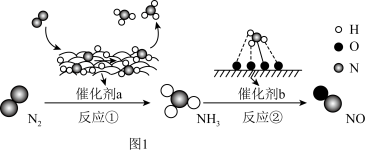
(1)图2中曲线_______ (填字母)是加入催化剂a时的能量变化曲线,该反应破坏生成物全部化学键所需要的总能量_______ (填“大于”或“小于”或“等于”)破坏反应物全部化学键所需要的总能量

(2)标准状况下进行反应②,若有1.25mol电子发生转移,则参加反应的NH3的体积为_______
(3)下列说法正确的是
Ⅱ.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径

(4)请写出CO2的电子式_______ ,该反应的机理及各分子化学键完全断裂时的能量变化如图所示,根据数据计算,分解1molCO2需_______ (填“吸收”或“放出”) _______ kJ的能量。


(1)图2中曲线

(2)标准状况下进行反应②,若有1.25mol电子发生转移,则参加反应的NH3的体积为
(3)下列说法正确的是
| A.合成氨在工业生产中常将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.工业合成氨中,为加快化学反应速率,压强和温度越高越好 |
| C.合成氨工业要用合适的催化剂,目的是降低该反应的活化能 |
| D.工业合成氨中反应物不能百分之百转化为生成物 |
Ⅱ.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径

(4)请写出CO2的电子式

您最近一年使用:0次



