名校
1 . 下列说法正确的是
A. , , 的反应在温度低时不能自发进行 的反应在温度低时不能自发进行 |
| B.室温下冰自动融化成水,这是熵增的过程 |
| C.海水提溴:一般需要经过浓缩、氧化、用热空气吹出及冷凝、精制等步骤 |
D.硫酸工业:采用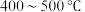 的高温,有利于增大反应正向进行的程度 的高温,有利于增大反应正向进行的程度 |
您最近半年使用:0次
名校
2 . I.在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g)  2SO3(g) ΔH=—196.6kJ•mol-1(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)。表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g) ΔH=—196.6kJ•mol-1(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)。表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是________ 。
(2)在实际生产中,选定的温度为400~500℃,原因是___________ 。
(3)在实际生产中,采用的压强为常压,原因是___________ 。
(4)在实际生产中,通入过量的空气,原因是___________ 。
(5)尾气中SO2必须回收,原因是___________ 。
II.Bodenstein研究了反应:2HI(g) H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:
H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:
(6)根据上述实验结果,该反应的平衡常数K的计算式为___________ 。
(7)上述反应中,正反应速率v正=k正x2(HI),逆反应速率v逆=k逆x(H2)•x(I2),其中k正、k逆为正、逆反应速率常数,则k逆为___________ (用含K和k正的代数式表示)。
III.在刚性容器压强为1.01MPa时,乙酸甲酯与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g) CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3):n(H2)=1:10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3):n(H2)=1:10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
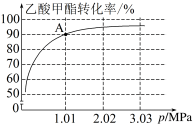
(8)A点时,CH3CH2OH(g)的体积分数为___________ %(保留一位小数)。
(9)此温度下,该反应的化学平衡常数Kp=___________ MPa-1(Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
 2SO3(g) ΔH=—196.6kJ•mol-1(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)。表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g) ΔH=—196.6kJ•mol-1(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)。表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是
(2)在实际生产中,选定的温度为400~500℃,原因是
(3)在实际生产中,采用的压强为常压,原因是
(4)在实际生产中,通入过量的空气,原因是
(5)尾气中SO2必须回收,原因是
II.Bodenstein研究了反应:2HI(g)
 H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:
H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.6 | 0.73 | 0.773 | 0.78 | 0.784 |
(6)根据上述实验结果,该反应的平衡常数K的计算式为
(7)上述反应中,正反应速率v正=k正x2(HI),逆反应速率v逆=k逆x(H2)•x(I2),其中k正、k逆为正、逆反应速率常数,则k逆为
III.在刚性容器压强为1.01MPa时,乙酸甲酯与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g)
 CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3):n(H2)=1:10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3):n(H2)=1:10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
(8)A点时,CH3CH2OH(g)的体积分数为
(9)此温度下,该反应的化学平衡常数Kp=
您最近半年使用:0次
名校
解题方法
3 . 合成氨工业中,在催化剂作用下发生反应 。下列说法正确的是
。下列说法正确的是
 。下列说法正确的是
。下列说法正确的是| A.该反应的反应物键能总和大于生成物的键能总和 |
| B.实际生产中通常选择200℃、100Mpa条件下合成氨 |
| C.采取迅速冷却的方法,使气态氨变为液态氨后及时从平衡混合物中分离出去,可提高氨的产量 |
| D.增大催化剂的表面积,可有效加快反应速率和提高平衡转化率 |
您最近半年使用:0次
2023-11-21更新
|
239次组卷
|
2卷引用:安徽省六安第一中学2023-2024学年高二上学期期中考试化学试题
23-24高三上·陕西汉中·阶段练习
解题方法
4 .  (简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、
(简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、 、LiCl和
、LiCl和 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
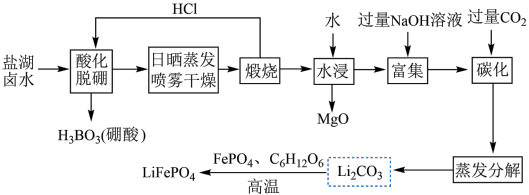
注:日晒蒸发、喷雾干燥后固体含NaCl、LiCl、 等。
等。
(1) 中Li在元素周期表中的位置为第
中Li在元素周期表中的位置为第___________ 周期___________ 族。
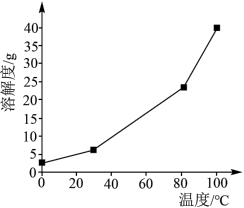
(2)硼酸在水中的溶解度随温度的变化关系如图所示。
已知: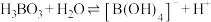
 最多与
最多与___________  溶液完全反应。“酸化脱硼”中采用
溶液完全反应。“酸化脱硼”中采用___________ (填“加热”或“冷却”),采用该操作的目的是___________ 。
(3)“煅烧”过程中,常需要搅拌,搅拌的目的是___________ 。
(4)“蒸发分解”的化学方程式为___________ 。
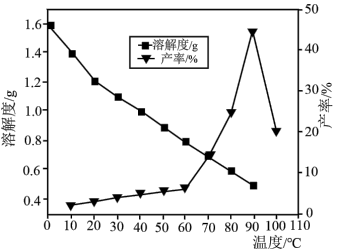
(5)已知不同温度下蒸发分解得到 的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是
的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是___________ ,制得 后需要洗涤,具体操作为
后需要洗涤,具体操作为___________ 。
(6)用 、
、 、
、 制备
制备 时,有
时,有 产生,则参与反应的
产生,则参与反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
 (简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、
(简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、 、LiCl和
、LiCl和 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
注:日晒蒸发、喷雾干燥后固体含NaCl、LiCl、
 等。
等。(1)
 中Li在元素周期表中的位置为第
中Li在元素周期表中的位置为第(2)硼酸在水中的溶解度随温度的变化关系如图所示。

已知:
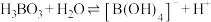
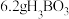 最多与
最多与 溶液完全反应。“酸化脱硼”中采用
溶液完全反应。“酸化脱硼”中采用(3)“煅烧”过程中,常需要搅拌,搅拌的目的是
(4)“蒸发分解”的化学方程式为
(5)已知不同温度下蒸发分解得到
 的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是
的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是 后需要洗涤,具体操作为
后需要洗涤,具体操作为
(6)用
 、
、 、
、 制备
制备 时,有
时,有 产生,则参与反应的
产生,则参与反应的 和
和 的物质的量之比为
的物质的量之比为
您最近半年使用:0次
名校
解题方法
5 .  可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备
可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备 以及含量测定的实验。已知:常温下
以及含量测定的实验。已知:常温下 不溶于水,较稳定,与酸反应生成
不溶于水,较稳定,与酸反应生成 ;加热时会分解生成
;加热时会分解生成 和
和 。
。
请回答下列问题:
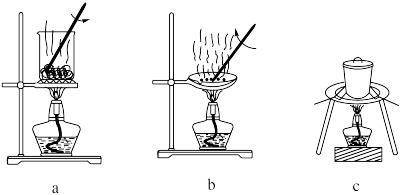
(1)灼烧。灼烧 制
制 时,可使用的实验装置有
时,可使用的实验装置有___________ (填字母)。
(2)转化。向 中先加入稳定剂和
中先加入稳定剂和 溶液,充分反应后,过滤、洗涤、干燥,可得粗品
溶液,充分反应后,过滤、洗涤、干燥,可得粗品 。
。
①写出制备 时发生反应的化学方程式:
时发生反应的化学方程式:___________ 。
②“转化”阶段有大量热量放出,为了提高 的产率,添加
的产率,添加 溶液时,比较理想的操作方法为
溶液时,比较理想的操作方法为___________ 。
(3)测定。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中 的含量。
的含量。

①实验时在稀盐酸中加入 溶液的作用是
溶液的作用是___________ (用化学方程式表示)。
②为了减小实验误差,在每次读数前需要进行的操作是___________ 、___________ 。
③该小组记录的实验数据如下:样品的质量为 ;反应开始前量气管的读数为
;反应开始前量气管的读数为 ;反应结束冷却到室温后量气管的读数为
;反应结束冷却到室温后量气管的读数为 ,已知:室温条件下气体摩尔体积为
,已知:室温条件下气体摩尔体积为 ,则样品中过氧化镁的质量分数为
,则样品中过氧化镁的质量分数为___________  (用含
(用含 的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得
的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得 的质量分数
的质量分数___________ (填“偏大”“偏小”或“无影响”)。
 可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备
可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备 以及含量测定的实验。已知:常温下
以及含量测定的实验。已知:常温下 不溶于水,较稳定,与酸反应生成
不溶于水,较稳定,与酸反应生成 ;加热时会分解生成
;加热时会分解生成 和
和 。
。请回答下列问题:
(1)灼烧。灼烧
 制
制 时,可使用的实验装置有
时,可使用的实验装置有
(2)转化。向
 中先加入稳定剂和
中先加入稳定剂和 溶液,充分反应后,过滤、洗涤、干燥,可得粗品
溶液,充分反应后,过滤、洗涤、干燥,可得粗品 。
。①写出制备
 时发生反应的化学方程式:
时发生反应的化学方程式:②“转化”阶段有大量热量放出,为了提高
 的产率,添加
的产率,添加 溶液时,比较理想的操作方法为
溶液时,比较理想的操作方法为(3)测定。某研究小组拟用下图装置测定样品(含
 杂质)中
杂质)中 的含量。
的含量。
①实验时在稀盐酸中加入
 溶液的作用是
溶液的作用是②为了减小实验误差,在每次读数前需要进行的操作是
③该小组记录的实验数据如下:样品的质量为
 ;反应开始前量气管的读数为
;反应开始前量气管的读数为 ;反应结束冷却到室温后量气管的读数为
;反应结束冷却到室温后量气管的读数为 ,已知:室温条件下气体摩尔体积为
,已知:室温条件下气体摩尔体积为 ,则样品中过氧化镁的质量分数为
,则样品中过氧化镁的质量分数为 (用含
(用含 的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得
的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得 的质量分数
的质量分数
您最近半年使用:0次
2023-10-06更新
|
794次组卷
|
5卷引用:安徽省巢湖市第一中学2024届高三10月月考化学试题
名校
6 . 在硫酸工业中,通过下列反应使SO2氧化为SO3:2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是___________ 。
(2)在实际生产中,选定的温度为400℃~500℃,原因是___________
(3)在实际生产中,采用的压强为常压,原因是___________
(4)在实际生产中,通入过量的空气,原因是___________
(5)尾气中的SO2必须回收,原因是___________ 。
(6)在550℃、1MPa下,若SO2的起始浓度为2mol/L,O2的起始浓度为1mol/L,试求该条件下的平衡常数K=___________ 。
 2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 95.0 | 97.7 | 98.3 |
(2)在实际生产中,选定的温度为400℃~500℃,原因是
(3)在实际生产中,采用的压强为常压,原因是
(4)在实际生产中,通入过量的空气,原因是
(5)尾气中的SO2必须回收,原因是
(6)在550℃、1MPa下,若SO2的起始浓度为2mol/L,O2的起始浓度为1mol/L,试求该条件下的平衡常数K=
您最近半年使用:0次
名校
解题方法
7 . 工业上制备硫酸的一步重要反应是 在400~500℃下的催化氧化反应:
在400~500℃下的催化氧化反应:
 。下列有关说法错误的是
。下列有关说法错误的是
 在400~500℃下的催化氧化反应:
在400~500℃下的催化氧化反应:
 。下列有关说法错误的是
。下列有关说法错误的是A.常通入过量的空气,以提高 的平衡转化率 的平衡转化率 |
| B.为提高反应速率和平衡转化率,采用的压强越大越好 |
| C.控制温度为400~500℃既能提升反应速率,又能使催化剂有较高的活性 |
| D.要综合考虑影响速率与平衡的各种因素、设备条件和经济成本等,寻找适宜的生产条件 |
您最近半年使用:0次
2023-08-12更新
|
404次组卷
|
8卷引用:安徽省六安市裕安区新安中学2023-2024学年高二下学期第一次月考化学试题
安徽省六安市裕安区新安中学2023-2024学年高二下学期第一次月考化学试题河南省周口市无锡天一企业管理有限公司等2校2022-2023学年高二上学期12月期末考试化学试题山东省鄄城县第一中学2023-2024学年高二上学期9月月考化学试题黑龙江省哈尔滨市第一中学校2023-2024学年高二上学期第一次质量检测化学试题(已下线)专题05 化学反应的方向 化学反应的调控 -【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)天津市天津中学2023-2024学年高二上学期第一次月考化学试题(已下线)寒假作业04 化学反应的方向及调控-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)四川省宜宾市叙州区第二中学校2023-2024学年高二上学期12月月考化学试题
解题方法
8 . 硫氰化钾(KSCN)可用作洗涤剂中的缓蚀剂,也常用作分析试剂,用于鉴定三价铁、铜、银等。某小组以二硫化碳(CS2)和液氨为原料制备KSCN晶体:将固体催化剂、二硫化碳和稍过量的液氨在反应釜中混合,在5.88×105Pa、100℃下,反应20h,再经减压脱硫蒸发转化等步骤制得KSCN产品,其实验流程如下。

已知:i.NH4SCN在高于170℃时易分解。
ii.(NH4)2CO3在105℃时分解为NH3和CO2。
请回答下列问题:
(1)反应釜中,除生成NH4SCN外,还有一种产物(属于无氧酸式盐)。
①NH4SCN中阴、阳离子的空间构型依次为___________ 和___________ 。
②写出反应釜中主要反应的化学方程式:___________ 。
③反应釜中温度越高越易反应,但控制温度不过高的原因是___________ 。
(2)写出步骤I减压脱硫蒸发的化学方程式:___________ 。
(3)步骤Ⅱ中,工业上用K2CO3溶液而不用KOH溶液的原因有两种:一是K2CO3比KOH便宜;二是有效降低KSCN中K2S杂质的含量,试分析K2CO3能降低K2S杂质含量的原因是___________ 。
(4)实验流程中可以循环使用的物质除催化剂外,还有___________ 。(填化学式)。
(5)用KSCN滴定法可以测定银的含量,其步骤如下:称取0.2000g粗银(假设杂质不参与反应),加入10mL6mol·L-1硝酸中加热溶解,煮沸后,用蒸馏水稀释至100mL并转移至锥形瓶中,加入5mL硫酸铁铵溶液[NH4Fe(SO4)2]作指示剂,用0.1mol·L-1KSCN标准溶液滴定,至终点时消耗18mLKSCN标准溶液。
已知:i.氮的氧化物遇KSCN溶液呈红色。
ii.SCN—+Ag+=AgSCN↓(白色)。
①实验步骤中“煮沸”的目的是___________ 。
②滴定终点的标志是:加入最后半滴标准溶液时,___________ 。
③粗银中Ag的质量分数为___________ %。

已知:i.NH4SCN在高于170℃时易分解。
ii.(NH4)2CO3在105℃时分解为NH3和CO2。
请回答下列问题:
(1)反应釜中,除生成NH4SCN外,还有一种产物(属于无氧酸式盐)。
①NH4SCN中阴、阳离子的空间构型依次为
②写出反应釜中主要反应的化学方程式:
③反应釜中温度越高越易反应,但控制温度不过高的原因是
(2)写出步骤I减压脱硫蒸发的化学方程式:
(3)步骤Ⅱ中,工业上用K2CO3溶液而不用KOH溶液的原因有两种:一是K2CO3比KOH便宜;二是有效降低KSCN中K2S杂质的含量,试分析K2CO3能降低K2S杂质含量的原因是
(4)实验流程中可以循环使用的物质除催化剂外,还有
(5)用KSCN滴定法可以测定银的含量,其步骤如下:称取0.2000g粗银(假设杂质不参与反应),加入10mL6mol·L-1硝酸中加热溶解,煮沸后,用蒸馏水稀释至100mL并转移至锥形瓶中,加入5mL硫酸铁铵溶液[NH4Fe(SO4)2]作指示剂,用0.1mol·L-1KSCN标准溶液滴定,至终点时消耗18mLKSCN标准溶液。
已知:i.氮的氧化物遇KSCN溶液呈红色。
ii.SCN—+Ag+=AgSCN↓(白色)。
①实验步骤中“煮沸”的目的是
②滴定终点的标志是:加入最后半滴标准溶液时,
③粗银中Ag的质量分数为
您最近半年使用:0次
解题方法
9 . 下列说法错误的是
| A.合成氨反应采取循环操作主要是为了提高化学反应速率 |
B.  、 、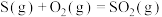  ,则 ,则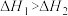 |
C.反应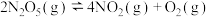  ,能自发进行的原因是 ,能自发进行的原因是 |
D.一定温度下,对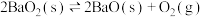 平衡体系缩小体积,再次达到平衡时 平衡体系缩小体积,再次达到平衡时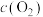 不变 不变 |
您最近半年使用:0次
2023-02-21更新
|
186次组卷
|
6卷引用:安徽省明光市第二中学2023-2024学年高二上学期期中考试化学试卷
安徽省明光市第二中学2023-2024学年高二上学期期中考试化学试卷 河南省商开大联考2022~2023学年高二上学期期末考试化学试题(已下线)专题05 化学反应的方向 化学反应的调控 -【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)河北省沧州市2023-2024学年高二上学期12月月考化学试题江西省部分学校2023-2024学年高二下学期开学考试化学试题陕西省榆林市府谷县府谷中学2023-2024学年高二下学期开学化学试题
名校
10 . 哈伯工业合成氨的流程如图,为提高原料平衡转化率采取的措施是
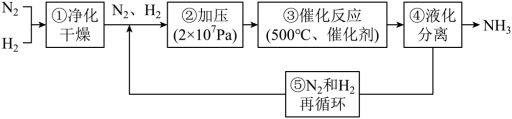

| A.①②③④⑤ | B.②③④⑤ | C.②④⑤ | D.②③④ |
您最近半年使用:0次
2022-10-21更新
|
176次组卷
|
18卷引用:安徽省宣城市2018-2019学年高二下学期期末考试化学试题
安徽省宣城市2018-2019学年高二下学期期末考试化学试题山西省长治市第二中学2019-2020学年高二上学期12月月考化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第四节 化学反应的调控 方法帮山东省淄博市沂源县第二中学2020-2021学年高二下学期期中考试化学试题江西省九江市第一中学2021-2022学年高二上学期第一次月考化学试题山西省长治市第二中学校2021-2022学年高二上学期第一次月考化学试题(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省齐齐哈尔市第八中学2022-2023学年高二上学期10月月考化学试题重庆市南川中学2022-2023学年高二上学期第一学月考试化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题山西省太原市2019-2020学年高二上学期期中测评化学试题天津市部分区2022-2023 学年高三上学期1月期末考试化学试题广东省湛江市第二十一中学2022-2023学年高二上学期期中考试化学试题第二章 化学反应速率与化学平衡 第四节 化学反应的调控河南省濮阳市第一高级中学2023-2024学年高二上学期9月月考化学试题四川省内江市威远中学校2023-2024学年高二上学期期中考试化学试题四川省内江市威远中学校2023-2024学年高二上学期第二次月考(期中)化学试卷湖北省武汉市重点中学5G联合体2023-2024学年高二上学期期中考试化学试题



