名校
解题方法
1 . 使用SNCR脱硝技术的原理是6NO(g)+4NH3(g) 5N2(g)+6H2O(g),如图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果。下列说法正确的是
5N2(g)+6H2O(g),如图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果。下列说法正确的是

 5N2(g)+6H2O(g),如图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果。下列说法正确的是
5N2(g)+6H2O(g),如图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果。下列说法正确的是
| A.从图1判断,该反应的正反应方向是放热反应 |
| B.从图2判断,减少氨气的浓度有助于提高NO的转化率 |
| C.从图1判断,脱硝的最佳温度约为900℃ |
| D.从图2判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为1.5-2.0 |
您最近一年使用:0次
2021-12-13更新
|
167次组卷
|
2卷引用:安徽省亳州市第二中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
2 . 工业炼铁是在高炉中进行的,高炉炼铁的主要反应是:①2C(焦炭)+O2(空气)  2CO;②Fe2O3+3CO
2CO;②Fe2O3+3CO 2Fe+3CO2。该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需。其主要原因是
2Fe+3CO2。该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需。其主要原因是
 2CO;②Fe2O3+3CO
2CO;②Fe2O3+3CO 2Fe+3CO2。该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需。其主要原因是
2Fe+3CO2。该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需。其主要原因是| A.CO过量 | B.CO与铁矿石接触不充分 |
| C.炼铁高炉的高度不够 | D.上述反应有一定的限度 |
您最近一年使用:0次
2021-05-13更新
|
772次组卷
|
18卷引用:安徽省亳州市第五完全中学2021-2022学年高二上学期期中考试化学试题
安徽省亳州市第五完全中学2021-2022学年高二上学期期中考试化学试题(已下线)09-10年湖北潜江文昌高中高一下学期期末总复习化学试题(已下线)2013-2014黑龙江省哈六中高一下学期期末考试化学试卷山东省临沂市蒙阴县实验中学2016-2017学年高一下学期第二次月考(期末模拟)化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高一下学期期中考试化学试题辽宁省沈阳市城郊市重点联合体2019-2020学年高一上学期第二次月考化学试题山东省济宁市汶上圣泽中学2019-2020学年高一下学期第二次月考化学试题(已下线)2.2.2 化学平衡状态(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)(已下线)第七章 能力提升检测卷-2021年高考化学一轮复习讲练测专题9 第一单元 金属的冶炼方法-高中化学必修第二册苏教版2019福建省福州第一中学2020-2021学年高一下学期期中考化学试题北京市第十三中学2020~2021学年高一下学期期中考试化学试题(已下线)专题11 开发利用金属矿物和海水资源【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)(已下线)6.2.2 化学反应的限度-2021-2022学年高一化学课后培优练(人教版2019必修第二册)(已下线)第16讲 金属材料与合金(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )贵州省黔东南州2020-2021学年高一下学期期末考试化学试题海南中学美伦校区2022-2023学年高一下学期期末考试化学试题 6.2.2 化学反应的限度 随堂练习
名校
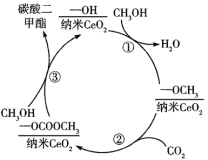
3 . 碳酸二甲酯(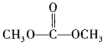 )是一种低毒、环保、性能优异、具有优良发展前景的“绿色”化工产品。纳米CeO2催化CO2和CH3OH合成碳酸二甲酯的示意图如图所示,下列说法正确的是
)是一种低毒、环保、性能优异、具有优良发展前景的“绿色”化工产品。纳米CeO2催化CO2和CH3OH合成碳酸二甲酯的示意图如图所示,下列说法正确的是
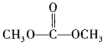 )是一种低毒、环保、性能优异、具有优良发展前景的“绿色”化工产品。纳米CeO2催化CO2和CH3OH合成碳酸二甲酯的示意图如图所示,下列说法正确的是
)是一种低毒、环保、性能优异、具有优良发展前景的“绿色”化工产品。纳米CeO2催化CO2和CH3OH合成碳酸二甲酯的示意图如图所示,下列说法正确的是
| A.CeO2可有效提高CH3OH的平衡转化率 | B.反应①中有O-H键的断裂 |
| C.反应②可以看作是取代反应 | D.上述转化过程中,中间产物有4种 |
您最近一年使用:0次
2021-02-08更新
|
599次组卷
|
5卷引用:安徽省涡阳县育萃高级中学2020-2021学年高二下学期第一次月考化学试题
名校
解题方法
4 . 我国科研人员在银催化简单烷烃的区域选择性方面取得了重要突破,有效克服烷烃 键的惰性并实现其区域选择性活化。一种对烷烃
键的惰性并实现其区域选择性活化。一种对烷烃 键的选择性插入反应进程如图所示。下列说法正确的是
键的选择性插入反应进程如图所示。下列说法正确的是

 键的惰性并实现其区域选择性活化。一种对烷烃
键的惰性并实现其区域选择性活化。一种对烷烃 键的选择性插入反应进程如图所示。下列说法正确的是
键的选择性插入反应进程如图所示。下列说法正确的是
| A.Ⅰ、Ⅱ、Ⅲ三种物质中,最稳定的是Ⅱ |
| B.总反应速率取决于由中间体1生成中间体2的一步 |
| C.升高温度三个反应的速率均加快,有利于提高烷烃的转化率 |
| D.催化剂对化学反应具有选择性,生成不同产物的同时改变了反应的焓变 |
您最近一年使用:0次
2021-01-27更新
|
422次组卷
|
4卷引用:安徽省涡阳县育萃高级中学2020-2021学年高二下学期第一次月考化学试题
解题方法
5 . “丁烯裂解法” 是另一种生产丙烯的方法,但生产过程中伴有生成乙烯的副反应发生,具体反应如下:主反应:3C4H8 4C3H6,副反应:C4H8
4C3H6,副反应:C4H8 2C2H4,下图是平衡时各物质的百分含量随温度或压强的变化趋势:
2C2H4,下图是平衡时各物质的百分含量随温度或压强的变化趋势:
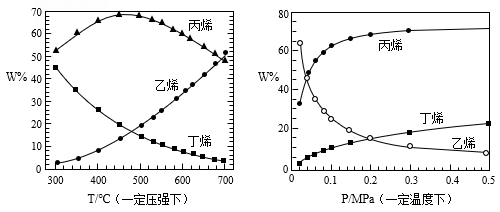
从产物纯度的角度考虑,丙烯和乙烯的质量比越高越好,则下列反应条件最适宜的是
 4C3H6,副反应:C4H8
4C3H6,副反应:C4H8 2C2H4,下图是平衡时各物质的百分含量随温度或压强的变化趋势:
2C2H4,下图是平衡时各物质的百分含量随温度或压强的变化趋势:
从产物纯度的角度考虑,丙烯和乙烯的质量比越高越好,则下列反应条件最适宜的是
| A.300℃ 0.1 MPa | B.700 ℃ 0.1 MPa |
| C.300℃ 0.5 MPa | D.700℃ 0.5 MPa |
您最近一年使用:0次
解题方法
6 . 新能源汽车的大力推广,带动锂电池材料的发展。我国科学家研发出利用钛铁矿(主要成分为 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备锂离子电极材料—
等杂质)制备锂离子电极材料— 和
和 的工艺流程如下:
的工艺流程如下:

回答下列问题:
(1) 中,Fe元素的化合价为
中,Fe元素的化合价为____________ 。
(2)“酸浸”后,钛主要以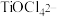 形式存在,写出
形式存在,写出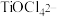 水解的的离子方程式
水解的的离子方程式_________________ 。
(3)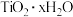 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
分析高于40℃时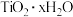 转化率下降的原因
转化率下降的原因_______________ 。
(4) 中Ti的化合价为
中Ti的化合价为 ,其中过氧键的数目为
,其中过氧键的数目为_____________ 。
(5)滤液②中加入双氧水和磷酸,反应生成 的离子方程式为
的离子方程式为____________ ;若测得Fe3+沉淀完全后,溶液中 为
为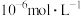 ,则常温下溶液的pH=
,则常温下溶液的pH=______________ 。(已知 的
的 )
)
(6)从滤液②中得到 沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法
沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法_________________________________________ 。
 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备锂离子电极材料—
等杂质)制备锂离子电极材料— 和
和 的工艺流程如下:
的工艺流程如下:
回答下列问题:
(1)
 中,Fe元素的化合价为
中,Fe元素的化合价为(2)“酸浸”后,钛主要以
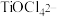 形式存在,写出
形式存在,写出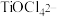 水解的的离子方程式
水解的的离子方程式(3)
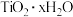 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
沉淀与双氧水、氨水反应40min所得实验结果如下表所示:| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
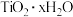 转化率/% 转化率/% | 92 | 95 | 97 | 93 | 88 |
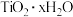 转化率下降的原因
转化率下降的原因(4)
 中Ti的化合价为
中Ti的化合价为 ,其中过氧键的数目为
,其中过氧键的数目为(5)滤液②中加入双氧水和磷酸,反应生成
 的离子方程式为
的离子方程式为 为
为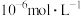 ,则常温下溶液的pH=
,则常温下溶液的pH= 的
的 )
)(6)从滤液②中得到
 沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法
沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法
您最近一年使用:0次
解题方法
7 . 工业上可在高纯度氨气下,通过球磨氢化锂的方式合成高纯度的储氢材料氨基锂,该过程中发生反应:LiH(s)+NH3(g)=LiNH2(s)+H2 (g)。如图表示在0.3 MPa下,不同球磨时间的目标产物LiNH2的相对纯度变化曲线。下列说法正确的是


| A.工业生产中,在0.3 MPa下合成LiNH2的最佳球磨时间是2.0 h |
| B.投入定量的反应物,平衡时混合气体的平均摩尔质量越大,LiNH2的相对纯度越高 |
| C.在0.3 MPa下,若平衡时H2的物质的量分数为60%,则该反应的平衡常数K=1.5 |
| D.LiH和LiNH2都能在水溶液中稳定存在 |
您最近一年使用:0次
2020-02-09更新
|
194次组卷
|
2卷引用:安徽省亳州市涡阳县育萃高级中学2021-2022学年高二上学期第一次月考化学试题
真题
名校
8 . 据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
 CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是| A.使用Cu-Zn-Fe催化剂可大大提高生产效率 |
| B.反应需在300℃进行可推测该反应是吸热反应 |
| C.充入大量CO2气体可提高H2的转化率 |
| D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率 |
您最近一年使用:0次
2019-01-30更新
|
614次组卷
|
45卷引用:安徽省亳州市第十八中学2019-2020学年高二上学期第一次月考化学试题
安徽省亳州市第十八中学2019-2020学年高二上学期第一次月考化学试题2010年全国普通高等学校招生统一考试上海卷化学试题(已下线)2010年6月浙江省金温七校高二化学期末卷2010年高考化学试题分项专题七 化学反应中的能量变化2010年高考化学试题分项专题八 化学反应速率和化学平衡(已下线)2010年黑龙江省双鸭山一中高三上学期期中考试(化学)(已下线)2011届上海市吴淞中学高三上学期期中考试化学试卷(已下线)2011-2012年广东省汕头市金山中学高二上学期期中考试化学试卷(理科)(已下线)2013-2014学年广东省执信中学高二上学期期中考试理科化学试卷2014-2015学年甘肃省武威六中高二上学期第二次月考化学试卷2014-2015学年江西省高安中学高一重点班下期末化学试卷2016届江西省上饶市余干二中高三上学期教学质检化学试卷2015-2016学年山东省淄博市淄川一中等三校高二上期末联考化学试卷2015-2016学年辽宁师大附中高一下学期6月月考化学试卷2016-2017学年河南省师大附中高二上期中化学试卷上海市格致中学2016-2017学年高一下学期第二次测验化学试题山西省大同市第一中学2017-2018学年高二上学期期中考试化学试题天津市红桥区2017-2018学年高二上学期期末考试化学试题新疆昌吉市2017-2018学年高二上学期期末考试化学试题【全国百强校】北京101中学2017-2018学年高二下学期期中考试化学试题吉林省长春市田家炳实验中学2018-2019学年高二上学期第一学程检测化学试题【全国百强校】贵州省思南中学2018-2019学年高二上学期期中考试化学试题新疆乌鲁木齐市二十三中学2018-2019学年高二10月月考化学试题湖南省永州市东安县第一中学2019-2020学年高二上学期第一次月考化学试题江西省南城县第二中学2018-2019学年高二上学期第二次月考化学试题山西省朔州市怀仁县第一中学2018-2019学年高二上学期第二次月考化学试题2020届高三化学选修4二轮专题练——焓变及反应热综合【选择精编25题】贵州省长顺县二中2019-2020学年高二上学期期末考试化学试题山西省忻州市第一中学2019-2020学年高一4月月考化学试题河北省黄骅中学2020-2021学年高二上学期第一次月考化学试题湖南省娄底市第一中学2020-2021学年高二上学期期中考试化学(高考班)试题湖北省汉川市第二中学2020-2021学年高二上学期期中考试化学试题江苏省镇江市第一中学2020-2021学年高二下学期4月分阶段测化学试题河南省南阳市一中2021-2022学年高二上学期第一次月考化学试题山西省运城市康杰中学2021-2022学年高二上学期期中化学试题浙江省山河联盟2021-2022学年高二上学期12月考试化学试题宁夏银川市第二中学2021-2022学年高二下学期第一次月考化学试题(已下线)2.2.3 浓度、压强对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)河北省唐山市迁西县职业技术教育中心2021-2022学年高二(普职融通部)上学期期中考试化学试题(已下线)化学预测卷(四)-预测卷(浙江专版)湖南省常德市西洞庭管理区第一中学2022-2023学年高二上学期第二次月考化学试题第2课时 温度、浓度对化学平衡的影响江西省乐平中学2022-2023学年高二上学期11月期中考试化学试题(已下线)专题06 化学反应的方向及调控【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)新疆实验中学2023-2024学年高二上学期期中考试化学试题
9 . 氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
(1)实验①和②的目的是______________________ 。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_______________ (填一种即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示。分析该图能够得出的实验结论是_____________________ 。
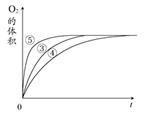
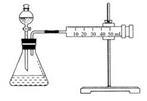
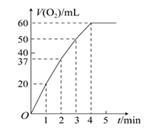
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验。
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量______________________________________ 来比较。
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如下图所示。解释反应速率变化的原因:_______________ 。
(3)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是_________ (填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2%H2O2溶液 | 无 |
| ② | 10 mL 5%H2O2溶液 | 无 |
| ③ | 10 mL 5%H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5%H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5%H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |

(1)实验①和②的目的是
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示。分析该图能够得出的实验结论是

Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验。
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如下图所示。解释反应速率变化的原因:

(3)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
您最近一年使用:0次
2016-12-09更新
|
179次组卷
|
3卷引用:安徽省毫州市涡阳第—中学2021-2022学年高二上学期第一次教学质量检测化学试题



