名校
解题方法
1 . 甲醇是重要的有机化工原料,目前世界甲醇年产量超过2.1×107吨,在能源紧张的今天,甲醇的需求也在增大。甲醇的合成方法是:
(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH=-90.1kJ·mol-1
另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
(ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0kJ·mol-1
回答下列问题:
(1)甲醇的燃烧热为__ kJ·mol-1。
(2)在碱性条件下利用一氯甲烷(CH3Cl)水解也可制备少量的甲醇,该反应的化学方程式为__ 。
(3)若反应在密闭恒容绝热容器中进行,反应(iv)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.1kJ·mol-1对合成甲醇反应中CO的转化率的影响是( )
a.增大 b.减小 c.无影响 d.无法判断
(4)在恒温恒容的密闭容器中发生反应(ⅰ),各物质的浓度如下表:
①x=__ 。
②前2min内H2的平均反应速率为v(H2)=__ 。该温度下,反应(ⅰ)的平衡常数K=__ 。(保留1位小数)
③反应进行到第2min时,改变了反应条件,改变的这个条件可能是( )
a.使用催化剂 b.降低温度 c.增加H2的浓度
(5)如图是温度、压强与反应(ⅰ)中CO转化率的关系:

由图象可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400℃和10MPa的条件,其原因是__ 。
(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH=-90.1kJ·mol-1
另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
(ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0kJ·mol-1
回答下列问题:
(1)甲醇的燃烧热为
(2)在碱性条件下利用一氯甲烷(CH3Cl)水解也可制备少量的甲醇,该反应的化学方程式为
(3)若反应在密闭恒容绝热容器中进行,反应(iv)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.1kJ·mol-1对合成甲醇反应中CO的转化率的影响是
a.增大 b.减小 c.无影响 d.无法判断
(4)在恒温恒容的密闭容器中发生反应(ⅰ),各物质的浓度如下表:
| 浓度/mol·L-1 时间/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | x | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
①x=
②前2min内H2的平均反应速率为v(H2)=
③反应进行到第2min时,改变了反应条件,改变的这个条件可能是
a.使用催化剂 b.降低温度 c.增加H2的浓度
(5)如图是温度、压强与反应(ⅰ)中CO转化率的关系:

由图象可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400℃和10MPa的条件,其原因是
您最近一年使用:0次
名校
解题方法
2 . 在防治新冠肺炎的工作中,过氧乙酸(CH3COOOH)是众多消毒剂中的一种。过氧乙酸具有强氧化能力,可将各种病原微生物杀灭。其性质不稳定,遇热易分解。某同学利用高浓度的双氧水和冰醋酸制备少量过氧乙酸并进行相关实验。
I.过氧乙酸的制备.
向100mL的三颈烧瓶中加入25mL冰醋酸,滴加42.5%双氧水15mL,之后加入一定量浓硫酸,维持反应温度为40℃,磁力搅拌4h后,室温静置12h。
(1)三颈烧瓶中制取过氧乙酸的反应方程式为____ 。
(2)资料显示浓硫酸的用量对制得的过氧乙酸的质量分数有较为明显的影响,如图所示。根据图中数据分析本实验中浓硫酸的用量应为____ (填字母)。
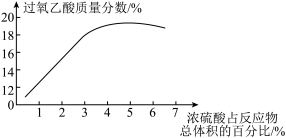
a 1.5mL-2.0mL b 3.5mL-4.0mL C 5.5mL-6.0mL
II.过氧乙酸质量分数的测定
准确称取1.00g过氧乙酸样液,定容子100mL容量瓶中,取其中10.00mL溶液调pH后,用KMnO4标准溶液滴定至溶液出现浅红色,以除去过氧乙酸试样中剩余的H2O2,再加入过量KI溶液,摇匀,用0.0200mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液25.00mL。(已知: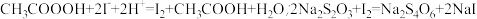 )。
)。
(3)加入过量KI溶液前,需除去H2O2的原因是____ (用离子方程式表示)。
(4)滴定时所选指示剂为____ ;制得过氧乙酸溶液中过氧乙酸质量分数为____ %。
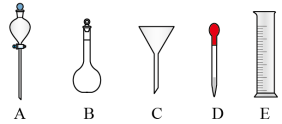
(5)过氧乙酸用于消毒时,要将原液稀释到0.2%-0.5%之间。若实验室配制1000mL过氧乙酸稀溶液时,除需使用烧杯和玻璃棒外,还要用到以下哪些仪器____ (填标号)。
I.过氧乙酸的制备.
向100mL的三颈烧瓶中加入25mL冰醋酸,滴加42.5%双氧水15mL,之后加入一定量浓硫酸,维持反应温度为40℃,磁力搅拌4h后,室温静置12h。
(1)三颈烧瓶中制取过氧乙酸的反应方程式为
(2)资料显示浓硫酸的用量对制得的过氧乙酸的质量分数有较为明显的影响,如图所示。根据图中数据分析本实验中浓硫酸的用量应为

a 1.5mL-2.0mL b 3.5mL-4.0mL C 5.5mL-6.0mL
II.过氧乙酸质量分数的测定
准确称取1.00g过氧乙酸样液,定容子100mL容量瓶中,取其中10.00mL溶液调pH后,用KMnO4标准溶液滴定至溶液出现浅红色,以除去过氧乙酸试样中剩余的H2O2,再加入过量KI溶液,摇匀,用0.0200mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液25.00mL。(已知:
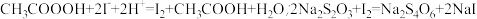 )。
)。(3)加入过量KI溶液前,需除去H2O2的原因是
(4)滴定时所选指示剂为
(5)过氧乙酸用于消毒时,要将原液稀释到0.2%-0.5%之间。若实验室配制1000mL过氧乙酸稀溶液时,除需使用烧杯和玻璃棒外,还要用到以下哪些仪器

您最近一年使用:0次
2020-03-10更新
|
465次组卷
|
3卷引用:安徽省太和第一中学2019-2020学年高二下学期教学衔接调研考试(超越班)化学试题
安徽省太和第一中学2019-2020学年高二下学期教学衔接调研考试(超越班)化学试题贵州省2020届高三3月“阳光校园.空中黔课”阶段检测化学试题(已下线)2022年新高考化学时事热点情境化考题---实验装置题
3 . 水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________ H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________ (填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。
标注。
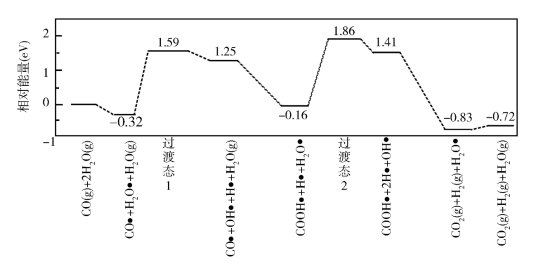
可知水煤气变换的ΔH________ 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________ eV,写出该步骤的化学方程式_______________________ 。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。
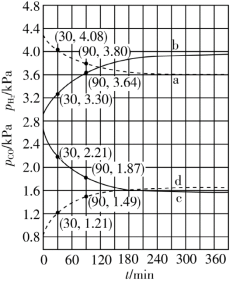
计算曲线a的反应在30~90 min内的平均速率 (a)=
(a)=___________ kPa·min−1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________ 、___________ 。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________ 、___________ 。
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用
 标注。
标注。
可知水煤气变换的ΔH
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。

计算曲线a的反应在30~90 min内的平均速率
 (a)=
(a)=
您最近一年使用:0次
2019-06-09更新
|
19205次组卷
|
20卷引用:安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题
安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题2019年全国统一考试化学试题(新课标Ⅰ)(已下线)专题09 反应速率、化学平衡——2019年高考真题和模拟题化学分项汇编(已下线)专题7.1 化学反应速率(讲)-《2020年高考一轮复习讲练测》(已下线)专题7.1 化学反应速率(练)-《2020年高考一轮复习讲练测》福建省泉州市泉港区第一中学2019-2020学年高二上学期第二次月考化学试题湖南省株洲市茶陵二中2020届高三上学期第二次月考化学试题专题2.2 化学反应速率和化学平衡(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题6.3 化学原理题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2章 综合检测高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二章素养检测人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 过高考 3年真题强化闯关鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记江苏省盱眙中学2021-2022学年高二上学期第三次学情调研化学试题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)专题15化学反应原理综合-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题17 原理综合题(已下线)T28-原理综合题2018-2019学年度耀华实验学校第二学期高二实验化学期末试卷
名校
解题方法
4 . 汽车尾气和燃煤尾气是造成空气污染的重要原因之一,治理汽车尾气和燃煤尾气是环境保护的重要课题。回答下列问题:
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;②N2(g)+2O2(g)= 2NO2(g) △H=+67.8 kJ/mol;③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol则CH4催化还原NO的热化学方程式为___________________ 。
(2)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g) 2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
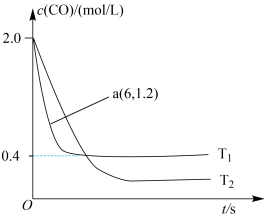
①据此判断该反应的正反应为__________ (填“放热”或“吸热”)反应。
②温度T1时,该反应的平衡常数K=___________ ;反应速率v=v正-v逆=k正c2(NO)c2(CO)-k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处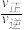 =
=______________ 。
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素作还原剂,其基本流程如图:

①SNCR-SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0,则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为_________________ 。
②体系温度直接影响SNCR技术的脱硝效率,如图所示:
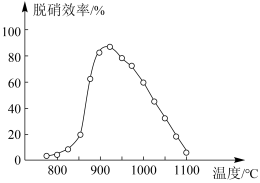
SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是_________________ ;当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是_____________________ 。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;②N2(g)+2O2(g)= 2NO2(g) △H=+67.8 kJ/mol;③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol则CH4催化还原NO的热化学方程式为
(2)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g)
 2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
①据此判断该反应的正反应为
②温度T1时,该反应的平衡常数K=
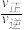 =
=(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素作还原剂,其基本流程如图:

①SNCR-SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0,则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为
②体系温度直接影响SNCR技术的脱硝效率,如图所示:

SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是
您最近一年使用:0次
2019-03-16更新
|
761次组卷
|
3卷引用:安徽省阜阳市第三中学2018-2019学年高一下学期第二次调研考试化学试题
5 . 在下列平衡 (黄色)
(黄色) (橙红色)
(橙红色) 中,溶液介于黄和橙红色之间,现欲增加溶液的橙红色,则要在溶液中加入
中,溶液介于黄和橙红色之间,现欲增加溶液的橙红色,则要在溶液中加入
 (黄色)
(黄色) (橙红色)
(橙红色) 中,溶液介于黄和橙红色之间,现欲增加溶液的橙红色,则要在溶液中加入
中,溶液介于黄和橙红色之间,现欲增加溶液的橙红色,则要在溶液中加入A.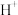 | B.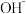 | C. | D. |
您最近一年使用:0次
2019-01-16更新
|
303次组卷
|
17卷引用:安徽省太和县第八中学2021-2022学年高二上学期第一次月考化学试题
安徽省太和县第八中学2021-2022学年高二上学期第一次月考化学试题(已下线)2011-2012年广东省广雅中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年河北省涿州二中高二上学期期中考试化学试卷(已下线)2011-2012学年江西省兴国县将军中学高二上学期期中考试化学试卷(已下线)2013-2014学年陕西省岐山县高二上学期期中质量检测理科化学试卷2014-2015学年广东省深圳市明珠学校高二上学期期中化学试卷2015-2016学年河北省唐山市高二上学期期末考试化学试卷广东省阳东广雅学校2017-2018学年高二10月月考化学试题天津市红桥区2017-2018学年高二上学期期中考试化学试题甘肃省武威第五中学2018-2019学年高二上学期期末考试化学试题甘肃省靖远四中2018-2019学年高二第二学期开学检测化学试题天津市红桥区2020 届高三期末质量检测化学试题福建省莆田第十五中学2019-2020学年高二上学期期末考试化学试题福建省莆田第十五中学2018-2019学年高二上学期期末考试化学试题天津市红桥区2019-2020学年高三上学期期末考试化学试题甘肃省临夏州临夏县中学2021-2022学年高二上学期期中考试化学(B卷)试题甘肃省临夏州临夏县中学2021-2022学年高二上学期期中考试化学(A卷)试题



