解题方法
1 . 下列说法错误的是
| A.合成氨反应采取循环操作主要是为了提高化学反应速率 |
B.  、 、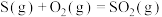  ,则 ,则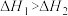 |
C.反应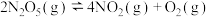  ,能自发进行的原因是 ,能自发进行的原因是 |
D.一定温度下,对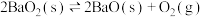 平衡体系缩小体积,再次达到平衡时 平衡体系缩小体积,再次达到平衡时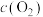 不变 不变 |
您最近一年使用:0次
2023-02-21更新
|
189次组卷
|
6卷引用:安徽省明光市第二中学2023-2024学年高二上学期期中考试化学试卷
安徽省明光市第二中学2023-2024学年高二上学期期中考试化学试卷 河南省商开大联考2022~2023学年高二上学期期末考试化学试题(已下线)专题05 化学反应的方向 化学反应的调控 -【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)河北省沧州市2023-2024学年高二上学期12月月考化学试题江西省部分学校2023-2024学年高二下学期开学考试化学试题陕西省榆林市府谷县府谷中学2023-2024学年高二下学期开学化学试题
名校
解题方法
2 . 下列有关反应2SO2+O2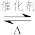 2SO3的说法中不正确的是
2SO3的说法中不正确的是
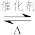 2SO3的说法中不正确的是
2SO3的说法中不正确的是| A.该反应为可逆反应,故在一定条件下二氧化硫与氧气不可能全部转化为三氧化硫 |
| B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零 |
| C.一定条件下,向某密闭容器中加入2molSO2和1molO2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等 |
| D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题 |
您最近一年使用:0次
2021-04-28更新
|
158次组卷
|
11卷引用:安徽省滁州市定远县育才学校2020-2021学年高一下学期期中考试化学试题
安徽省滁州市定远县育才学校2020-2021学年高一下学期期中考试化学试题(已下线)2010-2011学年山西省临汾一中高一下学期期中考试化学试卷(已下线)2011-2012学年云南省开远四中高一下学期期中考试化学试卷(已下线)2011-2012学年河北省邢台一中高一下学期期末考试化学试卷2015-2016学年贵州遵义航天中学高二上第三次月考化学卷《课时同步君》2017-2018学年高一化学人教必修2-2.3.2 化学反应的限度(已下线)2018年12月27日 《每日一题》人教选修4-可逆反应黑龙江省哈尔滨市第六中学校2019-2020学年高一下学期返校适应训练化学试题天津市两校联考2021-2022学年高二上学期第二次质量检测化学试题河北省张家口市第一中学2021-2022学年高二上学期10月月考化学试题(已下线)6.2.2 化学平衡(第2课时 化学平衡移动)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)
3 . 某酸性工业废水中含有 。光照下,草酸(
。光照下,草酸( )能将其中的
)能将其中的 今转化为
今转化为 。某课题组研究发现,少量铁明矾
。某课题组研究发现,少量铁明矾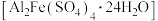 能对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
能对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度的草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度的草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
测得实验①和②溶液中的 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
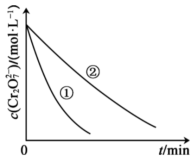
(2)实验①和②的结果表明___________ 对该反应的速率有影响。
(3)该课题组对铁明矾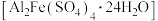 中起催化作用的成分提出如下假设(请你完成假设二和假设三):
中起催化作用的成分提出如下假设(请你完成假设二和假设三):
假设一: 起催化作用;
起催化作用;
假设二:___________ ;
假设三:___________ ;……
(4)请你设计实验验证上述假设一完成下表中内容[除了上述实验提供的试剂外,可供选择的药品有 、
、 、
、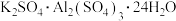 、
、 等。溶液中
等。溶液中 的浓度可用仪器测定]。
的浓度可用仪器测定]。
 。光照下,草酸(
。光照下,草酸( )能将其中的
)能将其中的 今转化为
今转化为 。某课题组研究发现,少量铁明矾
。某课题组研究发现,少量铁明矾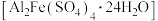 能对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
能对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25
 下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度的草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度的草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 10 | 30 | |
| ② | 5 | 60 | 10 | |
| ③ | 60 | 20 |
测得实验①和②溶液中的
 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(2)实验①和②的结果表明
(3)该课题组对铁明矾
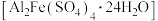 中起催化作用的成分提出如下假设(请你完成假设二和假设三):
中起催化作用的成分提出如下假设(请你完成假设二和假设三):假设一:
 起催化作用;
起催化作用;假设二:
假设三:
(4)请你设计实验验证上述假设一完成下表中内容[除了上述实验提供的试剂外,可供选择的药品有
 、
、 、
、 、
、 等。溶液中
等。溶液中 的浓度可用仪器测定]。
的浓度可用仪器测定]。| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 取 | 反应进行相同时间后:若溶液中的 浓度,则假设一成立;若溶液中的 浓度,则假设一成立;若溶液中的 浓度 浓度 |
您最近一年使用:0次
2021-03-09更新
|
131次组卷
|
4卷引用:安徽省滁州九校2021-2022学年高二上学期第四次调研考试化学试题
安徽省滁州九校2021-2022学年高二上学期第四次调研考试化学试题(已下线)2013-2014学年辽宁省沈阳市高二上教学质量监测化学试卷(已下线)2014届辽宁省沈阳市高二上教学质量监测化学试卷 广西南宁市2020-2021学年高二上学期期末考试(原理)化学试题
4 . 氮氧化物(NO、NO2)、SO2是大气污染物。回答下列问题:
(1)污染物对自然环境造成的污染有____________ (写一种即可)。
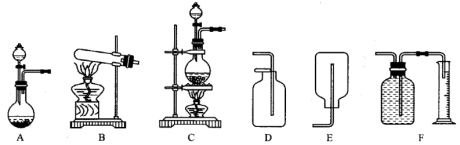
(2)图1包含气体发生装置和收集装置(部分装置的夹持仪器已省略),实验室以Cu与浓HNO3反应制备并收集NO2应选择的装置是____________ (填字母)。
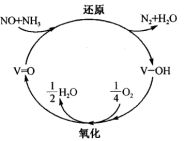
(3)SCR脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达90%以上。催化反应机理如图2所示,写出该反应发生的化学方程式:____________ 。
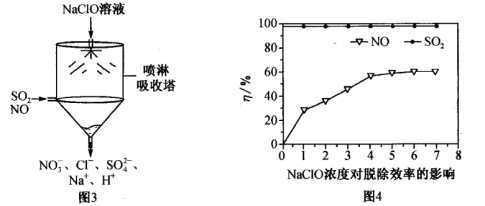
(4)目前,NaClO溶液广泛地应用于脱硫脱硝。
①某课外小组同学设计了如图喷淋吸收塔装置(如图3)。设计该装置的优点是____________ ,脱硝(NO)反应的离子方程式为____________ 。
②如图4为NaClO浓度对脱硫脱硝效率(η/%)的影响。当温度为50℃,溶液的pH=10,c(SO2)=c(NO)=300 mg·m-3,SO2的脱除效率一直维持在98%以上,而NO脱除效率相对较低,其原因是____________ 。
(5)研究表明,ZnO水悬浊液能有效地吸收SO2,然后再经O2催化氧化,可得到硫酸盐。已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO3-,SO32-的物质的量分数(物质的量分数= )随pH的分布如图5所示。
)随pH的分布如图5所示。
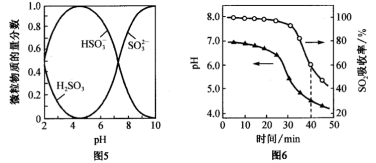
向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40 min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(如图6)。溶液pH几乎不变阶段,主要产物是____________ (填化学式);SO2吸收率迅速降低阶段,主要反应的离子方程式为____________ 。
(1)污染物对自然环境造成的污染有
(2)图1包含气体发生装置和收集装置(部分装置的夹持仪器已省略),实验室以Cu与浓HNO3反应制备并收集NO2应选择的装置是

(3)SCR脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达90%以上。催化反应机理如图2所示,写出该反应发生的化学方程式:

(4)目前,NaClO溶液广泛地应用于脱硫脱硝。
①某课外小组同学设计了如图喷淋吸收塔装置(如图3)。设计该装置的优点是
②如图4为NaClO浓度对脱硫脱硝效率(η/%)的影响。当温度为50℃,溶液的pH=10,c(SO2)=c(NO)=300 mg·m-3,SO2的脱除效率一直维持在98%以上,而NO脱除效率相对较低,其原因是

(5)研究表明,ZnO水悬浊液能有效地吸收SO2,然后再经O2催化氧化,可得到硫酸盐。已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO3-,SO32-的物质的量分数(物质的量分数=
 )随pH的分布如图5所示。
)随pH的分布如图5所示。
向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40 min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(如图6)。溶液pH几乎不变阶段,主要产物是
您最近一年使用:0次
名校
解题方法
5 . 过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面,如图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2) 的流程。
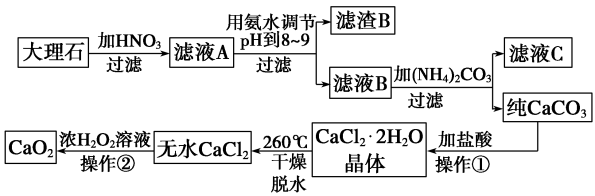
请回答下列问题:
(1)写出加硝酸后反应的离子方程式___________ 。
(2)操作①应包括的步骤是___________ 。
(3)用氨水调节pH至8~9的目的是___________ 。
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中 c( )
)___________ c( )(填“≥”、“≤”、“<”、“>”或“=”)。
)(填“≥”、“≤”、“<”、“>”或“=”)。
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出加氢氧化钠前该反应的化学方程式__________ ;用简要的文字解释用氢氧化钠调节pH至9~11的原因__________ 。
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率________ 。

请回答下列问题:
(1)写出加硝酸后反应的离子方程式
(2)操作①应包括的步骤是
(3)用氨水调节pH至8~9的目的是
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中 c(
 )
) )(填“≥”、“≤”、“<”、“>”或“=”)。
)(填“≥”、“≤”、“<”、“>”或“=”)。(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出加氢氧化钠前该反应的化学方程式
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率
您最近一年使用:0次
2020-09-09更新
|
172次组卷
|
2卷引用:安徽省滁州市定远县民族中学2021-2022学年高三上学期10月教学质量检测化学试题
6 . 1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖。哈伯法合成氨需要20﹣50Mpa的高压和500℃的高温下,用铁作催化剂,且氨的产率为10%~15%。2005年美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2=2NH3,下列有关说法正确的是( )
| A.不同的催化剂对化学反应速率的影响均相同 |
| B.哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
| C.新法合成能在常温下进行是因为不需要断裂化学键 |
| D.新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展愿景 |
您最近一年使用:0次
2019-11-25更新
|
159次组卷
|
2卷引用:安徽省滁州市定远县民族中学2020届高三上学期期中考试化学试题
名校
7 . [安徽省合肥市2019年高三第三次教学质量检测]化工生产与人类进步紧密相联。下列有关说法不正确的是
| A.空气吹出法提取海水中溴通常使用SO2作还原剂 |
| B.侯氏制碱法工艺流程中利用了物质溶解度的差异 |
| C.合成氨采用高温、高压和催化剂主要是提高氢气平衡转化率 |
| D.工业用乙烯直接氧化法制环氧乙烷体现绿色化学和原子经济 |
您最近一年使用:0次
2019-05-18更新
|
1228次组卷
|
7卷引用:安徽省滁州市定远县重点中学2020届高三5月模拟理综化学试题
名校
解题方法
8 . Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:


回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为___________________ 。“酸浸”实验中为了提高酸浸的效率,除了升温还可以采取的措施有___________________ (至少写两种)。
(2)“酸浸”后,“滤液①”钛主要以 形式存在,写出其水解生成TiO2·xH2O的离子方程式
形式存在,写出其水解生成TiO2·xH2O的离子方程式__________________ 。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
分析40 ℃时TiO2·xH2O转化率最高的原因__________________ 。
(4)若“滤液②”中 ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使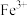 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中 ,此时是否有Mg3(PO4)2沉淀生成?
,此时是否有Mg3(PO4)2沉淀生成?_____________ (列式计算 )。FePO4、Mg3(PO4)2的Ksp分别为 。
。


回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为
(2)“酸浸”后,“滤液①”钛主要以
 形式存在,写出其水解生成TiO2·xH2O的离子方程式
形式存在,写出其水解生成TiO2·xH2O的离子方程式(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40 ℃时TiO2·xH2O转化率最高的原因
(4)若“滤液②”中
 ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使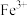 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中 ,此时是否有Mg3(PO4)2沉淀生成?
,此时是否有Mg3(PO4)2沉淀生成? 。
。
您最近一年使用:0次
名校
9 . 在硫酸工业中,通过下列反应使SO2转化为SO3:2SO2+O2 2SO3 ΔH< 0,已知常压下平衡混合气体中SO3的体积分数为91%。试回答:
2SO3 ΔH< 0,已知常压下平衡混合气体中SO3的体积分数为91%。试回答:
(1)在生产中常用过量的空气,是为了________________________________ ;
(2)加热到400 ℃~500 ℃,是由于______________________________________ ;
(3)压强采用________ ,原因是__________________________________________________ ;
(4)常用浓H2SO4来吸收SO3而不用水,是因为__________________________________________ ;
(5)尾气中的SO2必须回收,是为了_______________________________________________________ 。
 2SO3 ΔH< 0,已知常压下平衡混合气体中SO3的体积分数为91%。试回答:
2SO3 ΔH< 0,已知常压下平衡混合气体中SO3的体积分数为91%。试回答:(1)在生产中常用过量的空气,是为了
(2)加热到400 ℃~500 ℃,是由于
(3)压强采用
(4)常用浓H2SO4来吸收SO3而不用水,是因为
(5)尾气中的SO2必须回收,是为了
您最近一年使用:0次
2018-12-10更新
|
140次组卷
|
3卷引用:【校级联考】安徽省滁州市定远县西片区2018-2019学年高二上学期期中考试化学试题
名校
10 . 硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:2SO2(g)+O2(g)  2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是________ 。
(2)反应2SO2(g)+O2(g) 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________ (填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2mol SO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
(3)某温度下, SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。

2.0 molSO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。平衡状态由A变到B时,平衡常数K(A)_____ K(B)(填“>”、“<”或“=”), B点的化学平衡常数是______ 。
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2, t1时刻达到平衡,测得容器中含SO30.18mol。

①tl 时刻达到平衡后,改变一个条件使化学反应速率发生如下图所示的变化,则改变的条件是________ 。
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20mol SO2和0.10molO2,则平衡________ 移动(填“向正反应方向”、“向逆反应方向”或“不”) ,再次达到平衡后,n(SO3)的取值范围是_____________ 。
 2SO3(g)。
2SO3(g)。(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g)
 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2mol SO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
(3)某温度下, SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。

2.0 molSO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。平衡状态由A变到B时,平衡常数K(A)
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2, t1时刻达到平衡,测得容器中含SO30.18mol。

①tl 时刻达到平衡后,改变一个条件使化学反应速率发生如下图所示的变化,则改变的条件是
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20mol SO2和0.10molO2,则平衡
您最近一年使用:0次
2018-11-12更新
|
189次组卷
|
2卷引用:安徽省滁州市定远县育才学校2021-2022学年高二上学期期中考试(实验班)化学试题



