1 . 工业合成氨缓解了有限耕地与不断增长的人口对粮食大量需求之间的矛盾。
(1)N2分子通常条件下非常稳定,其本质原因是___________ ,工业上选择500℃主要出于两方面考虑,一是反应速率快;二是___________ 。
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
结合表中所给信息,下图中能正确表示合成氨反应过程中能量变化关系的是___________。
(3)一定条件下,氨与水的反应存在限度,氨水成弱碱性,用一个化学用语,表示氨与水反应及溶液显碱性的原因___________ 。
(1)N2分子通常条件下非常稳定,其本质原因是
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
| 共价键 | H-H | N≡N | N-H |
| 键能(kJ/mol) | 436 | 946 | 391 |
A. | B. | C.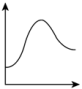 | D.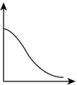 |
您最近一年使用:0次
名校
2 . 合成氨工业对国民经济和社会发展具有重要的意义。
(1) 在不同温度、压强和相同催化剂条件下,初始
在不同温度、压强和相同催化剂条件下,初始 、
、 分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(
分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数( )如图所示。
)如图所示。
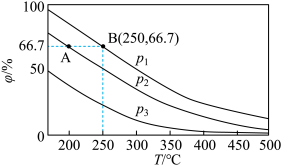
①其中,
___________  (填“>”或“<”),其原因是
(填“>”或“<”),其原因是___________ 。
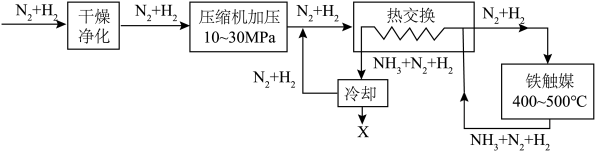
②A、B两点的反应速率: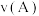
___________ 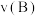 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
③若在250℃、 条件下,反应达到平衡时容器的体积为0.06L,则该条件下合成氨的平衡常数
条件下,反应达到平衡时容器的体积为0.06L,则该条件下合成氨的平衡常数
___________  (保留一位小数)。
(保留一位小数)。
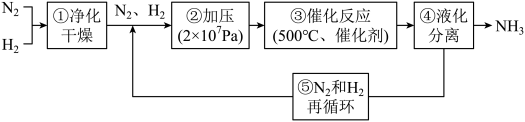
(2)工业合成氨生产流程示意图如下:
①X为___________ 。
②上述流程中,有利于提高原料利用率的措施是___________ (填标号)。
A.“净化干燥” B.“压缩机加压” C.“铁触媒400~500℃” D.原料气循环利用
③“干燥净化”中采用铜氨溶液除去CO:
 如何处理吸收CO后的铜氨溶液,请提出你的建议
如何处理吸收CO后的铜氨溶液,请提出你的建议___________ 。
(1)
 在不同温度、压强和相同催化剂条件下,初始
在不同温度、压强和相同催化剂条件下,初始 、
、 分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(
分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数( )如图所示。
)如图所示。
①其中,

 (填“>”或“<”),其原因是
(填“>”或“<”),其原因是②A、B两点的反应速率:
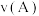
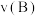 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。③若在250℃、
 条件下,反应达到平衡时容器的体积为0.06L,则该条件下合成氨的平衡常数
条件下,反应达到平衡时容器的体积为0.06L,则该条件下合成氨的平衡常数
 (保留一位小数)。
(保留一位小数)。(2)工业合成氨生产流程示意图如下:

①X为
②上述流程中,有利于提高原料利用率的措施是
A.“净化干燥” B.“压缩机加压” C.“铁触媒400~500℃” D.原料气循环利用
③“干燥净化”中采用铜氨溶液除去CO:

 如何处理吸收CO后的铜氨溶液,请提出你的建议
如何处理吸收CO后的铜氨溶液,请提出你的建议
您最近一年使用:0次
名校
解题方法
3 . 下图为工业合成氨流程图,该反应速率方程为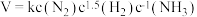 ,原料气(
,原料气( 及少量
及少量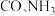 的混合气体)在进入合成塔前可经过铜氨液净化处理,其反应为:
的混合气体)在进入合成塔前可经过铜氨液净化处理,其反应为: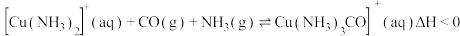 ,有关说法错误的是
,有关说法错误的是
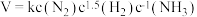 ,原料气(
,原料气( 及少量
及少量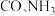 的混合气体)在进入合成塔前可经过铜氨液净化处理,其反应为:
的混合气体)在进入合成塔前可经过铜氨液净化处理,其反应为: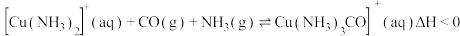 ,有关说法错误的是
,有关说法错误的是
| A.步骤①中“净化”可以防止催化剂中毒 |
| B.步骤②中“加压”既可以提高合成氨原料的转化率,又可以加快反应速率 |
| C.为保证足够高的反应速率,反应达到一定转化率时需及时将氨从体系中分离 |
D.“净化”时适当升高温度,可增大反应速率和 的平衡转化率 的平衡转化率 |
您最近一年使用:0次
名校
解题方法
4 . 2016年中国科学院大连物理研究所的研究团队研制了一种新型催化剂,这是近年来合成氨反应的重要突破。工业合成氨的反应为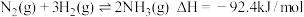 ,下列关于该反应调控的说法不正确的是
,下列关于该反应调控的说法不正确的是
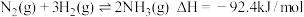 ,下列关于该反应调控的说法不正确的是
,下列关于该反应调控的说法不正确的是| A.实际生产中,及时液化分离出氨可增大反应物的转化率 |
| B.选用该新型催化剂能大幅提高反应物的平衡转化率 |
C.铁触媒在 左右时活性最大,是实际生产中选择 左右时活性最大,是实际生产中选择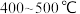 进行的重要原因 进行的重要原因 |
D.实际生产中,采用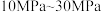 压强,与常压相比,能缩短达平衡所需时间 压强,与常压相比,能缩短达平衡所需时间 |
您最近一年使用:0次
2024-01-21更新
|
212次组卷
|
2卷引用:福建省厦门外国语学校2023-2024学年高二上学期期末模拟考试化学试题
名校
5 . 如下图所示为工业合成氨的流程图。下列说法不正确的是
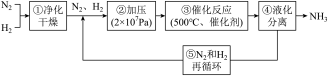

| A.步骤①中“净化”可以防止催化剂中毒 |
| B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 |
| C.步骤③、④、⑤均有利于提高原料平衡的转化率 |
| D.为提高反应物的转化率应及时将氨从混合气中分离出去 |
您最近一年使用:0次
2023-10-26更新
|
327次组卷
|
7卷引用:福建省漳州市东山县2023-2024学年高二上学期期中考试化学试题
名校
解题方法
6 . 以废银(主要含Ag,以及少量SiO2、α-Al2O3杂质)为原料提取高纯度银的流程如图1所示,其他条件相同,浸出率与温度、时间的关系分别如图2和图3所示:
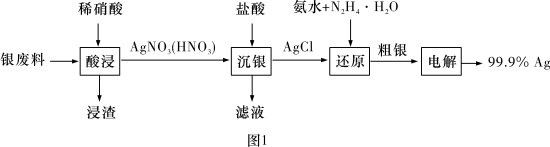
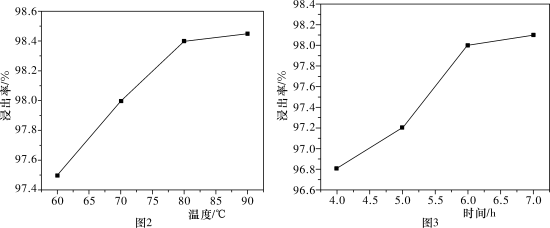
| A.最佳生产条件是温度为80℃、时间为6.0 h |
| B.浸渣的主要成分是SiO2 |
| C.“电解”中向AgNO3溶液中添加少量NaNO3能增强导电性 |
| D.理论上制备21.6 g Ag需要消耗2.5gN2H4·H2O |
您最近一年使用:0次
2023-08-16更新
|
167次组卷
|
2卷引用:福建省福建师范大学附属中学2023-2024学年高三上学期10月月考化学试题
名校
解题方法
7 . 关于合成氨反应
 ,下列说法不正确的是
,下列说法不正确的是

 ,下列说法不正确的是
,下列说法不正确的是| A.使用高效催化剂能减小反应活化能 |
B.为了提高原料利用率, 和 和 循环使用 循环使用 |
C.工业合成氨温度为700K是因为升高温度有利于提高 的平衡转化率 的平衡转化率 |
| D.恒温恒容下,若体系的总压强不再改变,说明该反应已达平衡状态 |
您最近一年使用:0次
2023-07-16更新
|
226次组卷
|
3卷引用:福建省宁德市区域性学业质量检测2022-2023学年高二上学期2月期末考试化学试题
福建省宁德市区域性学业质量检测2022-2023学年高二上学期2月期末考试化学试题(已下线)专题05 化学反应的方向 化学反应的调控 -【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)广西百色市德保高中2023-2024学年高二上学期11月期中考试化学试题
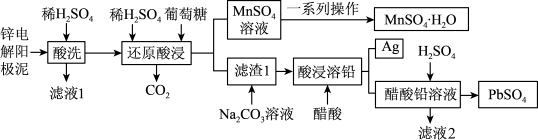
8 . 一种锌电解阳极,主要成分为Ag、MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16(Mn元素化合价为+2和+4两种),可用于回收金属元素锌、锰、铅和银的工艺,如图所示。回答下列问题:
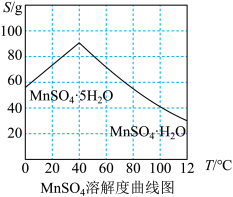
已知:①MnSO4·H2O易溶于水,不溶于乙醇。
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:
葡萄糖(C6H12O6)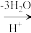
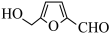
 + HCOOH
+ HCOOH
③在一定条件下, + PbSO4=PbCO3+
+ PbSO4=PbCO3+
(1)经过“酸洗"后的滤渣中主要的成分有___________ 。
(2)“还原酸浸”过程中主要反应的化学方程式为___________ 。
(3)结合MnSO4溶解度曲线图分析,由MnSO4溶液制得MnSO4·H2O晶体的“一系列操作”是___________ ,用___________ (填物质的名称)洗涤、干燥。
(4)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是___________ ,为提高葡萄糖的有效利用率(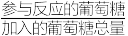 ×100%),除了充分搅拌外还可以
×100%),除了充分搅拌外还可以___________ 。
(5)关于流程中有关物质的说法正确的是___________(填标号)。

已知:①MnSO4·H2O易溶于水,不溶于乙醇。
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:
葡萄糖(C6H12O6)
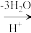

 + HCOOH
+ HCOOH③在一定条件下,
 + PbSO4=PbCO3+
+ PbSO4=PbCO3+
(1)经过“酸洗"后的滤渣中主要的成分有
(2)“还原酸浸”过程中主要反应的化学方程式为
(3)结合MnSO4溶解度曲线图分析,由MnSO4溶液制得MnSO4·H2O晶体的“一系列操作”是

(4)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是
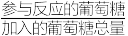 ×100%),除了充分搅拌外还可以
×100%),除了充分搅拌外还可以(5)关于流程中有关物质的说法正确的是___________(填标号)。
| A.为了提高“还原酸浸”的浸出效率,可以大幅提高温度 |
| B.滤液1中含有Mn2+、Pb2+和Zn2+ |
| C.可以采用金属Na与ZnSO4溶液反应,置换出金属锌 |
| D.流程中的“滤液2”可循环利用 |
您最近一年使用:0次
解题方法
9 . 从分银渣(含Sb2S3、SnO2以及铅等杂质)中分离提取Na2SbO4和CaSnO3流程如图所示:

查阅资料:①Sn和C属于同主族元素,Sb和N属于同主族元素。
②“碱浸”中Sb元素发生反应的离子方程式为: 、
、
(1)Sn原子的质子数为50,其原子结构示意图为___________ 。
(2)“碱浸”中,可采取___________ 的方法提高浸取速率,其中,SnO2与NaOH反应的离子方程式为___________ 。
(3)“沉锑”中,X为___________ 。
(4)“沉锑”中,金属沉淀率与H2O2质量浓度关系如下图所示。为分离Sb元素和Sn元素,需控制H2O2质量浓度为___________ ,原因是___________ ,该过程Na3SbS3转化为Na2SbO4的离子方程式为___________ 。

(5)“一系列操作”为___________ 。
(6)用1t分银渣(含Sb元素质量分数6.1%)制得51kgNa3SbO4,则Na3SbO4的产率为___________ 。
(7)该流程中,可循环利用的物质是___________ (填化学式)。

查阅资料:①Sn和C属于同主族元素,Sb和N属于同主族元素。
②“碱浸”中Sb元素发生反应的离子方程式为:
 、
、
(1)Sn原子的质子数为50,其原子结构示意图为
(2)“碱浸”中,可采取
(3)“沉锑”中,X为
(4)“沉锑”中,金属沉淀率与H2O2质量浓度关系如下图所示。为分离Sb元素和Sn元素,需控制H2O2质量浓度为

(5)“一系列操作”为
(6)用1t分银渣(含Sb元素质量分数6.1%)制得51kgNa3SbO4,则Na3SbO4的产率为
(7)该流程中,可循环利用的物质是
您最近一年使用:0次
解题方法
10 . 工业上利用天然气制备 ,还可得到
,还可得到 、
、 等化工产品。一定条件下,有关反应如下:
等化工产品。一定条件下,有关反应如下:
反应1:
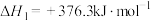
反应2: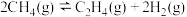
回答下列问题:
(1)相同条件下,反应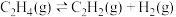
 ,
,
_______  。
。
(2)实验测得反应1的速率方程: ,
,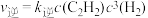 (
( 、
、 分别为正、逆反应速率常数)。
分别为正、逆反应速率常数)。
①结合速率的影响因素,推测速率常数k的影响因素有_______ (填标号)。
A.温度 B.浓度 C.催化剂 D.固体表面性质
②T℃下反应达到平衡时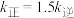 ,该温度下平衡常数
,该温度下平衡常数
_______ 。
(3)向恒温恒容密闭容器中充入适量 ,同时发生上述反应1和反应2,在不同催化剂
,同时发生上述反应1和反应2,在不同催化剂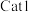 、
、 作用下,测得单位时间内
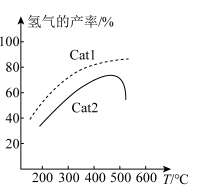
作用下,测得单位时间内 的产率与温度的关系如图所示。在其他条件相同时,催化效率较高的是
的产率与温度的关系如图所示。在其他条件相同时,催化效率较高的是_______ (填“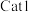 ”或“
”或“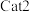 ”)。在
”)。在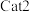 作用下,温度高于500℃时,
作用下,温度高于500℃时, 的产率降低的可能原因是
的产率降低的可能原因是_______ 。
(4)一定温度下,总压强恒定为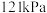 时,向密闭容器中充入
时,向密闭容器中充入 和
和 的混合气体(
的混合气体( 不参与反应),同时发生反应1和反应2,测得
不参与反应),同时发生反应1和反应2,测得 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如下图所示。
的物质的量分数的关系如下图所示。
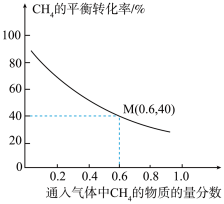
①随着通入气体中 的物质的量分数增大,
的物质的量分数增大, 的平衡转化率降低的主要原因是
的平衡转化率降低的主要原因是_______ 。
②已知M点对应的乙炔的选择性为75%(乙炔的选择性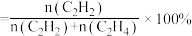 )。该温度下,反应2的平衡常数
)。该温度下,反应2的平衡常数
_______  (结果保留2位有效数字)。(提示:用平衡时气体分压计算的平衡常数为
(结果保留2位有效数字)。(提示:用平衡时气体分压计算的平衡常数为 ,
, 。)
。)
 ,还可得到
,还可得到 、
、 等化工产品。一定条件下,有关反应如下:
等化工产品。一定条件下,有关反应如下:反应1:

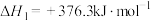
反应2:
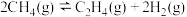
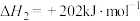
回答下列问题:
(1)相同条件下,反应
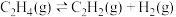
 ,
,
 。
。(2)实验测得反应1的速率方程:
 ,
,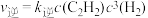 (
( 、
、 分别为正、逆反应速率常数)。
分别为正、逆反应速率常数)。①结合速率的影响因素,推测速率常数k的影响因素有
A.温度 B.浓度 C.催化剂 D.固体表面性质
②T℃下反应达到平衡时
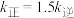 ,该温度下平衡常数
,该温度下平衡常数
(3)向恒温恒容密闭容器中充入适量
 ,同时发生上述反应1和反应2,在不同催化剂
,同时发生上述反应1和反应2,在不同催化剂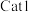 、
、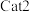 作用下,测得单位时间内
作用下,测得单位时间内 的产率与温度的关系如图所示。在其他条件相同时,催化效率较高的是
的产率与温度的关系如图所示。在其他条件相同时,催化效率较高的是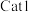 ”或“
”或“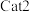 ”)。在
”)。在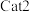 作用下,温度高于500℃时,
作用下,温度高于500℃时, 的产率降低的可能原因是
的产率降低的可能原因是
(4)一定温度下,总压强恒定为
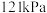 时,向密闭容器中充入
时,向密闭容器中充入 和
和 的混合气体(
的混合气体( 不参与反应),同时发生反应1和反应2,测得
不参与反应),同时发生反应1和反应2,测得 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如下图所示。
的物质的量分数的关系如下图所示。
①随着通入气体中
 的物质的量分数增大,
的物质的量分数增大, 的平衡转化率降低的主要原因是
的平衡转化率降低的主要原因是②已知M点对应的乙炔的选择性为75%(乙炔的选择性
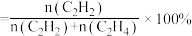 )。该温度下,反应2的平衡常数
)。该温度下,反应2的平衡常数
 (结果保留2位有效数字)。(提示:用平衡时气体分压计算的平衡常数为
(结果保留2位有效数字)。(提示:用平衡时气体分压计算的平衡常数为 ,
, 。)
。)
您最近一年使用:0次



