名校
解题方法
1 . “中国芯”的发展离不开单晶硅,工业上制高纯硅,先制得粗硅,再制高纯硅。
Ⅰ.请回答:
(1)工业制粗硅反应的化学方程式为___________ 。
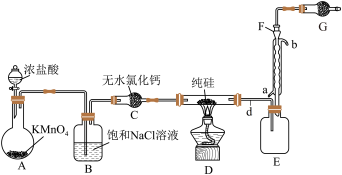
Ⅱ.某小组拟在实验室用如图所示装置模拟探究四氯化硅的制备和应用(夹持装置已省略)。
① ,
, ;
;
② 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为
的熔点、沸点分别为 、
、 。
。
请回答下列问题:
(2)装无水氯化钙的仪器名称是___________ 。
(3)若拆去B装置,可能的后果是___________ (写出一个即可)。
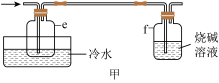
(4)有同学最初将E、F、G装置设计成图甲所示装置,图甲装置的主要缺点是___________ (写出一个即可)。 在高温条件下易分解生成
在高温条件下易分解生成 和
和 。利用
。利用 和
和 制备新型无机非金属材料(
制备新型无机非金属材料(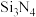 )的装置如图乙,写出该反应的化学方程式:
)的装置如图乙,写出该反应的化学方程式:___________ 。利用尾气制备盐酸,宜选择下列装置中的___________ (填序号)。
(6) 也是制取高纯硅的重要原料,它在浓的
也是制取高纯硅的重要原料,它在浓的 溶液中的反应方程式为
溶液中的反应方程式为___________ 。
Ⅰ.请回答:
(1)工业制粗硅反应的化学方程式为
Ⅱ.某小组拟在实验室用如图所示装置模拟探究四氯化硅的制备和应用(夹持装置已省略)。
①
 ,
, ;
;②
 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为
的熔点、沸点分别为 、
、 。
。请回答下列问题:
(2)装无水氯化钙的仪器名称是
(3)若拆去B装置,可能的后果是
(4)有同学最初将E、F、G装置设计成图甲所示装置,图甲装置的主要缺点是
 在高温条件下易分解生成
在高温条件下易分解生成 和
和 。利用
。利用 和
和 制备新型无机非金属材料(
制备新型无机非金属材料(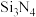 )的装置如图乙,写出该反应的化学方程式:
)的装置如图乙,写出该反应的化学方程式: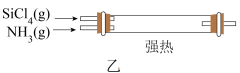

(6)
 也是制取高纯硅的重要原料,它在浓的
也是制取高纯硅的重要原料,它在浓的 溶液中的反应方程式为
溶液中的反应方程式为
您最近一年使用:0次
2024-01-06更新
|
1051次组卷
|
4卷引用:贵州省贵阳市第一中学2023-2024学年高三上学期11月高考适应性月考化学试卷(三)
贵州省贵阳市第一中学2023-2024学年高三上学期11月高考适应性月考化学试卷(三)(已下线)题型17 化学实验综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)河北省廊坊市2023-2024学年高一下学期3月月考化学试题
名校
解题方法
2 . 接触法制硫酸,接触室中的反应如下:
 ,
, 的平衡转化率与压强、温度的关系如下表所示:
的平衡转化率与压强、温度的关系如下表所示:
在实际生产中,下列条件最适宜的是

 ,
, 的平衡转化率与压强、温度的关系如下表所示:
的平衡转化率与压强、温度的关系如下表所示:| 温度 | 平衡时 的转化率 的转化率 | |||
 | 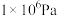 | 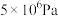 | 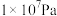 | |
| 450℃ | 97.5% | 99.2% | 99.6% | 99.7% |
| 550℃ | 85.6% | 94.9% | 97.7% | 98.3% |
A.温度450℃、压强 | B.温度550℃、压强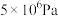 |
C.温度550℃、压强 | D.温度450℃、压强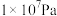 |
您最近一年使用:0次
名校
解题方法
3 . TiO2可以作为催化剂的载体,也可以用作涂料、光催化剂等其他材料。以废TiO2催化剂为原料,利用氯化法回收钛白粉(TiO2)的工艺流程如图所示:

已知:氯化过程中氯化钠不参与反应。
回答下列问题:
(1)对废TiO2催化剂进行预处理:物理清洗和破碎磨粉,其中破碎磨粉的目的是___________ 。
(2)氯化时将预处理的废催化剂与还原剂(如石油焦,主要是C)和氯化钠混合后进入氯化炉中,通入Cl2并加热到950℃进行反应,生成含有TiCl4(熔点为-25℃,沸点为135℃)的混合物,经过各物料合理的配比及条件的选择,可以得到无毒的气体,则氯化时发生反应的化学方程式为___________ 。
(3)在空气中加热“氧化”时,发生置换反应,反应的化学方程式为___________ 。
(4)氯化法工艺是干法生产,工艺优点为技术先进、流程短、能耗较低、物质循环利用、三废排放少、制得的钛白粉质量优异;但氯化炉设备结构复杂,对设备要求比较高。下列对设备要求的说法正确的是___________(填标号)。
(5)该氯化法工艺生产中经过简单处理可循环使用的物质有___________ (写化学式)。
(6)有科学工作者发现,在FeCl3存在时,可使TiO2的氯化速率有较大提升,是因为FeCl3在该过程中起着___________ 的作用,经研究发现反应过程中有FeCl2生成,最终还是以FeCl3形式存在。写出生成FeCl2的化学方程式:___________ 。

已知:氯化过程中氯化钠不参与反应。
回答下列问题:
(1)对废TiO2催化剂进行预处理:物理清洗和破碎磨粉,其中破碎磨粉的目的是
(2)氯化时将预处理的废催化剂与还原剂(如石油焦,主要是C)和氯化钠混合后进入氯化炉中,通入Cl2并加热到950℃进行反应,生成含有TiCl4(熔点为-25℃,沸点为135℃)的混合物,经过各物料合理的配比及条件的选择,可以得到无毒的气体,则氯化时发生反应的化学方程式为
(3)在空气中加热“氧化”时,发生置换反应,反应的化学方程式为
(4)氯化法工艺是干法生产,工艺优点为技术先进、流程短、能耗较低、物质循环利用、三废排放少、制得的钛白粉质量优异;但氯化炉设备结构复杂,对设备要求比较高。下列对设备要求的说法正确的是___________(填标号)。
| A.抗高温 | B.抗氧化 | C.抗腐蚀 | D.抗高压 |
(6)有科学工作者发现,在FeCl3存在时,可使TiO2的氯化速率有较大提升,是因为FeCl3在该过程中起着
您最近一年使用:0次
2022-07-04更新
|
142次组卷
|
2卷引用:贵州省黔东南苗族侗族自治州)2021-2022学年高二下学期期末联考化学试题
名校
解题方法
4 . 工业炼铁是在高炉中进行的,高炉炼铁的主要反应是:①2C(焦炭)+O2(空气)  2CO;②Fe2O3+3CO
2CO;②Fe2O3+3CO 2Fe+3CO2。该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需。其主要原因是
2Fe+3CO2。该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需。其主要原因是
 2CO;②Fe2O3+3CO
2CO;②Fe2O3+3CO 2Fe+3CO2。该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需。其主要原因是
2Fe+3CO2。该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需。其主要原因是| A.CO过量 | B.CO与铁矿石接触不充分 |
| C.炼铁高炉的高度不够 | D.上述反应有一定的限度 |
您最近一年使用:0次
2021-05-13更新
|
767次组卷
|
18卷引用:贵州省黔东南州2020-2021学年高一下学期期末考试化学试题
贵州省黔东南州2020-2021学年高一下学期期末考试化学试题(已下线)09-10年湖北潜江文昌高中高一下学期期末总复习化学试题(已下线)2013-2014黑龙江省哈六中高一下学期期末考试化学试卷山东省临沂市蒙阴县实验中学2016-2017学年高一下学期第二次月考(期末模拟)化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高一下学期期中考试化学试题辽宁省沈阳市城郊市重点联合体2019-2020学年高一上学期第二次月考化学试题山东省济宁市汶上圣泽中学2019-2020学年高一下学期第二次月考化学试题(已下线)2.2.2 化学平衡状态(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)(已下线)第七章 能力提升检测卷-2021年高考化学一轮复习讲练测专题9 第一单元 金属的冶炼方法-高中化学必修第二册苏教版2019福建省福州第一中学2020-2021学年高一下学期期中考化学试题北京市第十三中学2020~2021学年高一下学期期中考试化学试题(已下线)专题11 开发利用金属矿物和海水资源【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)(已下线)6.2.2 化学反应的限度-2021-2022学年高一化学课后培优练(人教版2019必修第二册)(已下线)第16讲 金属材料与合金(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )安徽省亳州市第五完全中学2021-2022学年高二上学期期中考试化学试题海南中学美伦校区2022-2023学年高一下学期期末考试化学试题 6.2.2 化学反应的限度 随堂练习
名校
解题方法
5 . 下列有关反应2SO2+O2 2SO3的说法中不正确的是
2SO3的说法中不正确的是
 2SO3的说法中不正确的是
2SO3的说法中不正确的是| A.该反应为可逆反应,故在一定条件下二氧化硫与氧气不可能全部转化为三氧化硫 |
| B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零 |
| C.一定条件下,向某密闭容器中加入2molSO2和1molO2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等 |
| D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题 |
您最近一年使用:0次
2021-04-28更新
|
155次组卷
|
11卷引用:2015-2016学年贵州遵义航天中学高二上第三次月考化学卷
2015-2016学年贵州遵义航天中学高二上第三次月考化学卷(已下线)2010-2011学年山西省临汾一中高一下学期期中考试化学试卷(已下线)2011-2012学年云南省开远四中高一下学期期中考试化学试卷(已下线)2011-2012学年河北省邢台一中高一下学期期末考试化学试卷《课时同步君》2017-2018学年高一化学人教必修2-2.3.2 化学反应的限度(已下线)2018年12月27日 《每日一题》人教选修4-可逆反应黑龙江省哈尔滨市第六中学校2019-2020学年高一下学期返校适应训练化学试题安徽省滁州市定远县育才学校2020-2021学年高一下学期期中考试化学试题天津市两校联考2021-2022学年高二上学期第二次质量检测化学试题河北省张家口市第一中学2021-2022学年高二上学期10月月考化学试题(已下线)6.2.2 化学平衡(第2课时 化学平衡移动)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)
名校
解题方法
6 . 在合成氨工业和硝酸制备工业中,常产生N2O、NO和NO2等氮氧化物造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)在2L密闭容器中通入3mol H2和1mol N2,测得不同温度下,NH3的产率随时间的变化如图所示。
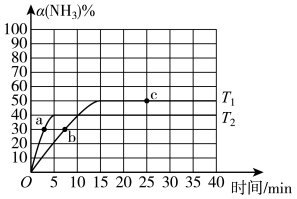
①下列有关说法正确的是________ (填序号)。
A.a处的v正>0
B.e点的v净=0
C.由b点到c点混合气体相对分子质量逐渐增大
D.平衡时,通入氩气平衡正向移动
②T2温度时,0~5min内v(N2)=___ mol·L-1·min-l
③已知:瞬时速率表达式v正=k正c3(H2)∙c(N2),v逆=k逆c2(NH3)(k为速率常数,只与温度有关)。温度由T1调到T2,活化分子百分率________ 。(填“增大”“减小”或“不变”),
k正增大倍数____ k逆增大倍数(填“大于”“小于”或“等于”)。T1°C时,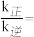
____
(2)工业生产尾气中产生的N2O需进行分解处理,用碘蒸气可大大提高N2O的分解速率,反应历程如下:
第一步:I2(g)=2I(g) (快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步: IO(g)+N2O(g)→N2(g)+O2(g)+I(g) ( 快反应)
在反应过程中,I2的浓度与N2O分解速率_____ (填“有关”或“无关”);第___ 步反应对总反应速率起决定性作用;第二步的活化能比第三步____ (填 “大”“小”或“相等”)。
(3)已除去N2O的硝酸尾气NO和NO2可用NaOH溶液吸收,写出NO和NO2与NaOH反应生成一种盐的反应方程式:_______ ;已知,常温下HNO2的电离常数Ka=5×10-4,则0.5mol/L对应钠盐的pH值为_______
(1)在2L密闭容器中通入3mol H2和1mol N2,测得不同温度下,NH3的产率随时间的变化如图所示。

①下列有关说法正确的是
A.a处的v正>0
B.e点的v净=0
C.由b点到c点混合气体相对分子质量逐渐增大
D.平衡时,通入氩气平衡正向移动
②T2温度时,0~5min内v(N2)=
③已知:瞬时速率表达式v正=k正c3(H2)∙c(N2),v逆=k逆c2(NH3)(k为速率常数,只与温度有关)。温度由T1调到T2,活化分子百分率
k正增大倍数
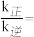
(2)工业生产尾气中产生的N2O需进行分解处理,用碘蒸气可大大提高N2O的分解速率,反应历程如下:
第一步:I2(g)=2I(g) (快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步: IO(g)+N2O(g)→N2(g)+O2(g)+I(g) ( 快反应)
在反应过程中,I2的浓度与N2O分解速率
(3)已除去N2O的硝酸尾气NO和NO2可用NaOH溶液吸收,写出NO和NO2与NaOH反应生成一种盐的反应方程式:
您最近一年使用:0次
名校
解题方法
7 . 在防治新冠肺炎的工作中,过氧乙酸(CH3COOOH)是众多消毒剂中的一种。过氧乙酸具有强氧化能力,可将各种病原微生物杀灭。其性质不稳定,遇热易分解。某同学利用高浓度的双氧水和冰醋酸制备少量过氧乙酸并进行相关实验。
I.过氧乙酸的制备.
向100mL的三颈烧瓶中加入25mL冰醋酸,滴加42.5%双氧水15mL,之后加入一定量浓硫酸,维持反应温度为40℃,磁力搅拌4h后,室温静置12h。
(1)三颈烧瓶中制取过氧乙酸的反应方程式为____ 。
(2)资料显示浓硫酸的用量对制得的过氧乙酸的质量分数有较为明显的影响,如图所示。根据图中数据分析本实验中浓硫酸的用量应为____ (填字母)。
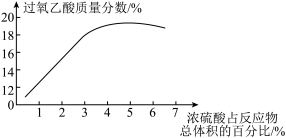
a 1.5mL-2.0mL b 3.5mL-4.0mL C 5.5mL-6.0mL
II.过氧乙酸质量分数的测定
准确称取1.00g过氧乙酸样液,定容子100mL容量瓶中,取其中10.00mL溶液调pH后,用KMnO4标准溶液滴定至溶液出现浅红色,以除去过氧乙酸试样中剩余的H2O2,再加入过量KI溶液,摇匀,用0.0200mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液25.00mL。(已知: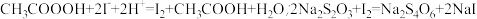 )。
)。
(3)加入过量KI溶液前,需除去H2O2的原因是____ (用离子方程式表示)。
(4)滴定时所选指示剂为____ ;制得过氧乙酸溶液中过氧乙酸质量分数为____ %。
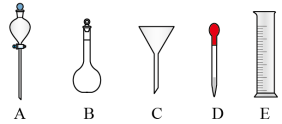
(5)过氧乙酸用于消毒时,要将原液稀释到0.2%-0.5%之间。若实验室配制1000mL过氧乙酸稀溶液时,除需使用烧杯和玻璃棒外,还要用到以下哪些仪器____ (填标号)。
I.过氧乙酸的制备.
向100mL的三颈烧瓶中加入25mL冰醋酸,滴加42.5%双氧水15mL,之后加入一定量浓硫酸,维持反应温度为40℃,磁力搅拌4h后,室温静置12h。
(1)三颈烧瓶中制取过氧乙酸的反应方程式为
(2)资料显示浓硫酸的用量对制得的过氧乙酸的质量分数有较为明显的影响,如图所示。根据图中数据分析本实验中浓硫酸的用量应为

a 1.5mL-2.0mL b 3.5mL-4.0mL C 5.5mL-6.0mL
II.过氧乙酸质量分数的测定
准确称取1.00g过氧乙酸样液,定容子100mL容量瓶中,取其中10.00mL溶液调pH后,用KMnO4标准溶液滴定至溶液出现浅红色,以除去过氧乙酸试样中剩余的H2O2,再加入过量KI溶液,摇匀,用0.0200mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液25.00mL。(已知:
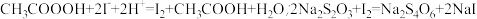 )。
)。(3)加入过量KI溶液前,需除去H2O2的原因是
(4)滴定时所选指示剂为
(5)过氧乙酸用于消毒时,要将原液稀释到0.2%-0.5%之间。若实验室配制1000mL过氧乙酸稀溶液时,除需使用烧杯和玻璃棒外,还要用到以下哪些仪器

您最近一年使用:0次
2020-03-10更新
|
465次组卷
|
3卷引用:贵州省2020届高三3月“阳光校园.空中黔课”阶段检测化学试题
贵州省2020届高三3月“阳光校园.空中黔课”阶段检测化学试题安徽省太和第一中学2019-2020学年高二下学期教学衔接调研考试(超越班)化学试题(已下线)2022年新高考化学时事热点情境化考题---实验装置题
解题方法
8 . 苯乙烯是一种重要的化工原料。工业中以乙苯(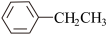 )为原料,采用催化脱氢的方法制取苯乙烯(
)为原料,采用催化脱氢的方法制取苯乙烯(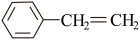 )。回答下列问题:
)。回答下列问题:
已知:①

 +H2(g)△H1>0
+H2(g)△H1>0
②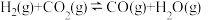 △H2>0
△H2>0
(1) +CO2(g)
+CO2(g)
 +CO(g)+H2O(g)△H=
+CO(g)+H2O(g)△H=_______ ,(用△H1、△H2表示)有利于提高己苯平衡转化率的条件是____ (填标号)。
a高温b高压c低温d低压
(2)已知T1℃下,将1mol乙苯蒸气通入到体积为2L的密闭容器中进行反应①,容器内气体总物质的量随反应时间的变化情况如下表所示:
①由表中数据计算0~10min内v(H2)=____ :平衡时乙苯的转化率为____
②T1℃下该反应的平衡常数K1=____
③若温度T1℃下的平衡常数K小于T2℃下的平衡常数K2,则T1____ T2(填“>”、“<”或“=”)
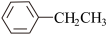 )为原料,采用催化脱氢的方法制取苯乙烯(
)为原料,采用催化脱氢的方法制取苯乙烯(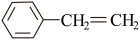 )。回答下列问题:
)。回答下列问题:已知:①


 +H2(g)△H1>0
+H2(g)△H1>0②
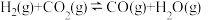 △H2>0
△H2>0(1)
 +CO2(g)
+CO2(g)
 +CO(g)+H2O(g)△H=
+CO(g)+H2O(g)△H=a高温b高压c低温d低压
(2)已知T1℃下,将1mol乙苯蒸气通入到体积为2L的密闭容器中进行反应①,容器内气体总物质的量随反应时间的变化情况如下表所示:
| 时间t/min | 0 | 10 | 20 | 30 | 40 |
| 总物质的量n/mol | 1.0 | 1.4 | 1.65 | 1.8 | 1.8 |
①由表中数据计算0~10min内v(H2)=
②T1℃下该反应的平衡常数K1=
③若温度T1℃下的平衡常数K小于T2℃下的平衡常数K2,则T1
您最近一年使用:0次
9 . 科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及物质未标出)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)===2CO(g)+4H2(g)的ΔH=_________ 。
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
①用H2表示前2 h 的平均反应速率v(H2)=_________________________________ ;
②该温度下,CO2的平衡转化率为________ 。
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①该反应的ΔH________ 0(填“>”或“<”)。
②曲线c表示的物质为________ 。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施______________ 。(答出一条即可)

(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)===2CO(g)+4H2(g)的ΔH=
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
| 时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
 | 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
①用H2表示前2 h 的平均反应速率v(H2)=
②该温度下,CO2的平衡转化率为
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①该反应的ΔH
②曲线c表示的物质为
③为提高H2的平衡转化率,除改变温度外,还可采取的措施
您最近一年使用:0次
2020-02-19更新
|
366次组卷
|
5卷引用:贵州省毕节市七星关区毕节市实验高级中学2020-2021学年高二上学期期中考试化学试题
名校
10 . 如图是可逆反应X2+3Y2  2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是
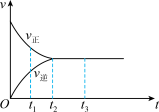
 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是
| A.t1时,只有正方向反应 |
| B.t2~t3,反应仍在进行 |
| C.t2时,反应到达限度 |
| D.t2~t3,各物质的浓度不再发生变化 |
您最近一年使用:0次



