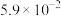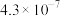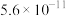名校
1 . NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的 、
、 和
和 的混合气体以一定流速通过装有催化剂的反应管,
的混合气体以一定流速通过装有催化剂的反应管, 的转化率、生成
的转化率、生成 的选择性
的选择性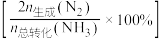 与温度的关系如图所示。下列说法正确的是
与温度的关系如图所示。下列说法正确的是
 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的 、
、 和
和 的混合气体以一定流速通过装有催化剂的反应管,
的混合气体以一定流速通过装有催化剂的反应管, 的转化率、生成
的转化率、生成 的选择性
的选择性 与温度的关系如图所示。下列说法正确的是
与温度的关系如图所示。下列说法正确的是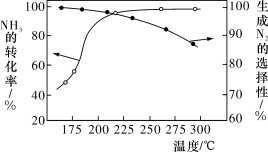
A.其他条件不变,升高温度, 的平衡转化率增大 的平衡转化率增大 |
B.其他条件不变,在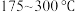 范围,随温度的升高,出口处 范围,随温度的升高,出口处 浓度不断增大 浓度不断增大 |
C.催化氧化除去尾气中的 应选择反应温度高于 应选择反应温度高于 |
D.高效除去尾气中的 ,需研发低温下 ,需研发低温下 转化率高和生成 转化率高和生成 选择性高的催化剂 选择性高的催化剂 |
您最近一年使用:0次
解题方法
2 . 含硫化合物是实验室和工业上的常用化学品。请回答:
(1)实验室可用铜与浓硫酸反应制备少量SO2:Cu(s)+2H2SO4(l)=CuSO4(s)+SO2(g)+2H2O(l) ΔH=−11.9kJ·mol-1。判断该反应的自发性并说明理由___________ 。
(2)已知2SO2(g)+O2 2SO3(g) ΔH=−198kJ·mol-1,850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1。
2SO3(g) ΔH=−198kJ·mol-1,850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1。
①反应开始到第10分钟,SO3反应速率为________ 。
②该温度下反应的平衡常数为________ 。
③平衡时SO2的转化率为________ 。
(3)工业上主要采用接触法用含硫矿石制备硫酸。其主要工艺是焙烧、炉气精制、用钒做催化剂将SO2氧化成SO3、吸收等。结合本大题的信息,完成下题。
①下列说法正确的是______ 。
a.须采用高温高压的反应条件使SO2氧化为SO3
b.通入过量的空气可以提高含硫矿石和SO2的转化率
c.进入接触室之前的气流无需净化处理
②在焙烧前要将硫铁矿粉碎,这样做的目的是______ 。
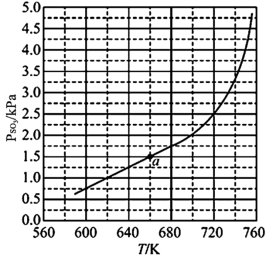
(4)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s) Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ),平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)
Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ),平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)_____ kPa,Kp(Ⅰ)随反应温度升高而_____ (填“增大”“减小”或“不变”)。
(1)实验室可用铜与浓硫酸反应制备少量SO2:Cu(s)+2H2SO4(l)=CuSO4(s)+SO2(g)+2H2O(l) ΔH=−11.9kJ·mol-1。判断该反应的自发性并说明理由
(2)已知2SO2(g)+O2
 2SO3(g) ΔH=−198kJ·mol-1,850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1。
2SO3(g) ΔH=−198kJ·mol-1,850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1。①反应开始到第10分钟,SO3反应速率为
②该温度下反应的平衡常数为
③平衡时SO2的转化率为
(3)工业上主要采用接触法用含硫矿石制备硫酸。其主要工艺是焙烧、炉气精制、用钒做催化剂将SO2氧化成SO3、吸收等。结合本大题的信息,完成下题。
①下列说法正确的是
a.须采用高温高压的反应条件使SO2氧化为SO3
b.通入过量的空气可以提高含硫矿石和SO2的转化率
c.进入接触室之前的气流无需净化处理
②在焙烧前要将硫铁矿粉碎,这样做的目的是
(4)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s)
 Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ),平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)
Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ),平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)
您最近一年使用:0次
名校
解题方法
3 . 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖。工业合成氨生产示意图如图所示。
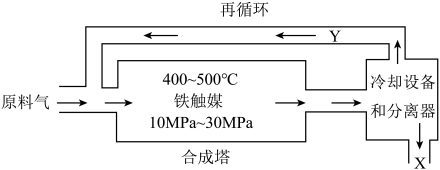
(1)下列有关合成氨工业的说法正确的是___________
(2)循环利用的Y是氮气和氢气,目的是___________ 。
(3)在合成氨工业中,要使氨的产率增大,同时又能提高反应速率,可采取的措施有___________ (填编号)。
①使用催化剂 ②恒温恒容,增大原料气 和
和 充入量 ③及时分离产生的
充入量 ③及时分离产生的
④升高温度 ⑤恒温恒容,充入惰性气体 使压强增大
使压强增大
(4)氮的固定和氮的循环是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分 值。
值。
分析数据可知:
①在 下模拟工业固氮,某时刻
下模拟工业固氮,某时刻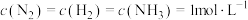 ,此时v正
,此时v正___________ v逆(填“>”“<”或“=”)。
②人类不适合大规模模拟大气固氮的原因是___________ 。
(5)哈伯1908年发表的文献中写到,在高温下,铁和铂都能作为使气态氨分解成为氢气、氮气的催化剂,下面是他做过的实验中的两组(条件都为901℃和3039.75 kPa)。
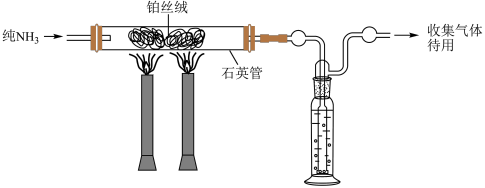
①使纯氨气通过白炽的铂丝,剩余的氨用浓硫酸洗涤除去。然后使气态混合物在相同条件下通过铁催化剂,出来的气体再缓缓通过20mL盐酸除去氨气。用气量计测得标准状况下剩余干燥气体的体积为2.02L。盐酸溶液用KOH溶液滴定,最终计算得到通入盐酸前氨气为1.86×10-4mol。
计算回答:在901℃下,N2 (g)+ 3H2 (g)
(g) 2NH3(g)的Kp=
2NH3(g)的Kp=___________ kPa-2。(保留一位有效数字)
②使纯氨气直接通过同一铁催化剂,出来的气体同样缓缓通入20mL盐酸,用气量计测得标准状况下剩余干燥气体的体积为1.82L。同理可以滴定后计算出通入盐酸前氨气的量,进而计算出Kp。在操作、计算误差合理的范围内,①、②得到的Kp基本相等。这对你有何启发?___________ 。

(1)下列有关合成氨工业的说法正确的是___________
| A.工业合成氨的反应是熵减小的放热反应,在低温时可自发进行 |
| B.合成氨反应中,反应物的总键能小于产物的总键能 |
C.合成氨厂一般采用的压强为 ,因为该压强下铁触媒的活性最高 ,因为该压强下铁触媒的活性最高 |
D. 的量越多, 的量越多, 的转化率越大,因此,充入的 的转化率越大,因此,充入的 越多越有利于 越多越有利于 的合成 的合成 |
(2)循环利用的Y是氮气和氢气,目的是
(3)在合成氨工业中,要使氨的产率增大,同时又能提高反应速率,可采取的措施有
①使用催化剂 ②恒温恒容,增大原料气
 和
和 充入量 ③及时分离产生的
充入量 ③及时分离产生的
④升高温度 ⑤恒温恒容,充入惰性气体
 使压强增大
使压强增大(4)氮的固定和氮的循环是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分
 值。
值。| 反应 | 大气固氮 | 工业固氮 | |||
温度 | 27 | 2000 | 25 | 400 | 450 |
 |  | 0.1 | 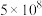 | 0.507 | 0.152 |
①在
 下模拟工业固氮,某时刻
下模拟工业固氮,某时刻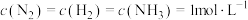 ,此时v正
,此时v正②人类不适合大规模模拟大气固氮的原因是
(5)哈伯1908年发表的文献中写到,在高温下,铁和铂都能作为使气态氨分解成为氢气、氮气的催化剂,下面是他做过的实验中的两组(条件都为901℃和3039.75 kPa)。

①使纯氨气通过白炽的铂丝,剩余的氨用浓硫酸洗涤除去。然后使气态混合物在相同条件下通过铁催化剂,出来的气体再缓缓通过20mL盐酸除去氨气。用气量计测得标准状况下剩余干燥气体的体积为2.02L。盐酸溶液用KOH溶液滴定,最终计算得到通入盐酸前氨气为1.86×10-4mol。
计算回答:在901℃下,N2 (g)+ 3H2
 (g)
(g) 2NH3(g)的Kp=
2NH3(g)的Kp=②使纯氨气直接通过同一铁催化剂,出来的气体同样缓缓通入20mL盐酸,用气量计测得标准状况下剩余干燥气体的体积为1.82L。同理可以滴定后计算出通入盐酸前氨气的量,进而计算出Kp。在操作、计算误差合理的范围内,①、②得到的Kp基本相等。这对你有何启发?
您最近一年使用:0次
2023-10-26更新
|
24次组卷
|
2卷引用:湖南省长沙市实验中学2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
4 . 以废银(主要含Ag,以及少量SiO2、α-Al2O3杂质)为原料提取高纯度银的流程如图1所示,其他条件相同,浸出率与温度、时间的关系分别如图2和图3所示:
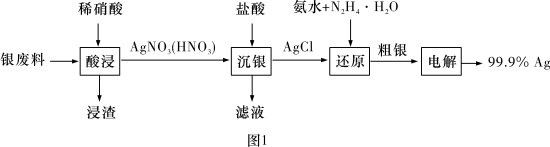
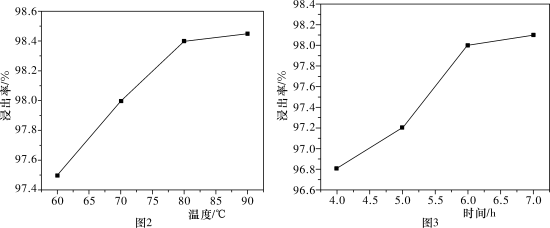
| A.最佳生产条件是温度为80℃、时间为6.0 h |
| B.浸渣的主要成分是SiO2 |
| C.“电解”中向AgNO3溶液中添加少量NaNO3能增强导电性 |
| D.理论上制备21.6 g Ag需要消耗2.5gN2H4·H2O |
您最近一年使用:0次
2023-08-16更新
|
167次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高三上学期入学考试(暑假作业检测)化学试题
名校
解题方法
5 . 化学反应速率和限度与生产、生活密切相关。
(1)某温度下, 恒容密闭容器中,X、Y、Z三种物质的物质的量随反应时间的变化曲线如图所示。
恒容密闭容器中,X、Y、Z三种物质的物质的量随反应时间的变化曲线如图所示。

①从反应开始到 内,用
内,用 的浓度变化表示的平均反应速率为
的浓度变化表示的平均反应速率为_______ mol·L-1·min-1。
②该反应的化学方程式为_______ 。
③若 均为气体,在
均为气体,在 时,向容器中通入氩气(容器体积不变),
时,向容器中通入氩气(容器体积不变), 的反应速率将
的反应速率将_______ (填“变大”、“不变”或“变小”)。
④若 均为气体,下列能说明该反应达到平衡状态的是
均为气体,下列能说明该反应达到平衡状态的是_______ (填字母)。
a. 三种气体的浓度相等
三种气体的浓度相等
b.混合气体的质量不随时间变化
c.混合气体的密度不随时间变化
d.单位时间内消耗X和 的物质的量之比为
的物质的量之比为
(2)实验室用 溶液与
溶液与 溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知
溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知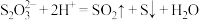 ):
):
①对比实验1和2可探究_______ 因素对化学反应速率的影响。
②对比实验1和3来探究浓度对化学反应速率的影响,则
_______ ,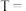
_______ 。
(1)某温度下,
 恒容密闭容器中,X、Y、Z三种物质的物质的量随反应时间的变化曲线如图所示。
恒容密闭容器中,X、Y、Z三种物质的物质的量随反应时间的变化曲线如图所示。
①从反应开始到
 内,用
内,用 的浓度变化表示的平均反应速率为
的浓度变化表示的平均反应速率为②该反应的化学方程式为
③若
 均为气体,在
均为气体,在 时,向容器中通入氩气(容器体积不变),
时,向容器中通入氩气(容器体积不变), 的反应速率将
的反应速率将④若
 均为气体,下列能说明该反应达到平衡状态的是
均为气体,下列能说明该反应达到平衡状态的是a.
 三种气体的浓度相等
三种气体的浓度相等b.混合气体的质量不随时间变化
c.混合气体的密度不随时间变化
d.单位时间内消耗X和
 的物质的量之比为
的物质的量之比为
(2)实验室用
 溶液与
溶液与 溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知
溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知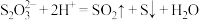 ):
):| 实验序号 | 体积/ | 温度/ | 溶液出现浑浊的时间/s | ||
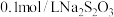 溶液 溶液 | 水 | 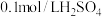 溶液 溶液 | |||
| 1 | 2.0 | 0.0 | 2.0 | 25 |  |
| 2 | 2.0 | 0.0 | 2.0 | 50 |  |
| 3 | 1.0 | V | 2.0 | T |  |
②对比实验1和3来探究浓度对化学反应速率的影响,则

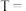
您最近一年使用:0次
2023-07-28更新
|
280次组卷
|
2卷引用:湖南师大附中博才实验中学2022-2023年高一下学期期末考试化学试题
名校
解题方法
6 . 金属钛具有密度小、强度高、耐腐蚀、无毒等优点,已广泛应用于航空航天工业,并逐步进入了化工、船舶、汽车、体育器材、医疗等民用领域,并显示出了巨大的发展潜力。还原法是工业上冶炼钛常用方法之一,该方法是以金红石(主要含 )为原料来制取,其主要工艺流程如下:
)为原料来制取,其主要工艺流程如下:
试回答下列问题:
(1)已知反应①通常在800~900℃的条件下进行,产物中有一种可燃性无色气体,写出反应①的化学方程式___________ 。
(2)反应②通常在800℃的条件下进行,通入氩气的目的是___________ ;
(3)下列推断不合理的是___________
(4)分离反应2的产物所得到的海绵钛中常混有少量杂质,应如何除去杂质?___________ 简述操作过程)。
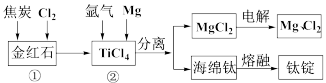
(5)②中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为___________ ℃。
 )为原料来制取,其主要工艺流程如下:
)为原料来制取,其主要工艺流程如下:
试回答下列问题:
(1)已知反应①通常在800~900℃的条件下进行,产物中有一种可燃性无色气体,写出反应①的化学方程式
(2)反应②通常在800℃的条件下进行,通入氩气的目的是
(3)下列推断不合理的是___________
| A.钛在高温下可能易与氧气反应 |
| B.镁的熔点比钛的熔点高 |
| C.钛的金属活动性比镁的金属活动性强 |
D.反应②产生的 可作为电解法制取镁的原料 可作为电解法制取镁的原料 |
(5)②中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为

您最近一年使用:0次
名校
解题方法
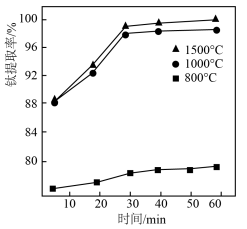
7 . 二草酸合铜(II)酸钾晶体 是一种重要的化工原料,微溶于冷水、酒精,可溶于热水,干燥时较为稳定,加热时易分解。制备产品二草酸合铜酸钾晶体可采用如下步骤,下列说法错误的是
是一种重要的化工原料,微溶于冷水、酒精,可溶于热水,干燥时较为稳定,加热时易分解。制备产品二草酸合铜酸钾晶体可采用如下步骤,下列说法错误的是
已知:25℃草酸和碳酸的电离平衡常数数值如下表。
 是一种重要的化工原料,微溶于冷水、酒精,可溶于热水,干燥时较为稳定,加热时易分解。制备产品二草酸合铜酸钾晶体可采用如下步骤,下列说法错误的是
是一种重要的化工原料,微溶于冷水、酒精,可溶于热水,干燥时较为稳定,加热时易分解。制备产品二草酸合铜酸钾晶体可采用如下步骤,下列说法错误的是
已知:25℃草酸和碳酸的电离平衡常数数值如下表。
电离平衡常数 |
|
|
|
|
|
|
|
|
| A.过程①微热的目的是加快草酸溶解,但会使草酸分解 |
| B.过程②中加入的碳酸钾物质的量与草酸物质的量相等时,得到草酸氢钾溶液 |
| C.操作③为趁热过滤,操作④为降温结晶、过滤洗涤、干燥 |
| D.得到的产品用酒精洗涤优于冷水洗涤 |
您最近一年使用:0次
2023-05-23更新
|
98次组卷
|
2卷引用:湖南省常德市 临澧县第一中学2023-2024学年高三上学期第五次阶段性考试化学试题
名校
解题方法
8 . 三氧化二镍( )是重要的电子元件和蓄电池材料,工业上利用含镍废料(主要含Ni、Al、Fe的氧化物,
)是重要的电子元件和蓄电池材料,工业上利用含镍废料(主要含Ni、Al、Fe的氧化物, ,C等)制备
,C等)制备 的工艺流程如下所示:
的工艺流程如下所示:
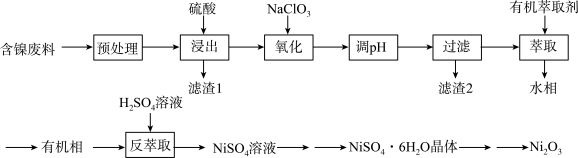
已知:①在该实验条件下 、
、 不能氧化
不能氧化 。
。
②常温下,溶液中0.010 mol/L金属离子形成氢氧化物沉淀的pH如下表所示:
③萃取的原理为 (水相)
(水相) (有机相)
(有机相)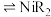 (有机相)
(有机相) (水相)
(水相)
回答下列问题:
(1)“预处理”时,可以用_______ (填化学式)溶液除去废料表面的油脂油污。
(2)“浸出”时,提高浸出效率可采取的措施有_______ (任写一种)。
(3)“氧化”时,加入 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(4)若常温下,“调pH”时,溶液中 浓度为0.1 mol/L,为使
浓度为0.1 mol/L,为使 等杂质离子沉淀完全(
等杂质离子沉淀完全(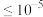 mol/L),经过计算,需控制溶液的pH范围是
mol/L),经过计算,需控制溶液的pH范围是_______ 。
(5)“萃取”时,操作若在实验室进行,需要用到的主要玻璃仪器有_______ 、烧杯。请利用化学平衡原理解释该流程中用 反萃取的原理
反萃取的原理_______ 。
 )是重要的电子元件和蓄电池材料,工业上利用含镍废料(主要含Ni、Al、Fe的氧化物,
)是重要的电子元件和蓄电池材料,工业上利用含镍废料(主要含Ni、Al、Fe的氧化物, ,C等)制备
,C等)制备 的工艺流程如下所示:
的工艺流程如下所示:
已知:①在该实验条件下
 、
、 不能氧化
不能氧化 。
。②常温下,溶液中0.010 mol/L金属离子形成氢氧化物沉淀的pH如下表所示:
离子 pH |  |  |  |  |
| 开始沉淀pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 完全沉淀pH | 8.7 | 4.7 | 3.2 | 9.0 |
 (水相)
(水相) (有机相)
(有机相)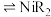 (有机相)
(有机相) (水相)
(水相)回答下列问题:
(1)“预处理”时,可以用
(2)“浸出”时,提高浸出效率可采取的措施有
(3)“氧化”时,加入
 发生反应的离子方程式为
发生反应的离子方程式为(4)若常温下,“调pH”时,溶液中
 浓度为0.1 mol/L,为使
浓度为0.1 mol/L,为使 等杂质离子沉淀完全(
等杂质离子沉淀完全(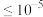 mol/L),经过计算,需控制溶液的pH范围是
mol/L),经过计算,需控制溶液的pH范围是(5)“萃取”时,操作若在实验室进行,需要用到的主要玻璃仪器有
 反萃取的原理
反萃取的原理
您最近一年使用:0次
2023-05-02更新
|
273次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
9 . 钒铬还原渣是钠化提钒过程的固体废弃物,其主要成分为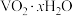 、
、 及少量的
及少量的 ,一种初步分离钒铬还原渣中的钒铬并获得
,一种初步分离钒铬还原渣中的钒铬并获得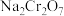 的工艺流程如图:
的工艺流程如图:
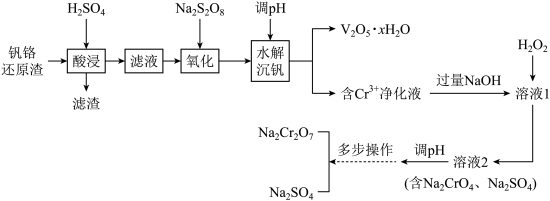
已知:①“酸浸”后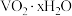 转化为
转化为 ;
;
② ;
;
③ 的
的 近似为
近似为 ;
;
④有关物质的溶解度(g/100 g )如表所示:
)如表所示:
回答下列问题:
(1)写出“滤渣”的一种用途:___________ ,“氧化”操作单元中,消耗的氧化剂与还原剂的物质的量之比为___________ 。
(2)若“含 净化液”中
净化液”中 ,则“水解沉钒”调pH的范围是2.5
,则“水解沉钒”调pH的范围是2.5___________ 。
(3)“溶液1”中含 ,加入
,加入 后发生的化学反应方程式为
后发生的化学反应方程式为___________ 。
(4)“溶液2”调pH所发生反应的离子方程式为___________ 。
(5)“多步操作”包括蒸发结晶、趁热过滤、所得滤液冷却结晶、过滤、洗涤等步骤,其中蒸发结晶时,过度蒸发将导致___________ 。
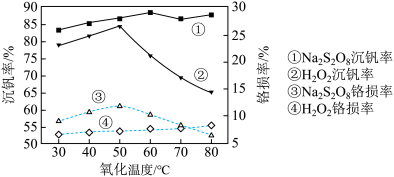
(6)研究温度对 与
与 的氧化一水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。由图可如,分别采用
的氧化一水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。由图可如,分别采用 、
、 进行“氧化”时,应选择的适宜温度是
进行“氧化”时,应选择的适宜温度是___________ 、___________ 。
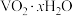 、
、 及少量的
及少量的 ,一种初步分离钒铬还原渣中的钒铬并获得
,一种初步分离钒铬还原渣中的钒铬并获得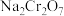 的工艺流程如图:
的工艺流程如图:
已知:①“酸浸”后
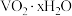 转化为
转化为 ;
;②
 ;
;③
 的
的 近似为
近似为 ;
;④有关物质的溶解度(g/100 g
 )如表所示:
)如表所示:| 温度/℃ | 20 | 40 | 60 | 80 | 100 |
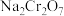 | 183.6 | 215.1 | 269.2 | 376.4 | 415.0 |
 | 19.5 | 48.8 | 45.3 | 43.7 | 42.5 |
(1)写出“滤渣”的一种用途:
(2)若“含
 净化液”中
净化液”中 ,则“水解沉钒”调pH的范围是2.5
,则“水解沉钒”调pH的范围是2.5(3)“溶液1”中含
 ,加入
,加入 后发生的化学反应方程式为
后发生的化学反应方程式为(4)“溶液2”调pH所发生反应的离子方程式为
(5)“多步操作”包括蒸发结晶、趁热过滤、所得滤液冷却结晶、过滤、洗涤等步骤,其中蒸发结晶时,过度蒸发将导致
(6)研究温度对
 与
与 的氧化一水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。由图可如,分别采用
的氧化一水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。由图可如,分别采用 、
、 进行“氧化”时,应选择的适宜温度是
进行“氧化”时,应选择的适宜温度是
您最近一年使用:0次
10 . 工业上可通过甲醇羰基化法制取甲酸甲酯(HCOOCH3):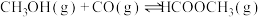 ,在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图实线所示(图中虚线表示相同条件下CO的平衡转化率随温度的变化)。下列说法不合理的是
,在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图实线所示(图中虚线表示相同条件下CO的平衡转化率随温度的变化)。下列说法不合理的是
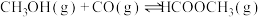 ,在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图实线所示(图中虚线表示相同条件下CO的平衡转化率随温度的变化)。下列说法不合理的是
,在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图实线所示(图中虚线表示相同条件下CO的平衡转化率随温度的变化)。下列说法不合理的是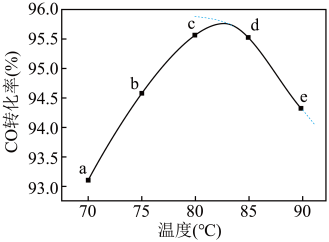
| A.适当增大压强可增大甲醇的平衡转化率 |
B.c点反应速率 |
C.反应速率 ,平衡常数 ,平衡常数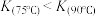 |
| D.生产时反应温度控制在80~85℃为宜 |
您最近一年使用:0次
2023-02-11更新
|
716次组卷
|
9卷引用:湖南省郴州市2021-2022学年高二上学期期末考试化学试题