名校
解题方法
1 . 以废银(主要含Ag,以及少量SiO2、α-Al2O3杂质)为原料提取高纯度银的流程如图1所示,其他条件相同,浸出率与温度、时间的关系分别如图2和图3所示:
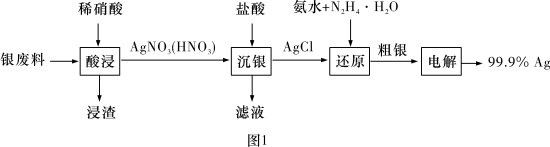
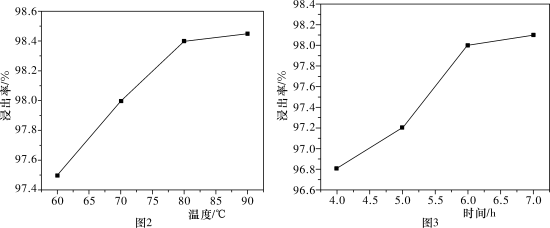
| A.最佳生产条件是温度为80℃、时间为6.0 h |
| B.浸渣的主要成分是SiO2 |
| C.“电解”中向AgNO3溶液中添加少量NaNO3能增强导电性 |
| D.理论上制备21.6 g Ag需要消耗2.5gN2H4·H2O |
您最近一年使用:0次
2023-08-16更新
|
209次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高三上学期入学考试(暑假作业检测)化学试题
名校
2 . 下列说法中操作正确、能达到目的且判断正确的是
| 说法 | 操作 | 目的 | 判断 |
| A | 合成氨时在经济性良好的范围内选择尽可能高的压强 | 增加 转化率和反应速率 转化率和反应速率 | 正确,压强增大使得反应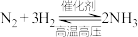 向右进行 向右进行 |
| B | 向 和生石灰混合体系加压 和生石灰混合体系加压 | 使 尽可能被吸收 尽可能被吸收 | 错误,根据反应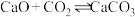 的 的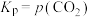 可知,压强增大不能使 可知,压强增大不能使 的分压发生改变 的分压发生改变 |
| C | 向两支盛有2mL 的乙二酸试管中滴加1mL浓度分别为 的乙二酸试管中滴加1mL浓度分别为 和 和 的 的 溶液 溶液 | 探究反应物浓度对反应速率的影响 | 正确,浓度越大反应速率越快, 褪色越快 褪色越快 |
| D | 向滴有KSCN溶液的 溶液中加入KCl固体 溶液中加入KCl固体 | 探究浓度对平衡的影响 | 正确,增加KCl浓度,使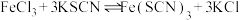 平衡移动 平衡移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 钪(Sc)及其化合物在电子、超导合金和催化剂等领域有重要应用。一种利用钛白废酸(含TiO2+、Sc3+、Fe3+等离子的硫酸废液)和拜尔法赤泥(含有Sc2O3、Al2O3、Fe2O3、SiO2等)联合提取钪的工艺流程如下。

回答下列问题:
(1)“酸浸”所得浸渣的主要成分是_______ 。
(2)“洗钛”中H2O2的作用是_______ (填标号)。
A.作氧化剂 B.作还原剂 C.作配体
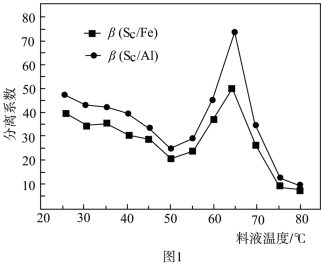
(3)“萃取”是用酸性磷酸酯萃取剂(P507)、苯乙酮、磺化煤油配得的混合液作萃取剂,P507质量分数(w)对萃取率的影响如表所示、料液温度对分离系数(β)的影响如图1所示,萃取时P507最佳质量分数及料液温度分别为_______ 、_______ 。
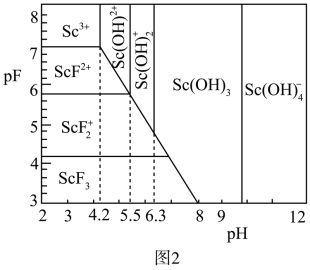
(4)含钪元素的微粒与pF[pF=–lgc(F–)]、pH的关系如图2所示,用氨水调节溶液的pH最好小于_______ ,“沉钪”所得滤液中c(F–)应大于_______ mol·L1。
(5)传统制备ScF3的方法是先得到ScF3·6H2O,再高温脱水得到ScF3,但所得ScF3通常含有ScOF杂质,原因是_______ (用化学方程式表示)。已知该流程中“沉钪”所得滤渣是ScF3与NH4Cl形成的水合复盐沉淀,“脱水除铵”可制得高纯度ScF3的原因是_______ 。

回答下列问题:
(1)“酸浸”所得浸渣的主要成分是
(2)“洗钛”中H2O2的作用是
A.作氧化剂 B.作还原剂 C.作配体
(3)“萃取”是用酸性磷酸酯萃取剂(P507)、苯乙酮、磺化煤油配得的混合液作萃取剂,P507质量分数(w)对萃取率的影响如表所示、料液温度对分离系数(β)的影响如图1所示,萃取时P507最佳质量分数及料液温度分别为
| w(P507)/% | 分相情况 | 钪萃取率/% | 铁萃取率/% |
| 1 | 分相容易 | 90.74 | 14.89 |
| 2 | 分相容易 | 91.74 | 19.88 |
| 3 | 分相容易 | 92.14 | 13.30 |
| 5 | 有第三相 | 90.59 | 28.47 |
| 8 | 轻微乳化 | 90.59 | 34.85 |

(4)含钪元素的微粒与pF[pF=–lgc(F–)]、pH的关系如图2所示,用氨水调节溶液的pH最好小于

(5)传统制备ScF3的方法是先得到ScF3·6H2O,再高温脱水得到ScF3,但所得ScF3通常含有ScOF杂质,原因是
您最近一年使用:0次
2022-05-24更新
|
178次组卷
|
2卷引用:湖南省岳阳县第一中学2022届高三下学期5月月考化学试题
名校
解题方法
4 . 氢化铝锂(LiAlH4)是一种极强的还原剂,在干燥空气中较稳定,在潮湿的空气中会发生剧烈水解,释放大量的H2并燃烧。某实验小组采用LiH和AlCl3的乙醚溶液进行反应,温度控制在28~31 ℃,反应完全后过滤氯化锂沉淀,再将过滤后的氢化铝锂乙醚溶液加苯蒸馏,得到氢化铝锂产品,实验装置如图1所示。已知:乙醚(沸点:34.6 ℃)在空气的作用下能被氧化成过氧化物、醛和乙酸,当乙醚中含有过氧化物时,蒸发后所分离残留的过氧化物加热到100 ℃以上时能引起强烈爆炸。
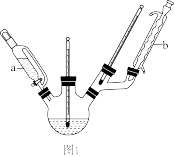
(1)仪器a的名称是_______ 。制取LiAlH4的实验原理_______ (用化学方程式表示)。
(2)反应温度控制在28~31℃的原因是_______ 。
(3)制备LiAlH4要在非水溶液中进行,原因是_______ (用化学方程式表示)。
(4)指出该实验装置可能存在的缺点:_______ 。
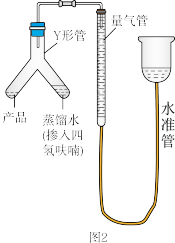
(5)氢化铝锂(不含氢化锂)纯度的测定:称取a g LiAlH4样品,按图2所示的装置组装好仪器,倾斜Y形管,将蒸馏水(掺有四氢呋喃)全部注入样品中,在标准状况下,反应前量气管(由碱式滴定管改装而成)读数为V1 mL,反应完毕冷却后,读出量气管读数的操作是_______ 。假设反应完毕后量气管读数为V2 mL,该样品的纯度为_______ (用含a、V1、V2的代数式表示)。

(1)仪器a的名称是
(2)反应温度控制在28~31℃的原因是
(3)制备LiAlH4要在非水溶液中进行,原因是
(4)指出该实验装置可能存在的缺点:
(5)氢化铝锂(不含氢化锂)纯度的测定:称取a g LiAlH4样品,按图2所示的装置组装好仪器,倾斜Y形管,将蒸馏水(掺有四氢呋喃)全部注入样品中,在标准状况下,反应前量气管(由碱式滴定管改装而成)读数为V1 mL,反应完毕冷却后,读出量气管读数的操作是

您最近一年使用:0次
5 . 含氮化合物在生产生活中有重要的应用。请回答:
(1)NOx与含硫化合物的热化学方程式如下:
反应I:CaS(s)+3NO2(g)=CaO(s)+SO2(g)+3NO(g) △H=-279.12kJ·mol-1 K1
反应II:CaS(s)+4NO2(g)=CaSO4(s)+4NO(g) △H=-714.52kJ·mol-1 K2
反应III:CaSO4(s)+NO(g)=CaO(s)+SO2(g)+NO2(g) △H K3
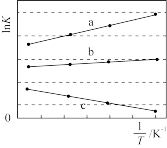
①三个反应的平衡常数的lnK随温度变化关系如图所示,则表示lnK2的曲线是____ 。
②在恒温条件下,加入反应物,一段时间后达到平衡时c(SO2)如图所示,t1时减小容器体积,t2时达到新平衡,请画出t1至t2时c(SO2)变化趋势图____ 。
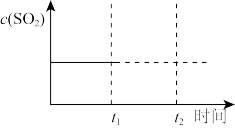
(2)合成氨工厂以“水煤气”和N2为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、H2、H2O、N2的混合气体,在反应器A进行合成氨,其催化剂III铁触媒,在500℃活性最大,反应器B中主要发生的反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H<0,装置如图。
CO2(g)+H2(g) △H<0,装置如图。
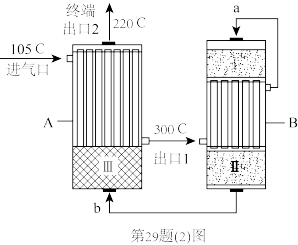
①温度比较:气流a____ 气流b(填“>”“<”或“=”)。
②气体流速一定,经由催化剂I到催化剂II,原料转化率有提升,其可能原因是:____ 。
③下列说法正确的是____ 。
A.利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成
B.N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高
2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高
C.终端出口2得到的气体,通过水吸收,再加热水溶液,可分离出NH3
D.反应原料气从进气口105℃到300℃出口1,已完成氨的合成
(3)已知-33℃液氨中存在:2NH3(l) NH
NH +NH
+NH K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH
K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH )=
)=____ mol·L-1。金属钾能溶解于液氨中形成蓝色的液氨溶液,反应的化学方程式为K+NH3=K++e(NH3) (电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式
(电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式____ 。
(1)NOx与含硫化合物的热化学方程式如下:
反应I:CaS(s)+3NO2(g)=CaO(s)+SO2(g)+3NO(g) △H=-279.12kJ·mol-1 K1
反应II:CaS(s)+4NO2(g)=CaSO4(s)+4NO(g) △H=-714.52kJ·mol-1 K2
反应III:CaSO4(s)+NO(g)=CaO(s)+SO2(g)+NO2(g) △H K3
①三个反应的平衡常数的lnK随温度变化关系如图所示,则表示lnK2的曲线是

②在恒温条件下,加入反应物,一段时间后达到平衡时c(SO2)如图所示,t1时减小容器体积,t2时达到新平衡,请画出t1至t2时c(SO2)变化趋势图
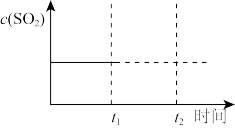
(2)合成氨工厂以“水煤气”和N2为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、H2、H2O、N2的混合气体,在反应器A进行合成氨,其催化剂III铁触媒,在500℃活性最大,反应器B中主要发生的反应为:CO(g)+H2O(g)
 CO2(g)+H2(g) △H<0,装置如图。
CO2(g)+H2(g) △H<0,装置如图。
①温度比较:气流a
②气体流速一定,经由催化剂I到催化剂II,原料转化率有提升,其可能原因是:
③下列说法正确的是
A.利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成
B.N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高
2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高C.终端出口2得到的气体,通过水吸收,再加热水溶液,可分离出NH3
D.反应原料气从进气口105℃到300℃出口1,已完成氨的合成
(3)已知-33℃液氨中存在:2NH3(l)
 NH
NH +NH
+NH K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH
K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH )=
)= (电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式
(电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式
您最近一年使用:0次
2022-05-11更新
|
940次组卷
|
2卷引用:湖南省株洲市攸县第四中学2022-2023学年高三上学期第五次月考化学试题
解题方法
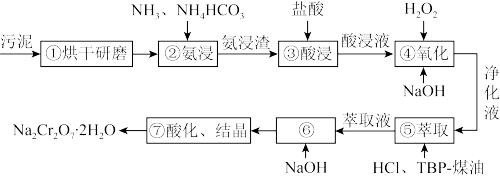
6 . 电镀污泥[主要含Cr(III)、Fe(III)、Cu(II)、Ni(II)等]中铬资源再利用生产红矾钠,该工业流程如图:
已知:(1)相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
(2)Cr(VI)在酸性和碱性环境下的存在形式分别为Cr2O 、CrO
、CrO 。
。
回答下列问题:
(1)将污泥烘干、研磨的目的是____ 。
(2)温度对氨浸浸出率的影响如图所示,氨浸的适宜温度为____ 左右,80℃以上铜镍浸出率下降的原因为____ 。

(3)氧化步骤中pH应控制的范围为____ ,H2O2发生反应的离子方程式为____ 。
(4)步骤⑥中加入NaOH的工艺名称为____ ,可循环利用的物质有____ (填选项)。
A.萃取余液 B.盐酸 C.NaOH D.结晶后母液
(5)若实验取干污泥250g,其中含Cr11.2%,实验所得晶体为59.6g,则Cr回收率为____ 。
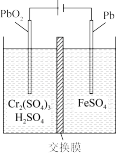
(6)通过电解法也可以将Cr(III)转化为Cr(VI)回收,装置如图,中间为____ (填“阳离子”、“阴离子”、“质子”)交换膜,阳极的反应式为_____ 。

已知:(1)相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Ni2+ | 6.7 | 9.5 |
| Cr3+ | 4.0 | 6.8 |
| Cu2+ | 6 | 9 |
 、CrO
、CrO 。
。回答下列问题:
(1)将污泥烘干、研磨的目的是
(2)温度对氨浸浸出率的影响如图所示,氨浸的适宜温度为

(3)氧化步骤中pH应控制的范围为
(4)步骤⑥中加入NaOH的工艺名称为
A.萃取余液 B.盐酸 C.NaOH D.结晶后母液
(5)若实验取干污泥250g,其中含Cr11.2%,实验所得晶体为59.6g,则Cr回收率为
(6)通过电解法也可以将Cr(III)转化为Cr(VI)回收,装置如图,中间为

您最近一年使用:0次
2022-05-01更新
|
409次组卷
|
2卷引用:湖南省2022届高三二轮复习联考(二)化学试题
名校
解题方法
7 . 一种制取电池级二氧化锰的工艺流程如下图:
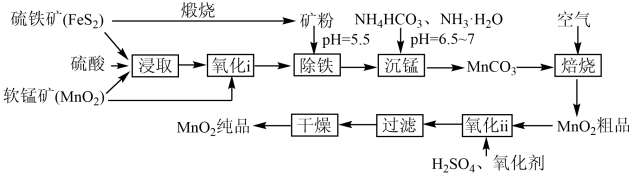
回答下列问题:
(1)“浸取”过程有硫单质生成,写出该过程中主要反应的化学方程式_______ 。
(2)“氧化ⅰ”过程软锰矿的作用是_______ 。“氧化ⅱ”过程中,将Mn(Ⅱ)转化为Mn(Ⅳ)的最适宜氧化剂是_______ (填标号)。
a. b.
b. c.
c.
(3)工业上煅烧硫铁矿产生的 气体可以用石灰乳吸收。常温下,测得
气体可以用石灰乳吸收。常温下,测得 与水形成的浊液pH为9,若忽略
与水形成的浊液pH为9,若忽略 的第二步水解,则
的第二步水解,则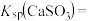
_______ (保留三位有效数字)[已知:室温下亚硫酸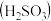 的电离平衡常数
的电离平衡常数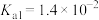 ,
, ]
]
(4)“沉锰”过程 转化为
转化为 的离子方程式为
的离子方程式为_______ 。在一定空气流速下,相同时间内“焙烧” ,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
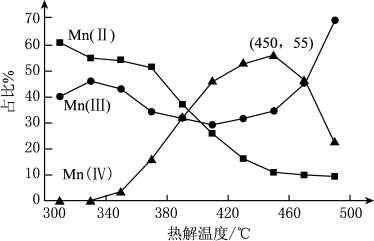
①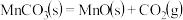
②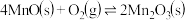

③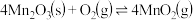

为了增大产物中 的占比,可以采用的措施是
的占比,可以采用的措施是_______ (答出两条)。将制备获得的电池级二氧化锰用于构建水系锌锰电池,其工作原理为: ,放电时正极的电极反应式为
,放电时正极的电极反应式为_______ 。
(5)用氧化还原法测定 纯品纯度(杂质不参与下列反应):称取
纯品纯度(杂质不参与下列反应):称取 样品0.1000g,试样经过过氧化钠碱熔后,得到
样品0.1000g,试样经过过氧化钠碱熔后,得到 溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时
溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时 歧化为
歧化为 和
和 ,过滤除去
,过滤除去 ,用
,用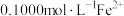 标准溶液滴定
标准溶液滴定 ,用去37.00mL,则样品中
,用去37.00mL,则样品中 的质量分数为
的质量分数为_______ (保留3位有效数字)。

回答下列问题:
(1)“浸取”过程有硫单质生成,写出该过程中主要反应的化学方程式
(2)“氧化ⅰ”过程软锰矿的作用是
a.
 b.
b. c.
c.
(3)工业上煅烧硫铁矿产生的
 气体可以用石灰乳吸收。常温下,测得
气体可以用石灰乳吸收。常温下,测得 与水形成的浊液pH为9,若忽略
与水形成的浊液pH为9,若忽略 的第二步水解,则
的第二步水解,则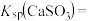
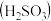 的电离平衡常数
的电离平衡常数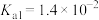 ,
, ]
](4)“沉锰”过程
 转化为
转化为 的离子方程式为
的离子方程式为 ,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
①
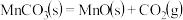
②
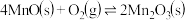

③
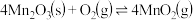

为了增大产物中
 的占比,可以采用的措施是
的占比,可以采用的措施是 ,放电时正极的电极反应式为
,放电时正极的电极反应式为(5)用氧化还原法测定
 纯品纯度(杂质不参与下列反应):称取
纯品纯度(杂质不参与下列反应):称取 样品0.1000g,试样经过过氧化钠碱熔后,得到
样品0.1000g,试样经过过氧化钠碱熔后,得到 溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时
溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时 歧化为
歧化为 和
和 ,过滤除去
,过滤除去 ,用
,用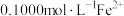 标准溶液滴定
标准溶液滴定 ,用去37.00mL,则样品中
,用去37.00mL,则样品中 的质量分数为
的质量分数为
您最近一年使用:0次
2022-04-29更新
|
1249次组卷
|
4卷引用:湖南省长沙市长沙县第一中学2021-2022学年高三下学期期中考试化学试题
湖南省长沙市长沙县第一中学2021-2022学年高三下学期期中考试化学试题山东省济宁市2022届高三第二次模拟考试化学试题湖北省武汉市第二中学2022届高三5月全仿真模拟考试(一)化学试题(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题
名校
解题方法
8 . 烟气脱硫脱硝技术是环境科学研究的热点。某小组模拟 氧化结合
氧化结合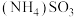 溶液吸收法同时脱除
溶液吸收法同时脱除 和NO的过程示意图如下。
和NO的过程示意图如下。
①已知: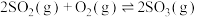
 ,则
,则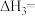
_______ 。
②其他条件不变时,高于150℃,在相同时间内 和NO的转化率均随温度升高而降低,原因是
和NO的转化率均随温度升高而降低,原因是_______ 。
③其他条件不变, 和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内,
和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内, 和NO的转化率随
和NO的转化率随 的浓度的变化如图。结合数据分析NO的转化率高于
的浓度的变化如图。结合数据分析NO的转化率高于 的原因
的原因_______ 。 和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,
和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内, 与NO的物质的量之比对
与NO的物质的量之比对 和NO脱除率的影响如图。
和NO脱除率的影响如图。 溶液显碱性,用化学平衡原理解释:
溶液显碱性,用化学平衡原理解释:_______ 。
② 的浓度很低时,
的浓度很低时, 的脱除率超过97%,原因是
的脱除率超过97%,原因是_______ 。
③在吸收器中, 与
与 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是_______ 。
④在吸收器中,随着吸收过程的进行,部分 被转化为
被转化为 ,反应中
,反应中 和
和 的物质的量之比为1:1,该反应的离子方程式是
的物质的量之比为1:1,该反应的离子方程式是_______ 。
 氧化结合
氧化结合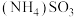 溶液吸收法同时脱除
溶液吸收法同时脱除 和NO的过程示意图如下。
和NO的过程示意图如下。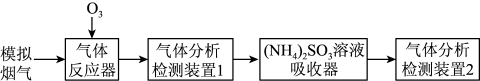
| 反应 | 平衡常数(25℃) | 活化能/(kJ/mol) |
反应a: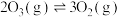 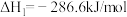 |  | 24.6 |
反应b: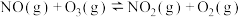 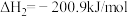 | 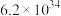 | 3.17 |
反应c:  | 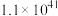 | 58.17 |
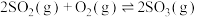
 ,则
,则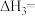
②其他条件不变时,高于150℃,在相同时间内
 和NO的转化率均随温度升高而降低,原因是
和NO的转化率均随温度升高而降低,原因是③其他条件不变,
 和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内,
和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内, 和NO的转化率随
和NO的转化率随 的浓度的变化如图。结合数据分析NO的转化率高于
的浓度的变化如图。结合数据分析NO的转化率高于 的原因
的原因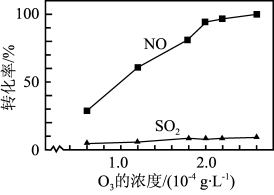
 和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,
和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内, 与NO的物质的量之比对
与NO的物质的量之比对 和NO脱除率的影响如图。
和NO脱除率的影响如图。
 溶液显碱性,用化学平衡原理解释:
溶液显碱性,用化学平衡原理解释:②
 的浓度很低时,
的浓度很低时, 的脱除率超过97%,原因是
的脱除率超过97%,原因是③在吸收器中,
 与
与 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是④在吸收器中,随着吸收过程的进行,部分
 被转化为
被转化为 ,反应中
,反应中 和
和 的物质的量之比为1:1,该反应的离子方程式是
的物质的量之比为1:1,该反应的离子方程式是
您最近一年使用:0次
2022-04-10更新
|
835次组卷
|
6卷引用:湖南省隆回县第一中学2022届高三下学期第二次模拟考试化学试题
9 . 运用化学反应原理研究碳、硫、氮元素单质及化合物对缓解环境污染具有重要意义。
(1)有毒的CO与SO2气体在一定条件下可转化为S和无毒的CO2,已知S的燃烧热为296kJ·mol-1,CO的燃烧热为283kJ·mol-1,则CO和SO2转化为单质S(s)和CO2的热化学方程式为____ 。
(2)在容积为2L的恒容密闭容器中,充入2molCO和3molNO,在t℃下发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g),起始压强为p0。实验测得N2(g)的物质的量随时间变化如图所示:
N2(g)+2CO2(g),起始压强为p0。实验测得N2(g)的物质的量随时间变化如图所示:
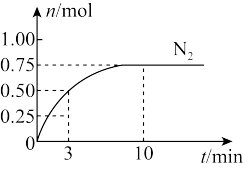
①从反应开始到3minCO2的平均反应速率v(CO2)=____ (保留三位小数)。
②向平衡体系中再加入0.1molCO和0.1molCO2,平衡____ (填“向正及应方向”“向逆反应方向”或“不”)移动。
③t℃时、反应的分压平衡常数Kp=____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)氨气催化还原氮氧化物(SCR)技术是目前用应用广泛的烟气氮氧化物脱除技术。在氮气足量的情况下,不同 ,不同温度对脱氮率的影响如图所示,从氮氧化物比例和温度这两个角度考虑,为达到最佳脱氮率所选择的条件是
,不同温度对脱氮率的影响如图所示,从氮氧化物比例和温度这两个角度考虑,为达到最佳脱氮率所选择的条件是____ 。
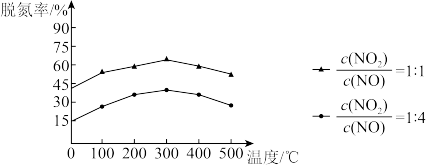
(4)有毒的NO2和NO气体若被100mL0.2mol·L-1的NaOH溶液恰好完全吸收,生成两种正盐,则标准状况下这两种气体的总体积为____ mL。
(5)将CO、O2和熔融K2CO3制成燃料电池,其工作原理如图所示。石墨II为____ (填“正”或“负”)极,石墨I的电极反应式为____ 。
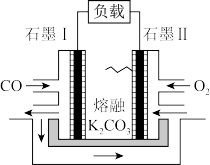
(1)有毒的CO与SO2气体在一定条件下可转化为S和无毒的CO2,已知S的燃烧热为296kJ·mol-1,CO的燃烧热为283kJ·mol-1,则CO和SO2转化为单质S(s)和CO2的热化学方程式为
(2)在容积为2L的恒容密闭容器中,充入2molCO和3molNO,在t℃下发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g),起始压强为p0。实验测得N2(g)的物质的量随时间变化如图所示:
N2(g)+2CO2(g),起始压强为p0。实验测得N2(g)的物质的量随时间变化如图所示:
①从反应开始到3minCO2的平均反应速率v(CO2)=
②向平衡体系中再加入0.1molCO和0.1molCO2,平衡
③t℃时、反应的分压平衡常数Kp=
(3)氨气催化还原氮氧化物(SCR)技术是目前用应用广泛的烟气氮氧化物脱除技术。在氮气足量的情况下,不同
 ,不同温度对脱氮率的影响如图所示,从氮氧化物比例和温度这两个角度考虑,为达到最佳脱氮率所选择的条件是
,不同温度对脱氮率的影响如图所示,从氮氧化物比例和温度这两个角度考虑,为达到最佳脱氮率所选择的条件是
(4)有毒的NO2和NO气体若被100mL0.2mol·L-1的NaOH溶液恰好完全吸收,生成两种正盐,则标准状况下这两种气体的总体积为
(5)将CO、O2和熔融K2CO3制成燃料电池,其工作原理如图所示。石墨II为

您最近一年使用:0次
解题方法
10 . 下列措施与化学反应速率无关的是
| A.炉膛内用煤粉代替煤块 | B.食物冷藏在冰箱 |
| C.工业合成氨时,及时将氨气液化分离 | D.在铁制品表面喷涂油漆 |
您最近一年使用:0次
2022-01-30更新
|
117次组卷
|
2卷引用:湖南省益阳市2021-2022学年高二上学期期末考试化学试题



