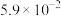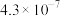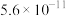名校
1 . NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的 、
、 和
和 的混合气体以一定流速通过装有催化剂的反应管,
的混合气体以一定流速通过装有催化剂的反应管, 的转化率、生成
的转化率、生成 的选择性
的选择性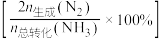 与温度的关系如图所示。下列说法正确的是
与温度的关系如图所示。下列说法正确的是
 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的 、
、 和
和 的混合气体以一定流速通过装有催化剂的反应管,
的混合气体以一定流速通过装有催化剂的反应管, 的转化率、生成
的转化率、生成 的选择性
的选择性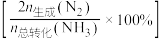 与温度的关系如图所示。下列说法正确的是
与温度的关系如图所示。下列说法正确的是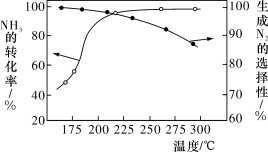
A.其他条件不变,升高温度, 的平衡转化率增大 的平衡转化率增大 |
B.其他条件不变,在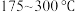 范围,随温度的升高,出口处 范围,随温度的升高,出口处 浓度不断增大 浓度不断增大 |
C.催化氧化除去尾气中的 应选择反应温度高于 应选择反应温度高于 |
D.高效除去尾气中的 ,需研发低温下 ,需研发低温下 转化率高和生成 转化率高和生成 选择性高的催化剂 选择性高的催化剂 |
您最近一年使用:0次
名校
解题方法
2 . 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖。工业合成氨生产示意图如图所示。
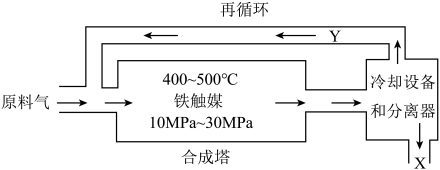
(1)下列有关合成氨工业的说法正确的是___________
(2)循环利用的Y是氮气和氢气,目的是___________ 。
(3)在合成氨工业中,要使氨的产率增大,同时又能提高反应速率,可采取的措施有___________ (填编号)。
①使用催化剂 ②恒温恒容,增大原料气 和
和 充入量 ③及时分离产生的
充入量 ③及时分离产生的
④升高温度 ⑤恒温恒容,充入惰性气体 使压强增大
使压强增大
(4)氮的固定和氮的循环是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分 值。
值。
分析数据可知:
①在 下模拟工业固氮,某时刻
下模拟工业固氮,某时刻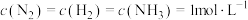 ,此时v正
,此时v正___________ v逆(填“>”“<”或“=”)。
②人类不适合大规模模拟大气固氮的原因是___________ 。
(5)哈伯1908年发表的文献中写到,在高温下,铁和铂都能作为使气态氨分解成为氢气、氮气的催化剂,下面是他做过的实验中的两组(条件都为901℃和3039.75 kPa)。
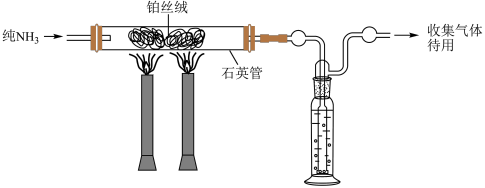
①使纯氨气通过白炽的铂丝,剩余的氨用浓硫酸洗涤除去。然后使气态混合物在相同条件下通过铁催化剂,出来的气体再缓缓通过20mL盐酸除去氨气。用气量计测得标准状况下剩余干燥气体的体积为2.02L。盐酸溶液用KOH溶液滴定,最终计算得到通入盐酸前氨气为1.86×10-4mol。
计算回答:在901℃下,N2 (g)+ 3H2 (g)
(g) 2NH3(g)的Kp=
2NH3(g)的Kp=___________ kPa-2。(保留一位有效数字)
②使纯氨气直接通过同一铁催化剂,出来的气体同样缓缓通入20mL盐酸,用气量计测得标准状况下剩余干燥气体的体积为1.82L。同理可以滴定后计算出通入盐酸前氨气的量,进而计算出Kp。在操作、计算误差合理的范围内,①、②得到的Kp基本相等。这对你有何启发?___________ 。

(1)下列有关合成氨工业的说法正确的是___________
| A.工业合成氨的反应是熵减小的放热反应,在低温时可自发进行 |
| B.合成氨反应中,反应物的总键能小于产物的总键能 |
C.合成氨厂一般采用的压强为 ,因为该压强下铁触媒的活性最高 ,因为该压强下铁触媒的活性最高 |
D. 的量越多, 的量越多, 的转化率越大,因此,充入的 的转化率越大,因此,充入的 越多越有利于 越多越有利于 的合成 的合成 |
(2)循环利用的Y是氮气和氢气,目的是
(3)在合成氨工业中,要使氨的产率增大,同时又能提高反应速率,可采取的措施有
①使用催化剂 ②恒温恒容,增大原料气
 和
和 充入量 ③及时分离产生的
充入量 ③及时分离产生的
④升高温度 ⑤恒温恒容,充入惰性气体
 使压强增大
使压强增大(4)氮的固定和氮的循环是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分
 值。
值。| 反应 | 大气固氮 | 工业固氮 | |||
温度 | 27 | 2000 | 25 | 400 | 450 |
 |  | 0.1 | 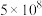 | 0.507 | 0.152 |
①在
 下模拟工业固氮,某时刻
下模拟工业固氮,某时刻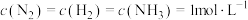 ,此时v正
,此时v正②人类不适合大规模模拟大气固氮的原因是
(5)哈伯1908年发表的文献中写到,在高温下,铁和铂都能作为使气态氨分解成为氢气、氮气的催化剂,下面是他做过的实验中的两组(条件都为901℃和3039.75 kPa)。

①使纯氨气通过白炽的铂丝,剩余的氨用浓硫酸洗涤除去。然后使气态混合物在相同条件下通过铁催化剂,出来的气体再缓缓通过20mL盐酸除去氨气。用气量计测得标准状况下剩余干燥气体的体积为2.02L。盐酸溶液用KOH溶液滴定,最终计算得到通入盐酸前氨气为1.86×10-4mol。
计算回答:在901℃下,N2 (g)+ 3H2
 (g)
(g) 2NH3(g)的Kp=
2NH3(g)的Kp=②使纯氨气直接通过同一铁催化剂,出来的气体同样缓缓通入20mL盐酸,用气量计测得标准状况下剩余干燥气体的体积为1.82L。同理可以滴定后计算出通入盐酸前氨气的量,进而计算出Kp。在操作、计算误差合理的范围内,①、②得到的Kp基本相等。这对你有何启发?
您最近一年使用:0次
2023-10-26更新
|
25次组卷
|
2卷引用:湖南省长沙市实验中学2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
3 . 金属钛具有密度小、强度高、耐腐蚀、无毒等优点,已广泛应用于航空航天工业,并逐步进入了化工、船舶、汽车、体育器材、医疗等民用领域,并显示出了巨大的发展潜力。还原法是工业上冶炼钛常用方法之一,该方法是以金红石(主要含 )为原料来制取,其主要工艺流程如下:
)为原料来制取,其主要工艺流程如下:
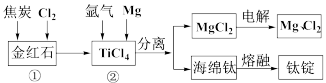
试回答下列问题:
(1)已知反应①通常在800~900℃的条件下进行,产物中有一种可燃性无色气体,写出反应①的化学方程式___________ 。
(2)反应②通常在800℃的条件下进行,通入氩气的目的是___________ ;
(3)下列推断不合理的是___________
(4)分离反应2的产物所得到的海绵钛中常混有少量杂质,应如何除去杂质?___________ 简述操作过程)。
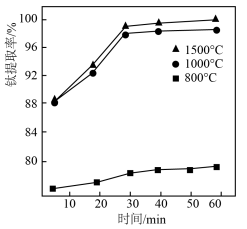
(5)②中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为___________ ℃。
 )为原料来制取,其主要工艺流程如下:
)为原料来制取,其主要工艺流程如下:
试回答下列问题:
(1)已知反应①通常在800~900℃的条件下进行,产物中有一种可燃性无色气体,写出反应①的化学方程式
(2)反应②通常在800℃的条件下进行,通入氩气的目的是
(3)下列推断不合理的是___________
| A.钛在高温下可能易与氧气反应 |
| B.镁的熔点比钛的熔点高 |
| C.钛的金属活动性比镁的金属活动性强 |
D.反应②产生的 可作为电解法制取镁的原料 可作为电解法制取镁的原料 |
(5)②中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为

您最近一年使用:0次
名校
解题方法
4 . 二草酸合铜(II)酸钾晶体 是一种重要的化工原料,微溶于冷水、酒精,可溶于热水,干燥时较为稳定,加热时易分解。制备产品二草酸合铜酸钾晶体可采用如下步骤,下列说法错误的是
是一种重要的化工原料,微溶于冷水、酒精,可溶于热水,干燥时较为稳定,加热时易分解。制备产品二草酸合铜酸钾晶体可采用如下步骤,下列说法错误的是
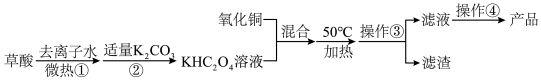
已知:25℃草酸和碳酸的电离平衡常数数值如下表。
 是一种重要的化工原料,微溶于冷水、酒精,可溶于热水,干燥时较为稳定,加热时易分解。制备产品二草酸合铜酸钾晶体可采用如下步骤,下列说法错误的是
是一种重要的化工原料,微溶于冷水、酒精,可溶于热水,干燥时较为稳定,加热时易分解。制备产品二草酸合铜酸钾晶体可采用如下步骤,下列说法错误的是
已知:25℃草酸和碳酸的电离平衡常数数值如下表。
电离平衡常数 |
|
|
|
|
|
|
|
|
| A.过程①微热的目的是加快草酸溶解,但会使草酸分解 |
| B.过程②中加入的碳酸钾物质的量与草酸物质的量相等时,得到草酸氢钾溶液 |
| C.操作③为趁热过滤,操作④为降温结晶、过滤洗涤、干燥 |
| D.得到的产品用酒精洗涤优于冷水洗涤 |
您最近一年使用:0次
2023-05-23更新
|
104次组卷
|
2卷引用:湖南省常德市 临澧县第一中学2023-2024学年高三上学期第五次阶段性考试化学试题
名校
解题方法
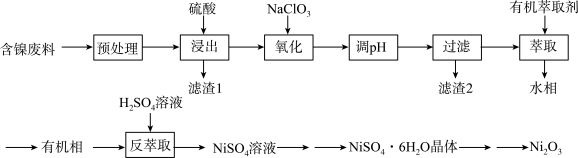
5 . 三氧化二镍( )是重要的电子元件和蓄电池材料,工业上利用含镍废料(主要含Ni、Al、Fe的氧化物,
)是重要的电子元件和蓄电池材料,工业上利用含镍废料(主要含Ni、Al、Fe的氧化物, ,C等)制备
,C等)制备 的工艺流程如下所示:
的工艺流程如下所示:
已知:①在该实验条件下 、
、 不能氧化
不能氧化 。
。
②常温下,溶液中0.010 mol/L金属离子形成氢氧化物沉淀的pH如下表所示:
③萃取的原理为 (水相)
(水相) (有机相)
(有机相)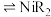 (有机相)
(有机相) (水相)
(水相)
回答下列问题:
(1)“预处理”时,可以用_______ (填化学式)溶液除去废料表面的油脂油污。
(2)“浸出”时,提高浸出效率可采取的措施有_______ (任写一种)。
(3)“氧化”时,加入 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(4)若常温下,“调pH”时,溶液中 浓度为0.1 mol/L,为使
浓度为0.1 mol/L,为使 等杂质离子沉淀完全(
等杂质离子沉淀完全(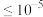 mol/L),经过计算,需控制溶液的pH范围是
mol/L),经过计算,需控制溶液的pH范围是_______ 。
(5)“萃取”时,操作若在实验室进行,需要用到的主要玻璃仪器有_______ 、烧杯。请利用化学平衡原理解释该流程中用 反萃取的原理
反萃取的原理_______ 。
 )是重要的电子元件和蓄电池材料,工业上利用含镍废料(主要含Ni、Al、Fe的氧化物,
)是重要的电子元件和蓄电池材料,工业上利用含镍废料(主要含Ni、Al、Fe的氧化物, ,C等)制备
,C等)制备 的工艺流程如下所示:
的工艺流程如下所示:
已知:①在该实验条件下
 、
、 不能氧化
不能氧化 。
。②常温下,溶液中0.010 mol/L金属离子形成氢氧化物沉淀的pH如下表所示:
离子 pH |  |  |  |  |
| 开始沉淀pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 完全沉淀pH | 8.7 | 4.7 | 3.2 | 9.0 |
 (水相)
(水相) (有机相)
(有机相)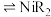 (有机相)
(有机相) (水相)
(水相)回答下列问题:
(1)“预处理”时,可以用
(2)“浸出”时,提高浸出效率可采取的措施有
(3)“氧化”时,加入
 发生反应的离子方程式为
发生反应的离子方程式为(4)若常温下,“调pH”时,溶液中
 浓度为0.1 mol/L,为使
浓度为0.1 mol/L,为使 等杂质离子沉淀完全(
等杂质离子沉淀完全(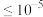 mol/L),经过计算,需控制溶液的pH范围是
mol/L),经过计算,需控制溶液的pH范围是(5)“萃取”时,操作若在实验室进行,需要用到的主要玻璃仪器有
 反萃取的原理
反萃取的原理
您最近一年使用:0次
2023-05-02更新
|
284次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
6 . 钒铬还原渣是钠化提钒过程的固体废弃物,其主要成分为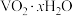 、
、 及少量的
及少量的 ,一种初步分离钒铬还原渣中的钒铬并获得
,一种初步分离钒铬还原渣中的钒铬并获得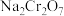 的工艺流程如图:
的工艺流程如图:
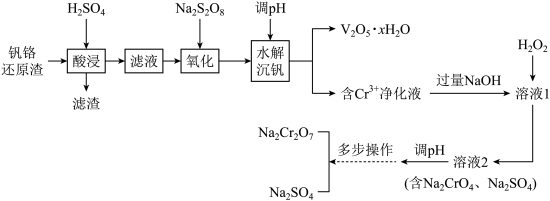
已知:①“酸浸”后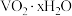 转化为
转化为 ;
;
② ;
;
③ 的
的 近似为
近似为 ;
;
④有关物质的溶解度(g/100 g )如表所示:
)如表所示:
回答下列问题:
(1)写出“滤渣”的一种用途:___________ ,“氧化”操作单元中,消耗的氧化剂与还原剂的物质的量之比为___________ 。
(2)若“含 净化液”中
净化液”中 ,则“水解沉钒”调pH的范围是2.5
,则“水解沉钒”调pH的范围是2.5___________ 。
(3)“溶液1”中含 ,加入
,加入 后发生的化学反应方程式为
后发生的化学反应方程式为___________ 。
(4)“溶液2”调pH所发生反应的离子方程式为___________ 。
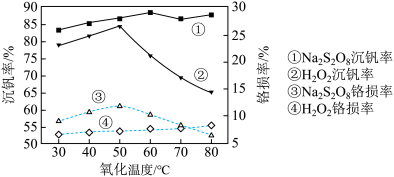
(5)“多步操作”包括蒸发结晶、趁热过滤、所得滤液冷却结晶、过滤、洗涤等步骤,其中蒸发结晶时,过度蒸发将导致___________ 。
(6)研究温度对 与
与 的氧化一水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。由图可如,分别采用
的氧化一水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。由图可如,分别采用 、
、 进行“氧化”时,应选择的适宜温度是
进行“氧化”时,应选择的适宜温度是___________ 、___________ 。
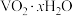 、
、 及少量的
及少量的 ,一种初步分离钒铬还原渣中的钒铬并获得
,一种初步分离钒铬还原渣中的钒铬并获得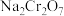 的工艺流程如图:
的工艺流程如图:
已知:①“酸浸”后
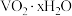 转化为
转化为 ;
;②
 ;
;③
 的
的 近似为
近似为 ;
;④有关物质的溶解度(g/100 g
 )如表所示:
)如表所示:| 温度/℃ | 20 | 40 | 60 | 80 | 100 |
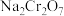 | 183.6 | 215.1 | 269.2 | 376.4 | 415.0 |
 | 19.5 | 48.8 | 45.3 | 43.7 | 42.5 |
(1)写出“滤渣”的一种用途:
(2)若“含
 净化液”中
净化液”中 ,则“水解沉钒”调pH的范围是2.5
,则“水解沉钒”调pH的范围是2.5(3)“溶液1”中含
 ,加入
,加入 后发生的化学反应方程式为
后发生的化学反应方程式为(4)“溶液2”调pH所发生反应的离子方程式为
(5)“多步操作”包括蒸发结晶、趁热过滤、所得滤液冷却结晶、过滤、洗涤等步骤,其中蒸发结晶时,过度蒸发将导致
(6)研究温度对
 与
与 的氧化一水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。由图可如,分别采用
的氧化一水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。由图可如,分别采用 、
、 进行“氧化”时,应选择的适宜温度是
进行“氧化”时,应选择的适宜温度是
您最近一年使用:0次
名校
7 . 化学对提高人类生活质量和促进社会发展具有重要作用。下列人类活动中,运用了相应的化学原理的是
| 选项 | 人类活动 | 化学原理 |
| A | 实验室用锌与稀硫酸反应制氢气,同时有热量放出 | 该反应不遵循能量守恒定律 |
| B | 游轮底部定期更换锌块 | 利用电解原理可防止腐蚀 |
| C |  溶液除铁锈 溶液除铁锈 |  水解呈酸性 水解呈酸性 |
| D | 工业合成氨通常在高温条件下进行 | 高温促进合成氨平衡正向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-04更新
|
126次组卷
|
2卷引用:湖南省长沙市长郡中学2022--2023学年高二上学期第二次线上月考化学试题
8 . 下列有关合成氨工业的说法中正确的是
| A.铁触媒作催化剂可加快反应速率,且有利于化学平衡向合成氨的方向移动 |
| B.升高温度可以加快反应速率,且有利于化学平衡向合成氨的方向移动 |
| C.增大压强能缩短达到平衡状态所用的时间 |
| D.合成氨采用的压强是10~30MPa,因为该压强下铁触媒的活性最高 |
您最近一年使用:0次
2022-07-26更新
|
756次组卷
|
17卷引用:湖南省益阳市箴言中学2021-2022学年高二上学期10月月考化学试题
湖南省益阳市箴言中学2021-2022学年高二上学期10月月考化学试题吉林省长春外国语学校2021-2022学年高二上学期第一次月考化学试题湖南省怀化市第五中学2021-2022学年高二上学期期中考试化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题湖南省隆回县第二中学2022-2023学年高二上学期线上课程摸底(期中)考试化学试题新疆昌吉州行知学校2022-2023学年高二上学期第一次线上月考化学试题黑龙江省哈尔滨市宾县第二中学2021-2022学年高二上学期第二次月考化学试题(已下线)必考点04 化学反应的方向和调控-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第12讲 化学反应的调控-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)2.4.1 合成氨生产适宜条件的选择-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)天津市第二十五中学2022 -2023学年高二上学期期中考试化学试题重庆市为明学校2022-2023学年高二上学期期末检测化学试题第四节 化学反应的调控河南省周口市太康县2022-2023学年高二上学期11月期中考试化学试题第二章 第四节 化学反应的调控(已下线)专题06 化学反应的方向及调控【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
名校
9 . 钪(Sc)及其化合物在电子、超导合金和催化剂等领域有重要应用。一种利用钛白废酸(含TiO2+、Sc3+、Fe3+等离子的硫酸废液)和拜尔法赤泥(含有Sc2O3、Al2O3、Fe2O3、SiO2等)联合提取钪的工艺流程如下。

回答下列问题:
(1)“酸浸”所得浸渣的主要成分是_______ 。
(2)“洗钛”中H2O2的作用是_______ (填标号)。
A.作氧化剂 B.作还原剂 C.作配体
(3)“萃取”是用酸性磷酸酯萃取剂(P507)、苯乙酮、磺化煤油配得的混合液作萃取剂,P507质量分数(w)对萃取率的影响如表所示、料液温度对分离系数(β)的影响如图1所示,萃取时P507最佳质量分数及料液温度分别为_______ 、_______ 。
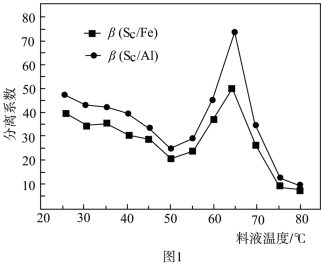
(4)含钪元素的微粒与pF[pF=–lgc(F–)]、pH的关系如图2所示,用氨水调节溶液的pH最好小于_______ ,“沉钪”所得滤液中c(F–)应大于_______ mol·L1。
(5)传统制备ScF3的方法是先得到ScF3·6H2O,再高温脱水得到ScF3,但所得ScF3通常含有ScOF杂质,原因是_______ (用化学方程式表示)。已知该流程中“沉钪”所得滤渣是ScF3与NH4Cl形成的水合复盐沉淀,“脱水除铵”可制得高纯度ScF3的原因是_______ 。

回答下列问题:
(1)“酸浸”所得浸渣的主要成分是
(2)“洗钛”中H2O2的作用是
A.作氧化剂 B.作还原剂 C.作配体
(3)“萃取”是用酸性磷酸酯萃取剂(P507)、苯乙酮、磺化煤油配得的混合液作萃取剂,P507质量分数(w)对萃取率的影响如表所示、料液温度对分离系数(β)的影响如图1所示,萃取时P507最佳质量分数及料液温度分别为
| w(P507)/% | 分相情况 | 钪萃取率/% | 铁萃取率/% |
| 1 | 分相容易 | 90.74 | 14.89 |
| 2 | 分相容易 | 91.74 | 19.88 |
| 3 | 分相容易 | 92.14 | 13.30 |
| 5 | 有第三相 | 90.59 | 28.47 |
| 8 | 轻微乳化 | 90.59 | 34.85 |

(4)含钪元素的微粒与pF[pF=–lgc(F–)]、pH的关系如图2所示,用氨水调节溶液的pH最好小于

(5)传统制备ScF3的方法是先得到ScF3·6H2O,再高温脱水得到ScF3,但所得ScF3通常含有ScOF杂质,原因是
您最近一年使用:0次
2022-05-24更新
|
176次组卷
|
2卷引用:湖南省岳阳县第一中学2022届高三下学期5月月考化学试题
10 . 含氮化合物在生产生活中有重要的应用。请回答:
(1)NOx与含硫化合物的热化学方程式如下:
反应I:CaS(s)+3NO2(g)=CaO(s)+SO2(g)+3NO(g) △H=-279.12kJ·mol-1 K1
反应II:CaS(s)+4NO2(g)=CaSO4(s)+4NO(g) △H=-714.52kJ·mol-1 K2
反应III:CaSO4(s)+NO(g)=CaO(s)+SO2(g)+NO2(g) △H K3
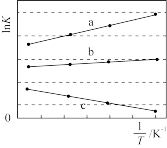
①三个反应的平衡常数的lnK随温度变化关系如图所示,则表示lnK2的曲线是____ 。
②在恒温条件下,加入反应物,一段时间后达到平衡时c(SO2)如图所示,t1时减小容器体积,t2时达到新平衡,请画出t1至t2时c(SO2)变化趋势图____ 。
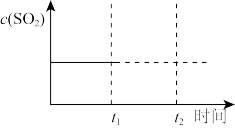
(2)合成氨工厂以“水煤气”和N2为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、H2、H2O、N2的混合气体,在反应器A进行合成氨,其催化剂III铁触媒,在500℃活性最大,反应器B中主要发生的反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H<0,装置如图。
CO2(g)+H2(g) △H<0,装置如图。
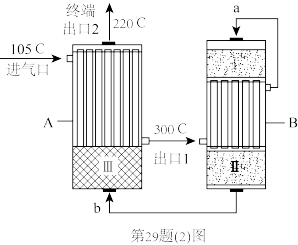
①温度比较:气流a____ 气流b(填“>”“<”或“=”)。
②气体流速一定,经由催化剂I到催化剂II,原料转化率有提升,其可能原因是:____ 。
③下列说法正确的是____ 。
A.利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成
B.N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高
2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高
C.终端出口2得到的气体,通过水吸收,再加热水溶液,可分离出NH3
D.反应原料气从进气口105℃到300℃出口1,已完成氨的合成
(3)已知-33℃液氨中存在:2NH3(l) NH
NH +NH
+NH K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH
K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH )=
)=____ mol·L-1。金属钾能溶解于液氨中形成蓝色的液氨溶液,反应的化学方程式为K+NH3=K++e(NH3) (电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式
(电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式____ 。
(1)NOx与含硫化合物的热化学方程式如下:
反应I:CaS(s)+3NO2(g)=CaO(s)+SO2(g)+3NO(g) △H=-279.12kJ·mol-1 K1
反应II:CaS(s)+4NO2(g)=CaSO4(s)+4NO(g) △H=-714.52kJ·mol-1 K2
反应III:CaSO4(s)+NO(g)=CaO(s)+SO2(g)+NO2(g) △H K3
①三个反应的平衡常数的lnK随温度变化关系如图所示,则表示lnK2的曲线是

②在恒温条件下,加入反应物,一段时间后达到平衡时c(SO2)如图所示,t1时减小容器体积,t2时达到新平衡,请画出t1至t2时c(SO2)变化趋势图
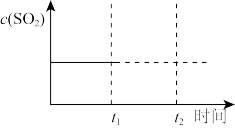
(2)合成氨工厂以“水煤气”和N2为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、H2、H2O、N2的混合气体,在反应器A进行合成氨,其催化剂III铁触媒,在500℃活性最大,反应器B中主要发生的反应为:CO(g)+H2O(g)
 CO2(g)+H2(g) △H<0,装置如图。
CO2(g)+H2(g) △H<0,装置如图。
①温度比较:气流a
②气体流速一定,经由催化剂I到催化剂II,原料转化率有提升,其可能原因是:
③下列说法正确的是
A.利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成
B.N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高
2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高C.终端出口2得到的气体,通过水吸收,再加热水溶液,可分离出NH3
D.反应原料气从进气口105℃到300℃出口1,已完成氨的合成
(3)已知-33℃液氨中存在:2NH3(l)
 NH
NH +NH
+NH K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH
K=10-29,在100mL液氨中加入0.0001mol NH4Cl固体溶解,并完全电离(忽略体积变化),则c(NH )=
)= (电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式
(电子的氨合物,显蓝色),加入NH4Cl固体,即发生共价键断裂和形成的反应,请写出离子方程式
您最近一年使用:0次
2022-05-11更新
|
874次组卷
|
2卷引用:湖南省株洲市攸县第四中学2022-2023学年高三上学期第五次月考化学试题