名校
1 . I.在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g)  2SO3(g) ΔH=—196.6kJ•mol-1(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)。表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g) ΔH=—196.6kJ•mol-1(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)。表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是________ 。
(2)在实际生产中,选定的温度为400~500℃,原因是___________ 。
(3)在实际生产中,采用的压强为常压,原因是___________ 。
(4)在实际生产中,通入过量的空气,原因是___________ 。
(5)尾气中SO2必须回收,原因是___________ 。
II.Bodenstein研究了反应:2HI(g) H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:
H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:
(6)根据上述实验结果,该反应的平衡常数K的计算式为___________ 。
(7)上述反应中,正反应速率v正=k正x2(HI),逆反应速率v逆=k逆x(H2)•x(I2),其中k正、k逆为正、逆反应速率常数,则k逆为___________ (用含K和k正的代数式表示)。
III.在刚性容器压强为1.01MPa时,乙酸甲酯与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g) CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3):n(H2)=1:10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3):n(H2)=1:10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
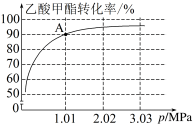
(8)A点时,CH3CH2OH(g)的体积分数为___________ %(保留一位小数)。
(9)此温度下,该反应的化学平衡常数Kp=___________ MPa-1(Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
 2SO3(g) ΔH=—196.6kJ•mol-1(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)。表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g) ΔH=—196.6kJ•mol-1(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)。表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是
(2)在实际生产中,选定的温度为400~500℃,原因是
(3)在实际生产中,采用的压强为常压,原因是
(4)在实际生产中,通入过量的空气,原因是
(5)尾气中SO2必须回收,原因是
II.Bodenstein研究了反应:2HI(g)
 H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:
H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.6 | 0.73 | 0.773 | 0.78 | 0.784 |
(6)根据上述实验结果,该反应的平衡常数K的计算式为
(7)上述反应中,正反应速率v正=k正x2(HI),逆反应速率v逆=k逆x(H2)•x(I2),其中k正、k逆为正、逆反应速率常数,则k逆为
III.在刚性容器压强为1.01MPa时,乙酸甲酯与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g)
 CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3):n(H2)=1:10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3):n(H2)=1:10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
(8)A点时,CH3CH2OH(g)的体积分数为
(9)此温度下,该反应的化学平衡常数Kp=
您最近一年使用:0次
名校
解题方法
2 .  可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备
可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备 以及含量测定的实验。已知:常温下
以及含量测定的实验。已知:常温下 不溶于水,较稳定,与酸反应生成
不溶于水,较稳定,与酸反应生成 ;加热时会分解生成
;加热时会分解生成 和
和 。
。
请回答下列问题:
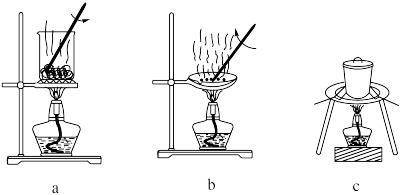
(1)灼烧。灼烧 制
制 时,可使用的实验装置有
时,可使用的实验装置有___________ (填字母)。
(2)转化。向 中先加入稳定剂和
中先加入稳定剂和 溶液,充分反应后,过滤、洗涤、干燥,可得粗品
溶液,充分反应后,过滤、洗涤、干燥,可得粗品 。
。
①写出制备 时发生反应的化学方程式:
时发生反应的化学方程式:___________ 。
②“转化”阶段有大量热量放出,为了提高 的产率,添加
的产率,添加 溶液时,比较理想的操作方法为
溶液时,比较理想的操作方法为___________ 。
(3)测定。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中 的含量。
的含量。

①实验时在稀盐酸中加入 溶液的作用是
溶液的作用是___________ (用化学方程式表示)。
②为了减小实验误差,在每次读数前需要进行的操作是___________ 、___________ 。
③该小组记录的实验数据如下:样品的质量为 ;反应开始前量气管的读数为
;反应开始前量气管的读数为 ;反应结束冷却到室温后量气管的读数为
;反应结束冷却到室温后量气管的读数为 ,已知:室温条件下气体摩尔体积为
,已知:室温条件下气体摩尔体积为 ,则样品中过氧化镁的质量分数为
,则样品中过氧化镁的质量分数为___________  (用含
(用含 的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得
的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得 的质量分数
的质量分数___________ (填“偏大”“偏小”或“无影响”)。
 可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备
可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备 以及含量测定的实验。已知:常温下
以及含量测定的实验。已知:常温下 不溶于水,较稳定,与酸反应生成
不溶于水,较稳定,与酸反应生成 ;加热时会分解生成
;加热时会分解生成 和
和 。
。请回答下列问题:
(1)灼烧。灼烧
 制
制 时,可使用的实验装置有
时,可使用的实验装置有
(2)转化。向
 中先加入稳定剂和
中先加入稳定剂和 溶液,充分反应后,过滤、洗涤、干燥,可得粗品
溶液,充分反应后,过滤、洗涤、干燥,可得粗品 。
。①写出制备
 时发生反应的化学方程式:
时发生反应的化学方程式:②“转化”阶段有大量热量放出,为了提高
 的产率,添加
的产率,添加 溶液时,比较理想的操作方法为
溶液时,比较理想的操作方法为(3)测定。某研究小组拟用下图装置测定样品(含
 杂质)中
杂质)中 的含量。
的含量。
①实验时在稀盐酸中加入
 溶液的作用是
溶液的作用是②为了减小实验误差,在每次读数前需要进行的操作是
③该小组记录的实验数据如下:样品的质量为
 ;反应开始前量气管的读数为
;反应开始前量气管的读数为 ;反应结束冷却到室温后量气管的读数为
;反应结束冷却到室温后量气管的读数为 ,已知:室温条件下气体摩尔体积为
,已知:室温条件下气体摩尔体积为 ,则样品中过氧化镁的质量分数为
,则样品中过氧化镁的质量分数为 (用含
(用含 的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得
的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得 的质量分数
的质量分数
您最近一年使用:0次
2023-10-06更新
|
799次组卷
|
5卷引用:安徽省巢湖市第一中学2024届高三10月月考化学试题
名校
解题方法
3 . 工业上制备硫酸的一步重要反应是 在400~500℃下的催化氧化反应:
在400~500℃下的催化氧化反应:
 。下列有关说法错误的是
。下列有关说法错误的是
 在400~500℃下的催化氧化反应:
在400~500℃下的催化氧化反应:
 。下列有关说法错误的是
。下列有关说法错误的是A.常通入过量的空气,以提高 的平衡转化率 的平衡转化率 |
| B.为提高反应速率和平衡转化率,采用的压强越大越好 |
| C.控制温度为400~500℃既能提升反应速率,又能使催化剂有较高的活性 |
| D.要综合考虑影响速率与平衡的各种因素、设备条件和经济成本等,寻找适宜的生产条件 |
您最近一年使用:0次
2023-08-12更新
|
410次组卷
|
8卷引用:安徽省六安市裕安区新安中学2023-2024学年高二下学期第一次月考化学试题
安徽省六安市裕安区新安中学2023-2024学年高二下学期第一次月考化学试题山东省鄄城县第一中学2023-2024学年高二上学期9月月考化学试题黑龙江省哈尔滨市第一中学校2023-2024学年高二上学期第一次质量检测化学试题天津市天津中学2023-2024学年高二上学期第一次月考化学试题四川省宜宾市叙州区第二中学校2023-2024学年高二上学期12月月考化学试题河南省周口市无锡天一企业管理有限公司等2校2022-2023学年高二上学期12月期末考试化学试题(已下线)专题05 化学反应的方向 化学反应的调控 -【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)(已下线)寒假作业04 化学反应的方向及调控-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
4 . 某镍矿石的主要成分为NiO,另含CoO、FeO、Fe2O3、Al2O3、MgO、CaO和SiO2等杂质,按以下流程可制备NiSO4•6H2O晶体和金属钴。

回答下列问题:
(1)“预处理”时需将Fe2+全部氧化为Fe3+,试剂X最好选用_______ (填序号),写出发生反应的化学方程式_______ 。
a.稀硝酸 b.双氧水 c.高锰酸钾溶液 d.新制氯水
(2)常温下,一些金属难溶氢氧化物的溶解度(用阳离子的浓度表示)与pH的关系图如图:

加入NiO调pH=5可除去_______ (填金属离子符号)。
(3)滤渣Z的成分为MgF2和CaF2。若原溶液中c(Ca2+)=1.0×10-3mol/L,沉淀后溶液中c(Mg2+)=1.5×10-6mol/L,则除钙率为_______ (忽略沉淀前后溶液体积变化)。(已知:Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11)
(4)影响P507萃取率的因素有很多,在其他条件相同时,根据如图分析分离镍、钴的最佳条件:相比(油相O:水相A)=_______ ;P507萃取金属离子的原理为nHR(Org)+Mn+(aq) MRn(Org)+nH+(aq),在一定范围内,随着pH升高,萃取率升高的原因是
MRn(Org)+nH+(aq),在一定范围内,随着pH升高,萃取率升高的原因是_______ 。

(5)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
从NiSO4溶液获得稳定的NiSO4•6H2O晶体的操作a依次是_______ 。

回答下列问题:
(1)“预处理”时需将Fe2+全部氧化为Fe3+,试剂X最好选用
a.稀硝酸 b.双氧水 c.高锰酸钾溶液 d.新制氯水
(2)常温下,一些金属难溶氢氧化物的溶解度(用阳离子的浓度表示)与pH的关系图如图:

加入NiO调pH=5可除去
(3)滤渣Z的成分为MgF2和CaF2。若原溶液中c(Ca2+)=1.0×10-3mol/L,沉淀后溶液中c(Mg2+)=1.5×10-6mol/L,则除钙率为
(4)影响P507萃取率的因素有很多,在其他条件相同时,根据如图分析分离镍、钴的最佳条件:相比(油相O:水相A)=
 MRn(Org)+nH+(aq),在一定范围内,随着pH升高,萃取率升高的原因是
MRn(Org)+nH+(aq),在一定范围内,随着pH升高,萃取率升高的原因是
(5)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
| 温度 | 低于30.8℃ | 30.8℃—53.8℃ | 53.8℃—280℃ | 高于280℃ |
| 晶体形态 | NiSO4•7H2O | NiSO4•6H2O | 多种结晶水合物 | NiSO4 |
您最近一年使用:0次
5 . 水体中过量氨氮(以NH3表示)或总氮(溶液中所有可溶性的含氮化合物中氮元素总量)含量过高会导致水体富营养化。用次氯酸钠除去氨氮的一种原理如下图所示,下列说法正确的是
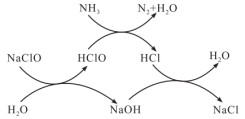

| A.NaClO除去氨氮的总反应化学方程式2NH3+3NaClO=N2+3NaCl+3H2O |
| B.整个过程中发生的反应都是氧化还原反应 |
| C.在较高温度下,氨氮去除率会升高 |
| D.NaClO投入过多,总氮去除率可能会升高 |
您最近一年使用:0次
2021-11-01更新
|
142次组卷
|
2卷引用:安徽省示范高中2021-2022学年高二上学期10月联赛化学试题
6 . 氮气在催化剂 表面,经过电催化制备
表面,经过电催化制备 的不同机理如下图所示,下列说法错误的是
的不同机理如下图所示,下列说法错误的是

 表面,经过电催化制备
表面,经过电催化制备 的不同机理如下图所示,下列说法错误的是
的不同机理如下图所示,下列说法错误的是
| A.机理一与机理二步骤中,都有加成反应 |
| B.机理一与机理二的慢反应分别是反应③和反应⑥ |
| C.消耗等物质的量氮气,机理二产生的氨气是机理一的2倍 |
| D.氨气在阴极区生成 |
您最近一年使用:0次
名校
7 . 合成氨的反应历程有多种,有一种反应历程如图所示,吸附在催化剂表面的物质用*表示。下列说法错误的是
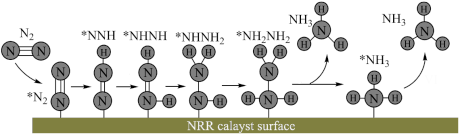

| A.催化剂的使用,并不能提高反应物的转化率 |
| B.N2生成NH3是通过多步氧化反应生成的 |
| C.两个氮原子上的加氢过程分步进行 |
| D.大量氨分子吸附在催化剂表面,将减缓反应速率 |
您最近一年使用:0次
2021-10-11更新
|
329次组卷
|
3卷引用:安徽省池州市江南中学2021-2022学年高二上学期11月月考化学试题
8 . CO2综合利用有利于实现碳中和目标,对于构建低碳社会具有重要意义。
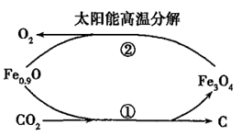
(1)在太阳能的作用下,缺铁氧化物[如Fe0.9O]能分解CO2,其过程如图所示。过程①的化学方程式是___________ 。在过程②中每产生1molO2,转移电子___________ mol。
(2)CO2与H2一起直接制备甲醇,其中的主要过程包括以下反应:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=—49.0kJ·mol−1
CH3OH(g)+H2O(g) ΔH=—49.0kJ·mol−1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.1kJ·mol−1
CO(g)+H2O(g) ΔH=+41.1kJ·mol−1
研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按n(CO2):n(H2)=1:3(总量为amol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)
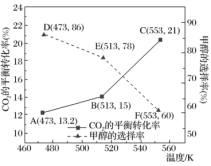
①根据图中数据,温度选择___________ K,达到平衡时,反应体系内甲醇的产量最高。
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因___________ 。
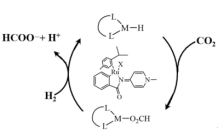
(3)利用CO2在新型钌配合物催化剂下加氢合成甲酸,反应机理如图所示,图中含Ru配合物的某段结构用M表示。中间体为___________ ,研究表明,极性溶剂有助于促进CO2插入M-H键,使用极性溶剂后极大地提高了整个反应的合成效率,原因是___________
(1)在太阳能的作用下,缺铁氧化物[如Fe0.9O]能分解CO2,其过程如图所示。过程①的化学方程式是

(2)CO2与H2一起直接制备甲醇,其中的主要过程包括以下反应:
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=—49.0kJ·mol−1
CH3OH(g)+H2O(g) ΔH=—49.0kJ·mol−1②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.1kJ·mol−1
CO(g)+H2O(g) ΔH=+41.1kJ·mol−1研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按n(CO2):n(H2)=1:3(总量为amol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)

①根据图中数据,温度选择
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因
(3)利用CO2在新型钌配合物催化剂下加氢合成甲酸,反应机理如图所示,图中含Ru配合物的某段结构用M表示。中间体为

您最近一年使用:0次
2021-10-10更新
|
349次组卷
|
2卷引用:安徽省池州市江南中学2021-2022学年高二上学期11月月考化学试题
名校
9 . 高铁酸钾( )是一种多功能的新型水处理剂。一种湿法制备高铁酸钾的新工艺流程如图:
)是一种多功能的新型水处理剂。一种湿法制备高铁酸钾的新工艺流程如图:

已知高铁酸盐热稳定性差,在碱性环境中比酸性环境中相对稳定。回答以下问题:
(1)高铁酸钾( )中铁元素的化合价为
)中铁元素的化合价为___________
(2)滤渣1的主要成分为(写化学式)___________
(3)写出氧化过程的离子方程式。___________
(4)氧化时控温20-25℃,温度不能高于25℃原因是___________
(5)实验测得氧化时间、氧化剂浓度与 产率、纯度的实验数据分别如下图1、2图所示。为了获取更纯的高铁酸钾,反应时间应控制在
产率、纯度的实验数据分别如下图1、2图所示。为了获取更纯的高铁酸钾,反应时间应控制在___________ min,氧化剂浓度应控制在___________ mol/L。

(6)高铁酸钾产品纯度测定方法如下(杂质不参与反应)在一定条件下,将1.32g样品与过量KI溶液反应后配成100mL溶液,每次取10.00mL用0.1000mol/L的 标准溶液滴定,三次滴定消耗
标准溶液滴定,三次滴定消耗 标准溶液体积平均为19.20mL,则原样品中高铁酸钾的质量分数为
标准溶液体积平均为19.20mL,则原样品中高铁酸钾的质量分数为___________ 。(已知: )
)
 )是一种多功能的新型水处理剂。一种湿法制备高铁酸钾的新工艺流程如图:
)是一种多功能的新型水处理剂。一种湿法制备高铁酸钾的新工艺流程如图:
已知高铁酸盐热稳定性差,在碱性环境中比酸性环境中相对稳定。回答以下问题:
(1)高铁酸钾(
 )中铁元素的化合价为
)中铁元素的化合价为(2)滤渣1的主要成分为(写化学式)
(3)写出氧化过程的离子方程式。
(4)氧化时控温20-25℃,温度不能高于25℃原因是
(5)实验测得氧化时间、氧化剂浓度与
 产率、纯度的实验数据分别如下图1、2图所示。为了获取更纯的高铁酸钾,反应时间应控制在
产率、纯度的实验数据分别如下图1、2图所示。为了获取更纯的高铁酸钾,反应时间应控制在
(6)高铁酸钾产品纯度测定方法如下(杂质不参与反应)在一定条件下,将1.32g样品与过量KI溶液反应后配成100mL溶液,每次取10.00mL用0.1000mol/L的
 标准溶液滴定,三次滴定消耗
标准溶液滴定,三次滴定消耗 标准溶液体积平均为19.20mL,则原样品中高铁酸钾的质量分数为
标准溶液体积平均为19.20mL,则原样品中高铁酸钾的质量分数为 )
)
您最近一年使用:0次
2021-10-10更新
|
359次组卷
|
5卷引用:安徽省池州市江南中学2021-2022学年高二上学期11月月考化学试题
名校
10 . 二氧化氯(ClO2)是一种重要的氧化剂,可用于某些污染物的处理。
(1)ClO2可由图1所示装置制备(电极不反应)。

①电解时阳极附近溶液的pH___ (填“减小”“增大”或“不变”)。
②阴极上产生ClO2的机理如图2所示(A、B均为含氯微粒,其他微粒未标出)。该机理可描述为___ 。
(2)ClO2可用于水体中Mn2+的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得Mn2+浓度随反应时间的变化如图3所示。

①pH=8.3时水体中Mn2+转化为MnO2,ClO2转化为ClO ,该反应的离子方程式为
,该反应的离子方程式为__ 。
②反应相同时间,水体中Mn2+浓度随pH增大而降低的原因是___ 。
(3)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=__ kcal·mol-1。

②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是____ ;添加NO时,SO2氧化率比不添加NO时高,其原因可能是___ 。
(1)ClO2可由图1所示装置制备(电极不反应)。

①电解时阳极附近溶液的pH
②阴极上产生ClO2的机理如图2所示(A、B均为含氯微粒,其他微粒未标出)。该机理可描述为
(2)ClO2可用于水体中Mn2+的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得Mn2+浓度随反应时间的变化如图3所示。

①pH=8.3时水体中Mn2+转化为MnO2,ClO2转化为ClO
 ,该反应的离子方程式为
,该反应的离子方程式为②反应相同时间,水体中Mn2+浓度随pH增大而降低的原因是
(3)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=

②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中
 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
您最近一年使用:0次
2021-09-22更新
|
645次组卷
|
6卷引用:安徽省安庆市第一中学2021-2022学年高三上学期10月月考化学试题
安徽省安庆市第一中学2021-2022学年高三上学期10月月考化学试题江苏省南京市2022届高三上学期9月学情调研化学试题江苏省扬州市扬州中学2022届高三开学考试化学试题2021年辽宁高考化学试题变式题11-19(已下线)黄金卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)押江苏卷第18题 化学反应原理综合题 -备战2022年高考化学临考题号押题(江苏卷)



