1 . 某工厂利用黄铁矿(主要成分为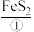 )制取硫酸的工艺流程如下:
)制取硫酸的工艺流程如下:
第一步:将黄铁矿粉碎后在沸腾炉中高温处理造气,可获得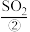 和炉渣(主要成分为
和炉渣(主要成分为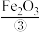 )。
)。
第二步:将获得的气体净化后与空气按一定比例通入催化反应室中,在催化剂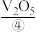 的作用下转化为
的作用下转化为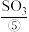 。
。
第三步:用吸收塔吸收后,再加适量水稀释至质量分数为98%的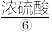 (密度约为1.84g·cm-3)。
(密度约为1.84g·cm-3)。
工业生产中产生的尾气用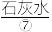 吸收,使其转化为
吸收,使其转化为 后,再用
后,再用 处理,生成SO2和
处理,生成SO2和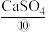 ,这样得到的SO2含量较高,可循环用作原料。
,这样得到的SO2含量较高,可循环用作原料。
根据上述短文,回答下列问题:
(1)上述10种物质中属于氧化物的是___________ (填序号,下同)。
(2)常温下,⑦⑧⑨⑩四种物质中能导电的是___________ 。
(3)写出③与⑨反应的离子方程式:___________ 。
(4)第三步中对应⑥的物质的量浓度为___________ mol·L-1。
(5)标准状况下,1.12L②完全转化为⑤时,反应中转移的电子的物质的量为___________ mol。
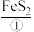 )制取硫酸的工艺流程如下:
)制取硫酸的工艺流程如下:第一步:将黄铁矿粉碎后在沸腾炉中高温处理造气,可获得
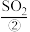 和炉渣(主要成分为
和炉渣(主要成分为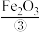 )。
)。第二步:将获得的气体净化后与空气按一定比例通入催化反应室中,在催化剂
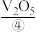 的作用下转化为
的作用下转化为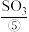 。
。第三步:用吸收塔吸收后,再加适量水稀释至质量分数为98%的
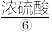 (密度约为1.84g·cm-3)。
(密度约为1.84g·cm-3)。工业生产中产生的尾气用
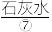 吸收,使其转化为
吸收,使其转化为 后,再用
后,再用 处理,生成SO2和
处理,生成SO2和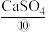 ,这样得到的SO2含量较高,可循环用作原料。
,这样得到的SO2含量较高,可循环用作原料。根据上述短文,回答下列问题:
(1)上述10种物质中属于氧化物的是
(2)常温下,⑦⑧⑨⑩四种物质中能导电的是
(3)写出③与⑨反应的离子方程式:
(4)第三步中对应⑥的物质的量浓度为
(5)标准状况下,1.12L②完全转化为⑤时,反应中转移的电子的物质的量为
您最近一年使用:0次
名校
解题方法
2 . 干燥剂的干燥性能可用干燥效率(1m3 空气中实际余留水蒸气的质量)来衡量,某些干燥剂的干燥效率数据如表所示,根据表中数据做出的推测不合理的是( )
| 物质 | CaCl2 | CaBr2 | CaO | CaSO4 | MgO | Al2O3 | ZnCl2 | ZnBr2 | CuSO4 |
| 干燥效率 | 0.14 | 0.14 | 0.2 | 0.04 | 0.008 | 0.003 | 0.8 | 1.1 | 1.4 |
| A.干燥剂中非金属元素对干燥效率无影响 |
| B.MgO 的干燥性能比 CaO 好 |
| C.MgSO4 的干燥效率可能小于 0.04 |
| D.干燥剂中金属元素对于干燥效率影响可能比较大 |
您最近一年使用:0次
2020-10-25更新
|
138次组卷
|
4卷引用:安徽省舒城中学2020-2021学年高一上学期开学考试化学试题
名校
解题方法
3 . 德国化学家哈伯(F.Haber)从1902年开始研究由氮气和氢气直接合成氨。合成氨为解决世界的粮食问题作出了重要贡献。其原理为N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ/mol
(1)若已知H-H键的键能为436.0kJ/mol,N-H的键能为390.8kJ/mol,则N N的键能约为
N的键能约为_____ kJ/mol
(2)合成氨反应不加催化剂很难发生,催化剂铁触媒加入后参与了反应降低了活化能。其能量原理如图所示,则加了催化剂后整个反应的速率由______ 决定(填“第一步反应”或者“第二步反应”),未使用催化剂时逆反应活化能______ 正反应活化能(填“大于”“小于”或者“等于”)

(3)从平衡和速率角度考虑,工业生产采取20MPa到50MPa的高压合成氨原因______
(4)一定温度下恒容容器中,以不同的H2和N2物质的量之比加入,平衡时NH3体积分数如图所示,则H2转化率a点______ b点(填"大于”“小于”或者“等于”)。若起始压强为20MPa,则b点时体系的总压强约为______ MPa。

(5)若该反应的正逆反应速率分别表示为v正=K正 ,v逆=K逆∙c2(NH3),则一定温度下,该反应 的平衡常数K=
,v逆=K逆∙c2(NH3),则一定温度下,该反应 的平衡常数K=______ (用含K正和K逆的表达式表示),若K正和K逆都是温度的函数,且随温度升高而升高,则图中c和d分别表示______ 和______ 随温度变化趋势(填K正或者K逆)。

(6)常温下,向20mL的0.1mol/L的盐酸中通入一定量氨气反应后溶液呈中性(假设溶液体积变化忽略不计)则所得溶液中c(NH4+)=_______
(1)若已知H-H键的键能为436.0kJ/mol,N-H的键能为390.8kJ/mol,则N
 N的键能约为
N的键能约为(2)合成氨反应不加催化剂很难发生,催化剂铁触媒加入后参与了反应降低了活化能。其能量原理如图所示,则加了催化剂后整个反应的速率由

(3)从平衡和速率角度考虑,工业生产采取20MPa到50MPa的高压合成氨原因
(4)一定温度下恒容容器中,以不同的H2和N2物质的量之比加入,平衡时NH3体积分数如图所示,则H2转化率a点

(5)若该反应的正逆反应速率分别表示为v正=K正
 ,v逆=K逆∙c2(NH3),则一定温度下,该反应 的平衡常数K=
,v逆=K逆∙c2(NH3),则一定温度下,该反应 的平衡常数K=
(6)常温下,向20mL的0.1mol/L的盐酸中通入一定量氨气反应后溶液呈中性(假设溶液体积变化忽略不计)则所得溶液中c(NH4+)=
您最近一年使用:0次
2020-05-09更新
|
429次组卷
|
3卷引用:安徽省A10联盟2020届高三下学期开年考理综化学试题
4 . 水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________ H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________ (填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。
标注。
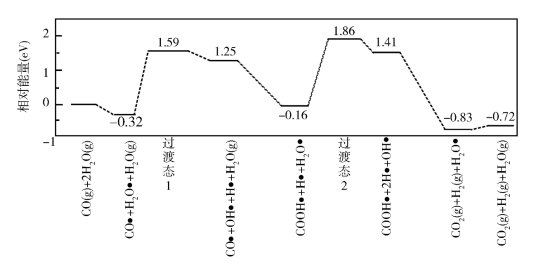
可知水煤气变换的ΔH________ 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________ eV,写出该步骤的化学方程式_______________________ 。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。
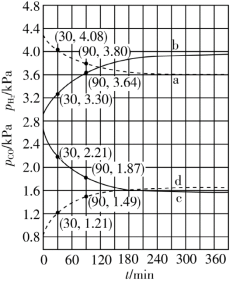
计算曲线a的反应在30~90 min内的平均速率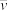 (a)=
(a)=___________ kPa·min−1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________ 、___________ 。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________ 、___________ 。
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用
 标注。
标注。
可知水煤气变换的ΔH
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。

计算曲线a的反应在30~90 min内的平均速率
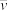 (a)=
(a)=
您最近一年使用:0次
2019-06-09更新
|
19203次组卷
|
20卷引用:安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题
安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题2019年全国统一考试化学试题(新课标Ⅰ)(已下线)专题09 反应速率、化学平衡——2019年高考真题和模拟题化学分项汇编(已下线)专题7.1 化学反应速率(讲)-《2020年高考一轮复习讲练测》(已下线)专题7.1 化学反应速率(练)-《2020年高考一轮复习讲练测》福建省泉州市泉港区第一中学2019-2020学年高二上学期第二次月考化学试题湖南省株洲市茶陵二中2020届高三上学期第二次月考化学试题专题2.2 化学反应速率和化学平衡(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题6.3 化学原理题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2章 综合检测高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二章素养检测人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 过高考 3年真题强化闯关鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记江苏省盱眙中学2021-2022学年高二上学期第三次学情调研化学试题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)专题15化学反应原理综合-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题17 原理综合题(已下线)T28-原理综合题2018-2019学年度耀华实验学校第二学期高二实验化学期末试卷
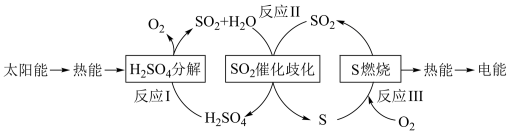
5 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:_________________________________________ 。
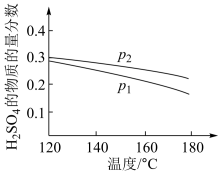
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
p2_______ p 1(填“>”或“<”),得出该结论的理由是________________ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+===S↓+2I2+2H2O
ii.I2+2H2O+_________ ===_________ +_______ +2I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=__________ 。
②比较A、B、C,可得出的结论是______________________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________ 。
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
p2
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+===S↓+2I2+2H2O
ii.I2+2H2O+
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
A | B | C | D | |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
您最近一年使用:0次
2018-06-09更新
|
6532次组卷
|
28卷引用:【校级联考】安徽省江南片2019届高三上学期入学摸底考试化学试题
【校级联考】安徽省江南片2019届高三上学期入学摸底考试化学试题云南省富宁县民族中学2020届高三上学期开学考试化学试题安徽省黄山市屯溪第一中学2021-2022学年高二上学期期中考试化学试题2018年全国普通高等学校招生统一考试化学(北京卷)(已下线)2018年高考题及模拟题汇编 专题14 化学反应原理综合陕西安康市紫阳县紫阳中学2019届高三上学期入学调研考试化学试题福建省泉州第五中学2019届高三入学调研考试化学试题【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期10月月考化学试题江西省丰城中学2018-2019学年高一上学期课改期末考试化学试题福建省福州市第三中学2019-2020学年高三10月月考化学试题(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》(已下线)考点12 化学反应速率化学平衡——《备战2020年高考精选考点专项突破题集》2020届人教版高三专题基础复习专题7《化学反应速率与化学平衡》测试卷四川省成都市实验中学2019-2020学年高三下学期第三次周测化学试题(已下线)专题6.3 化学原理题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第3节 化学反应的速率北京东城区2019-2020学年高二下学期期中考试化学试题(已下线)北京市第四中学2021-2022学年高三上学期期中考试化学试题北京市陈经纶中学2022-2023学年高二10月月考化学试题北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题(已下线)化学(上海C卷)-学易金卷:2023年高考第一次模拟考试卷北京市第八中学2022-2023学年高二上学期期末考试化学试题广西壮族自治区钦州市第四中学2022-2023学年高一下学期3月月考化学试卷北京市第一○一中学2023-2024学年高二上学期统练一化学试题浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷北京市广渠门中学2023-2024学年高二上学期期中考试化学试题 北京市铁路第二中学2023-2024学年高二上学期期中考试化学试题10-2023新东方高二上期中考化学
名校
解题方法
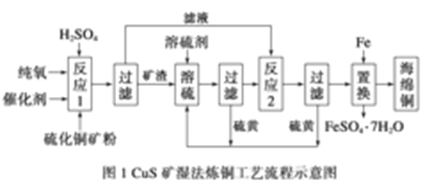
6 . 近年来,硫化铜矿的湿法冶炼技术已经取得了很大的发展。现有一种催化氧化酸浸硫化铜矿的冶炼法,其工艺流程如图所示:
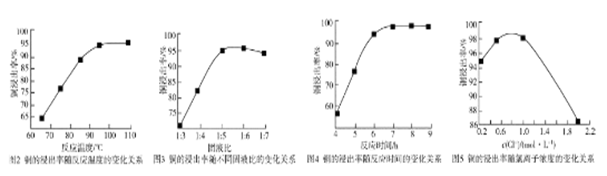
反应温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图2~如图5所示)。
回答下列问题:
(1)火法炼铜的主要反应:①2CuFeS2+4O2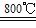 Cu2S+3SO2+2FeO(炉渣); ②2Cu2S+3O2
Cu2S+3SO2+2FeO(炉渣); ②2Cu2S+3O2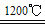 2Cu2O+2SO2;③2Cu2O+Cu2S
2Cu2O+2SO2;③2Cu2O+Cu2S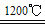 6Cu+SO2↑;则在反应①、②、③中被氧化的元素为
6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______ (填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________ NA;由amolCuFeS2生成a molCu,共消耗________ mol O2。
(2)写出反应1的化学方程式:________________ 。经查,硫黄、FeSO4·7H2O均可入药,用途广泛,湿法炼铜与火法炼铜相比,优点是_____________________ 。
(3)从溶液中得到FeSO4·7H2O晶体的操作是_______________________________ 。
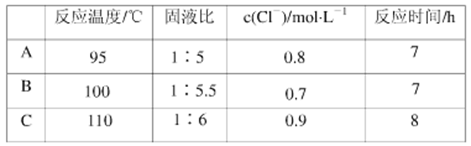
(4)根据实验以及工业生产的实验要求,从下表中得出的最佳工艺条件为________ (填字母代号)。

反应温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图2~如图5所示)。

回答下列问题:
(1)火法炼铜的主要反应:①2CuFeS2+4O2
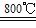 Cu2S+3SO2+2FeO(炉渣); ②2Cu2S+3O2
Cu2S+3SO2+2FeO(炉渣); ②2Cu2S+3O2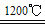 2Cu2O+2SO2;③2Cu2O+Cu2S
2Cu2O+2SO2;③2Cu2O+Cu2S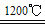 6Cu+SO2↑;则在反应①、②、③中被氧化的元素为
6Cu+SO2↑;则在反应①、②、③中被氧化的元素为(2)写出反应1的化学方程式:
(3)从溶液中得到FeSO4·7H2O晶体的操作是
(4)根据实验以及工业生产的实验要求,从下表中得出的最佳工艺条件为

您最近一年使用:0次
2017-03-16更新
|
255次组卷
|
3卷引用:安徽省定远县第三中学2018-2019学年高一下学期开学检测化学试题
安徽省定远县第三中学2018-2019学年高一下学期开学检测化学试题2017届湖南省长郡中学、衡阳八中等十三校重点中学高三第一次联考化学试卷(已下线)第5单元 常见的金属元素(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷



