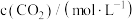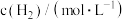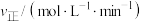1 . 碳达峰、碳中和是现在需要继续完成的环保任务, 的综合利用成为热点研究对象,
的综合利用成为热点研究对象, 作为碳源加氢是再生能源的有效方法,
作为碳源加氢是再生能源的有效方法, 加氢可以合成甲醇,
加氢可以合成甲醇, 提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过
提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过 加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:
加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:
反应I: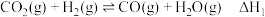
反应Ⅱ:
(1)①相关键能如下表,则
_______ ,该反应的活化能 (正)
(正)_______  (逆)(填“大于”“小于”或“等于”)。
(逆)(填“大于”“小于”或“等于”)。
②已知 的正反应速率
的正反应速率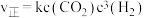 (k为正反应的速率常数),某温度时测得数据如下:
(k为正反应的速率常数),某温度时测得数据如下:
则此温度下,表中
______ 。
(2)据文献报道, 基纳米材料作为高性能催化剂可将
基纳米材料作为高性能催化剂可将 电还原为高能量密度的
电还原为高能量密度的 ,不同催化剂对生成
,不同催化剂对生成 的法拉第效率与电极电势的变化如图所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是
的法拉第效率与电极电势的变化如图所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是_______ 。 的转化率随温度和压强的变化如图,判断
的转化率随温度和压强的变化如图,判断 的大小关系:
的大小关系:__________ ;解释压强一定时, 的平衡转化率呈现如图变化的原因:
的平衡转化率呈现如图变化的原因:_________________ 。 ,向容积为
,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入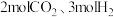 发生反应I、Ⅱ,平衡时
发生反应I、Ⅱ,平衡时 的转化率是
的转化率是 ,体系内剩余
,体系内剩余 ,则反应Ⅱ的平衡常数
,则反应Ⅱ的平衡常数
_______  ,体系内甲醇的平衡分压
,体系内甲醇的平衡分压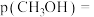
_____  (用含
(用含 的式子表示)。
的式子表示)。
 的综合利用成为热点研究对象,
的综合利用成为热点研究对象, 作为碳源加氢是再生能源的有效方法,
作为碳源加氢是再生能源的有效方法, 加氢可以合成甲醇,
加氢可以合成甲醇,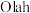 提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过
提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过 加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:
加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:反应I:
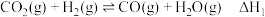
反应Ⅱ:

(1)①相关键能如下表,则

 (正)
(正) (逆)(填“大于”“小于”或“等于”)。
(逆)(填“大于”“小于”或“等于”)。化学键 |
|
|
|
|
键能 | 436 | 1071 | 464 | 803 |
 的正反应速率
的正反应速率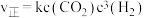 (k为正反应的速率常数),某温度时测得数据如下:
(k为正反应的速率常数),某温度时测得数据如下:
|
|
| |
1 | 0.02 | 0.01 |
|
2 | 0.02 | 0.02 | a |

(2)据文献报道,
 基纳米材料作为高性能催化剂可将
基纳米材料作为高性能催化剂可将 电还原为高能量密度的
电还原为高能量密度的 ,不同催化剂对生成
,不同催化剂对生成 的法拉第效率与电极电势的变化如图所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是
的法拉第效率与电极电势的变化如图所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是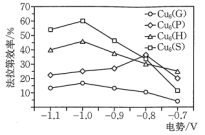
 的转化率随温度和压强的变化如图,判断
的转化率随温度和压强的变化如图,判断 的大小关系:
的大小关系: 的平衡转化率呈现如图变化的原因:
的平衡转化率呈现如图变化的原因:
 ,向容积为
,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入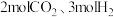 发生反应I、Ⅱ,平衡时
发生反应I、Ⅱ,平衡时 的转化率是
的转化率是 ,体系内剩余
,体系内剩余 ,则反应Ⅱ的平衡常数
,则反应Ⅱ的平衡常数
 ,体系内甲醇的平衡分压
,体系内甲醇的平衡分压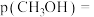
 (用含
(用含 的式子表示)。
的式子表示)。
您最近一年使用:0次
名校
2 . 工业制硫酸的关键反应为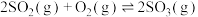
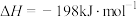 ,在
,在 存在时,该反应的机理为:ⅰ.
存在时,该反应的机理为:ⅰ.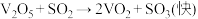 ⅱ.
ⅱ. 。
。
下列说法正确的是
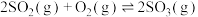
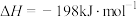 ,在
,在 存在时,该反应的机理为:ⅰ.
存在时,该反应的机理为:ⅰ.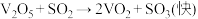 ⅱ.
ⅱ. 。
。下列说法正确的是
| A.反应ⅱ是决速步骤 |
B. 是该反应的催化剂 是该反应的催化剂 |
| C.逆反应的活化能小于198kJ/mol |
| D.工业生产选择400~500℃作为反应条件是符合勒夏特列原理的 |
您最近一年使用:0次
名校
3 . 下列事实中,不能用勒夏特列原理解释的是
A. 溶液中加入 溶液中加入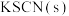 后颜色变深 后颜色变深 |
| B.用排饱和食盐水的方法收集氯气 |
C.棕红色 加压后颜色先变深后变浅 加压后颜色先变深后变浅 |
| D.500℃时比室温更有利于合成氨 |
您最近一年使用:0次
2023-11-23更新
|
133次组卷
|
2卷引用:陕西省 韩城市象山中学2023-2024学年高二上学期第三次月考化学试题
解题方法
4 .  (简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、
(简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、 、LiCl和
、LiCl和 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
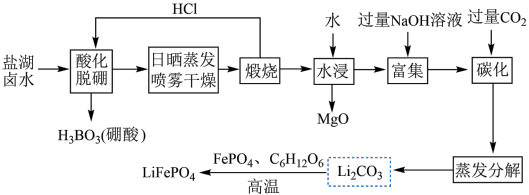
注:日晒蒸发、喷雾干燥后固体含NaCl、LiCl、 等。
等。
(1) 中Li在元素周期表中的位置为第
中Li在元素周期表中的位置为第___________ 周期___________ 族。
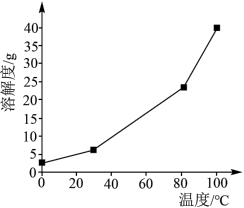
(2)硼酸在水中的溶解度随温度的变化关系如图所示。
已知: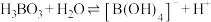
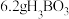 最多与
最多与___________  溶液完全反应。“酸化脱硼”中采用
溶液完全反应。“酸化脱硼”中采用___________ (填“加热”或“冷却”),采用该操作的目的是___________ 。
(3)“煅烧”过程中,常需要搅拌,搅拌的目的是___________ 。
(4)“蒸发分解”的化学方程式为___________ 。
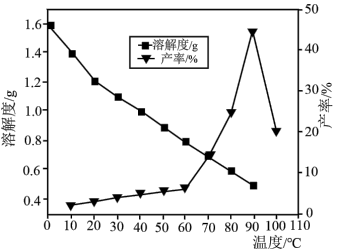
(5)已知不同温度下蒸发分解得到 的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是
的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是___________ ,制得 后需要洗涤,具体操作为
后需要洗涤,具体操作为___________ 。
(6)用 、
、 、
、 制备
制备 时,有
时,有 产生,则参与反应的
产生,则参与反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
 (简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、
(简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、 、LiCl和
、LiCl和 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
注:日晒蒸发、喷雾干燥后固体含NaCl、LiCl、
 等。
等。(1)
 中Li在元素周期表中的位置为第
中Li在元素周期表中的位置为第(2)硼酸在水中的溶解度随温度的变化关系如图所示。

已知:
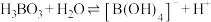
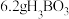 最多与
最多与 溶液完全反应。“酸化脱硼”中采用
溶液完全反应。“酸化脱硼”中采用(3)“煅烧”过程中,常需要搅拌,搅拌的目的是
(4)“蒸发分解”的化学方程式为
(5)已知不同温度下蒸发分解得到
 的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是
的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是 后需要洗涤,具体操作为
后需要洗涤,具体操作为
(6)用
 、
、 、
、 制备
制备 时,有
时,有 产生,则参与反应的
产生,则参与反应的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
5 . 如下图所示为工业合成氨的流程图。下列说法不正确的是
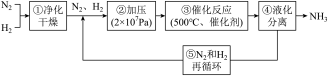

| A.步骤①中“净化”可以防止催化剂中毒 |
| B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 |
| C.步骤③、④、⑤均有利于提高原料平衡的转化率 |
| D.为提高反应物的转化率应及时将氨从混合气中分离出去 |
您最近一年使用:0次
2023-10-26更新
|
331次组卷
|
7卷引用:陕西省西安中学2023-2024学年高二上学期第一次综合评价化学试题
名校
解题方法
6 . 硫酸在国民经济中占有极其重要的地位,工业上常以黄铁矿为原料用接触法制硫酸。
(1)接触室中发生的反应:
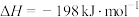 。
。
①若测得2h后 的浓度为0.6
的浓度为0.6 ,此时间内
,此时间内 的消耗速率为0.2
的消耗速率为0.2 ,则开始时
,则开始时 的浓度为
的浓度为_________  。
。
②将0.050mol (g)和0.030mol
(g)和0.030mol  (g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测
(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测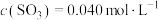 。计算该条件下反应的平衡常数K=
。计算该条件下反应的平衡常数K=_________ , 的平衡转化率为
的平衡转化率为_________ 。
③ 可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为
可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为_________ 。
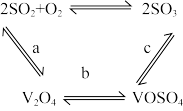
(2)硫酸的生产中,下列说法不正确的是_________(填字母)。
(3)为减少 的排放,工业上将
的排放,工业上将 转化为
转化为 固定,但存在C0会同时发生以下两个反应:
固定,但存在C0会同时发生以下两个反应:
恒容、恒温( )条件下,反应体系中
)条件下,反应体系中 随时间t变化的总趋势如图。结合已知信息分析
随时间t变化的总趋势如图。结合已知信息分析 随时间t变化的原因:
随时间t变化的原因:_________ 。
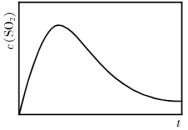
(1)接触室中发生的反应:

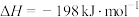 。
。①若测得2h后
 的浓度为0.6
的浓度为0.6 ,此时间内
,此时间内 的消耗速率为0.2
的消耗速率为0.2 ,则开始时
,则开始时 的浓度为
的浓度为 。
。②将0.050mol
 (g)和0.030mol
(g)和0.030mol  (g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测
(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测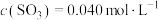 。计算该条件下反应的平衡常数K=
。计算该条件下反应的平衡常数K= 的平衡转化率为
的平衡转化率为③
 可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为
可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为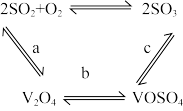
(2)硫酸的生产中,下列说法不正确的是_________(填字母)。
| A.把黄铁矿磨成细粉末在“沸腾”状态下燃烧,可以提高反应速率和原料的利用率 |
| B.气体在进接触室前要先净化,可防止催化剂中毒 |
| C.接触室中反应温度采用400~500℃,主要是为了提高原料的平衡转化率 |
D.吸收塔中操作采取逆流的形式, 从下而上,水从上而下 从下而上,水从上而下 |
 的排放,工业上将
的排放,工业上将 转化为
转化为 固定,但存在C0会同时发生以下两个反应:
固定,但存在C0会同时发生以下两个反应:| 反应 | 活化能 | 平衡常数 | |
| Ⅰ |  | 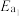 | 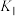 |
| Ⅱ |  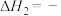 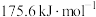 | 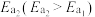 | 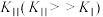 |
恒容、恒温(
 )条件下,反应体系中
)条件下,反应体系中 随时间t变化的总趋势如图。结合已知信息分析
随时间t变化的总趋势如图。结合已知信息分析 随时间t变化的原因:
随时间t变化的原因:
您最近一年使用:0次
2022-12-05更新
|
36次组卷
|
2卷引用:陕西省咸阳市实验中学2021-2022学年高二上学期第二次月考化学试题
7 . 下列事实能用勒夏特列原理来解释的是
| A.盛有2 mL 5%H2O2溶液的试管中滴入1 mL 0.1 mol·L-1 FeCl3溶液,试管中迅速产生大量气泡 |
B.工业上合成氨反应N2(g)+ 3H2 (g)  2NH3(g) ΔH<0 选择加热到500 ℃ 2NH3(g) ΔH<0 选择加热到500 ℃ |
C.H2、I2、HI平衡混合气体加压后颜色加深H2(g)+ I2(g)  2HI(g) 2HI(g) |
| D.实验室可以采用排饱和食盐水收集氯气 |
您最近一年使用:0次
2022-12-03更新
|
96次组卷
|
2卷引用:陕西省兴平市南郊高级中学2023-2024学年高二上学期第一次质量检测化学试题
2022高二·上海·专题练习
名校
8 . 下列事实符合化学平衡移动原理的是
①Cl2在饱和食盐水中的溶解度比纯水中小
②降温有利于N2和H2反应生成NH3
③可以用浓氨水和浓氢氧化钠溶液或固体来制取氨气
④加催化剂有利于合成氨的反应
⑤工业上生产硫酸的过程中,使用过量的空气以提高二氧化硫的利用率
⑥500℃左右的温度比室温更有利于合成氨的反应
①Cl2在饱和食盐水中的溶解度比纯水中小
②降温有利于N2和H2反应生成NH3
③可以用浓氨水和浓氢氧化钠溶液或固体来制取氨气
④加催化剂有利于合成氨的反应
⑤工业上生产硫酸的过程中,使用过量的空气以提高二氧化硫的利用率
⑥500℃左右的温度比室温更有利于合成氨的反应
| A.①②③④⑤⑥ | B.①②③⑤ | C.①②③⑤⑥ | D.①②③④⑥ |
您最近一年使用:0次
9 . 随着人们对硒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)为原料提取硒,设计的流程如图:
(1)“脱硫”时,测得脱硫率随温度的变化如图,最佳温度是____ 。____ ,该反应的离子方程式为____ 。
(3)采用催化剂联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。如表是“氧化酸浸”液中主要粒子的电位。
①控制电位在0.740-1.511V范围内,在氧化酸浸液中添加催化剂,可选择性还原ClO2,该过程的还原反应(半反应)式为____ 。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在____ V以上。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)])→Na2S净化→H2SO4酸化等。
①净化后的溶液中c(Na2S)达到0.026mol·L-1,此时溶液中的c(Cu2+)的最大值为____ mol·L-1,精硒中基本不含铜。([Ksp(CuS)=1.3×10-36])
②硒代硫酸钠酸化生成硒的离子方程式为_____ 。
(5)H2SeO4在水溶液中的电离方程式如下:H2SeO4=H++HSeO ,HSeO
,HSeO
 H++SeO
H++SeO 。已知0.01mol·L-1H2SeO4溶液的pH为x,则K(HSeO
。已知0.01mol·L-1H2SeO4溶液的pH为x,则K(HSeO )=
)=____ (写出含x的表达式)。

(1)“脱硫”时,测得脱硫率随温度的变化如图,最佳温度是

(3)采用催化剂联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。如表是“氧化酸浸”液中主要粒子的电位。
| 名称 | Cu2+/Cu | Zn2+/Zn | Fe2+/Fe | Fe3+/Fe2+ | ClO2/Cl- | H2SeO3/Se |
| 电位/V | 0.345 | -0.760 | -0.440 | 0.770 | 1.511 | 0.740 |
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)])→Na2S净化→H2SO4酸化等。
①净化后的溶液中c(Na2S)达到0.026mol·L-1,此时溶液中的c(Cu2+)的最大值为
②硒代硫酸钠酸化生成硒的离子方程式为
(5)H2SeO4在水溶液中的电离方程式如下:H2SeO4=H++HSeO
 ,HSeO
,HSeO
 H++SeO
H++SeO 。已知0.01mol·L-1H2SeO4溶液的pH为x,则K(HSeO
。已知0.01mol·L-1H2SeO4溶液的pH为x,则K(HSeO )=
)=
您最近一年使用:0次
2022-03-07更新
|
1032次组卷
|
7卷引用:陕西省西安市西工大附中2021-2022学年高三上学期第四次适应性训练理综化学试题
陕西省西安市西工大附中2021-2022学年高三上学期第四次适应性训练理综化学试题 陕西省渭南市2022届高考第一次模拟考试化学试题陕西省渭南市2021-2022学年高三下学期第一次模拟考试化学试题江西省重点中学盟校 2021-2022学年下学期高三第一次联考理综化学试题(已下线)二轮拔高卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)(已下线)二轮拔高卷6-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(工业流程题)
名校
10 . 实验小组进行化学反应速率的影响因素探究:
I.下表是甲同学用稀硫酸与某金属反应的实验数据:
分析上述数据,回答问题:本实验中探究了影响反应速率的因素除浓度外还有____ ,能证明该因素的实验序号是___ (因素与序号对应)。
II.乙同学用硫代硫酸钠(Na2S2O3)溶液与稀硫酸反应探究温度对反应速率的影响,反应的实验数据如下:
分析对比上述数据,回答下列问题:
(1)该实验中反应的离子方程式_______ 。
(2)该实验中看到的明显现象是_______ 。
(3)由此得出的结论是_______ 。
I.下表是甲同学用稀硫酸与某金属反应的实验数据:
| 实验序号 | 金属 质量/g | 金属状态 | C(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 丝 | 0.8 | 50 | 30 | 45 | 25 |
II.乙同学用硫代硫酸钠(Na2S2O3)溶液与稀硫酸反应探究温度对反应速率的影响,反应的实验数据如下:
| 试剂及用量 | 0.1mol/LNa2S2O3溶液5mL 0.1mol/LH2SO4溶液5mL | 0.1mol/LNa2S2O3溶液5mL 0.1mol/LH2SO4溶液5mL |
| 实验温度℃ | 25 | 50 |
| 出现明显现象的时间 | 长 | 短 |
| 结论 | ||
(1)该实验中反应的离子方程式
(2)该实验中看到的明显现象是
(3)由此得出的结论是
您最近一年使用:0次