解题方法
1 . 下列措施与化学反应速率无关的是
| A.炉膛内用煤粉代替煤块 | B.食物冷藏在冰箱 |
| C.工业合成氨时,及时将氨气液化分离 | D.在铁制品表面喷涂油漆 |
您最近一年使用:0次
2022-01-30更新
|
114次组卷
|
2卷引用:湖南省益阳市2021-2022学年高二上学期期末考试化学试题
2 . 化学在日常生活和生产中有着重要的应用,下列说法错误的是
| A.泡沫灭火器中的Al2(SO4)3溶液应贮存在玻璃筒内 |
| B.BaSO4在医学上用作钡餐所以Ba2+无毒对人体无害 |
| C.新能源汽车的推广与使用能减少氮氧化合物对环境的污染 |
| D.工业上通常采用铁触媒、400°C~500°C和10MPa~30MPa的条件来合成氨 |
您最近一年使用:0次
名校
3 . 为比较 和
和 对
对 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
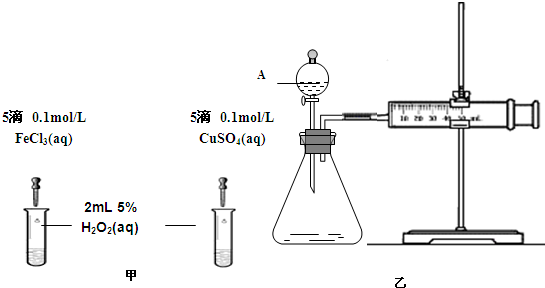
(1)定性分析:如图甲可通过观察_______ 的快慢,定性比较得出结论。有同学提出将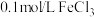 改为
改为_______  更为合理,其理由是
更为合理,其理由是_______ ;
(2)定量分析。如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是_______ ;
(3)查阅资料得知:将作为催化剂的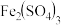 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从
均参加了反应,试从催化剂的角度 分析,这两个氧化还原反应的离子方程式分别是: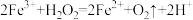 和
和_______ 。
II.欲用下图所示实验来证明 是
是 分解反应的催化剂。
分解反应的催化剂。
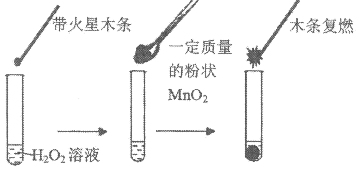
(1)该实验不能达到目的,若想证明 是催化剂还需要确认
是催化剂还需要确认_______ ;
(2)加入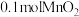 粉末于
粉末于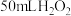 溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
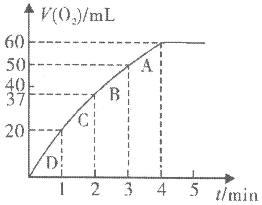
①写出 在二氧化锰作用下发生反应的化学方程式
在二氧化锰作用下发生反应的化学方程式_______ ;
②A、B、C、D各点反应速率快慢的顺序为_______ >_______ >_______ >_______ 。
 和
和 对
对 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察
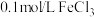 改为
改为 更为合理,其理由是
更为合理,其理由是(2)定量分析。如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是
(3)查阅资料得知:将作为催化剂的
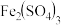 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从
均参加了反应,试从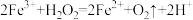 和
和II.欲用下图所示实验来证明
 是
是 分解反应的催化剂。
分解反应的催化剂。
(1)该实验不能达到目的,若想证明
 是催化剂还需要确认
是催化剂还需要确认(2)加入
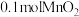 粉末于
粉末于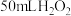 溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
①写出
 在二氧化锰作用下发生反应的化学方程式
在二氧化锰作用下发生反应的化学方程式②A、B、C、D各点反应速率快慢的顺序为
您最近一年使用:0次
名校
4 . Burns和Dainton研究发现Cl2与CO合成COCl2的反应机理如下:
①Cl2(g)⇌2Cl•(g) 快
②CO(g)+Cl•(g)⇌COCl•(g) 快
③COCl•(g)+Cl2(g)⇌COCl2(g)+Cl•(g) 慢
反应②的速率方程为v正=k正c(CO)×c(Cl•),v逆=k逆c(COCl•)。下列说法错误的是
①Cl2(g)⇌2Cl•(g) 快
②CO(g)+Cl•(g)⇌COCl•(g) 快
③COCl•(g)+Cl2(g)⇌COCl2(g)+Cl•(g) 慢
反应②的速率方程为v正=k正c(CO)×c(Cl•),v逆=k逆c(COCl•)。下列说法错误的是
| A.反应①的活化能大于反应③的活化能 |
B.反应②的平衡常数K= |
| C.要提高合成COCl2的速率,关键是提高反应③的速率 |
| D.选择合适的催化剂能提高单位时间内COCl2的产率 |
您最近一年使用:0次
2021-01-28更新
|
614次组卷
|
8卷引用:湖南省长郡中学2022-2023学年高二上学期第一次月考化学试题
5 . 工业上可采用CH3OH CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式A:CH3OH*→CH3O*+H* Ea=+103.1 kJ·mol-1
方式B:CH3OH*→CH3*+OH* Eb=+249.3 kJ·mol-1(其中Ea、Eb为活化能)。
图为计算机模拟的各步反应的能量变化示意图。

下列说法错误的是
 CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:方式A:CH3OH*→CH3O*+H* Ea=+103.1 kJ·mol-1
方式B:CH3OH*→CH3*+OH* Eb=+249.3 kJ·mol-1(其中Ea、Eb为活化能)。
图为计算机模拟的各步反应的能量变化示意图。

下列说法错误的是
| A.总反应的焓变(△H)大于0 |
| B.甲醇裂解过程主要历经的方式应为B |
| C.该历程中最小能垒(活化能)为70.7 kJ·mol-1 |
| D.该历程中,放热最多的步骤的化学方程式为CHO*+3H*=CO*+4H* |
您最近一年使用:0次
2020-10-25更新
|
347次组卷
|
2卷引用:湖南省怀化市2020-2021学年高二上学期10月联考化学试题
解题方法
6 . 2-硝基-1,3-苯二酚由间苯二酚先磺化,再硝化,后去磺酸基生成。原理如下:
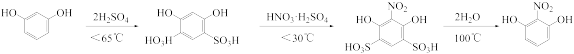
部分物质的相关性质如下:
制备过程如下:
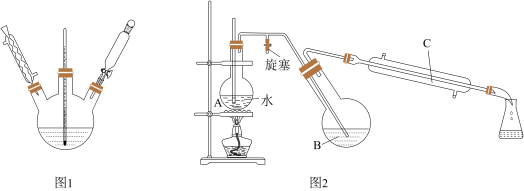
第一步:磺化。称取71.5 g间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内15 min(如图1)。
第二步:硝化。待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌15 min.。
第三步:蒸馏。将硝化反应混合物的稀释液转移到圆底烧瓶B中,然后用图2所示装置进行水蒸气蒸馏(水蒸气蒸馏可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的)。
请回答下列问题:
(1)硝化步骤中控制反应温度不超过30℃,可能的原因是__________ 。
(2)硝化步骤中制取“混酸”的具体操作是_______ 。
(3)图2中,烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止_______ ;蒸馏时冷凝管C中的水流应尽可能的调至最小,目的是_________ ;反应一段时间后,停止蒸馏,此时对旋塞和酒精灯的操作是_______ 。
(4)水蒸气蒸馏是分离和提纯有机物的方法之一,被提纯物质必须具备的条件正确的是________ 。
a.不溶或难溶于水,便于最后分离 b.在沸腾下与水不发生化学反应
C.难挥发性 d.易溶于水
(5)间苯二酚在一定条件下可转化为1,3-环已二醇,下列试剂能鉴别这两种物质的水溶液的是___________ 。
A 金属钠 B NaHCO3溶液
C FeCl3溶液 D 酸性KMnO4溶液
向间苯二酚的水溶液中滴加适量溴水,反应的化学方程式为___________ 。
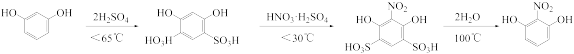
部分物质的相关性质如下:
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 水溶性(常温) |
| 间苯二酚 | 110 | 白色针状晶体 | 110. 7 | 易溶 |
| 2-硝基-1,3-苯二酚 | 155 | 桔红色针状晶体 | 87.8 | 难溶 |
制备过程如下:
第一步:磺化。称取71.5 g间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内15 min(如图1)。
第二步:硝化。待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌15 min.。
第三步:蒸馏。将硝化反应混合物的稀释液转移到圆底烧瓶B中,然后用图2所示装置进行水蒸气蒸馏(水蒸气蒸馏可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的)。

请回答下列问题:
(1)硝化步骤中控制反应温度不超过30℃,可能的原因是
(2)硝化步骤中制取“混酸”的具体操作是
(3)图2中,烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止
(4)水蒸气蒸馏是分离和提纯有机物的方法之一,被提纯物质必须具备的条件正确的是
a.不溶或难溶于水,便于最后分离 b.在沸腾下与水不发生化学反应
C.难挥发性 d.易溶于水
(5)间苯二酚在一定条件下可转化为1,3-环已二醇,下列试剂能鉴别这两种物质的水溶液的是
A 金属钠 B NaHCO3溶液
C FeCl3溶液 D 酸性KMnO4溶液
向间苯二酚的水溶液中滴加适量溴水,反应的化学方程式为
您最近一年使用:0次
7 . 如图所示为工业合成氨的流程图。有关说法不正确 的是
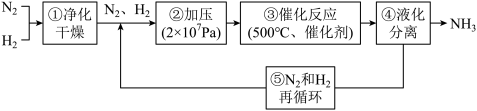

| A.步骤①中“净化”可以防止催化剂中毒 |
| B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 |
| C.产品液氨除可生产化肥外,还可用作制冷剂 |
| D.步骤③、④、⑤均有利于提高原料平衡的转化率 |
您最近一年使用:0次
8 . 当今环境问题越来越受到人们的重视。汽车尾气中含有较多的NO和CO,两种气体均会使人体中毒。处理大气中的污染物,打响“蓝天白云”保卫战是当前的重要课题。请回答下列问题
(1)用还原法将NO转化为无污染的物质。已知:
2C(s)+O2(g) 2CO △H1=-221.0KJ/mol
2CO △H1=-221.0KJ/mol
N2(g)+O2(g) 2NO △H2=+180.5KJ/mol
2NO △H2=+180.5KJ/mol
2NO+C(s) CO2(g)+N2(g) △H3=-573.75KJ/mol
CO2(g)+N2(g) △H3=-573.75KJ/mol
请写出CO与NO生成无污染气体CO2与N2的热化学方程式_______________________ 。
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器的反应温度分别为T甲= 500℃、T乙= 500℃、T丙= a℃
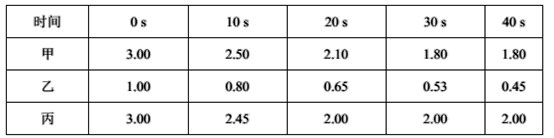
甲容器中,该反应的平衡常数K=_______ 。丙容器的反应温度a _______ 500℃(填“˃”、“<”或“=”),理由是_______________________________ 。
(3)某研究性小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。
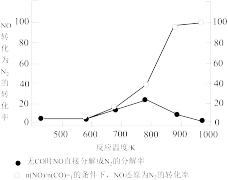
①若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为_________ 。
②在n(NO)/n(CO)=1的条件下,为更好的除去NO物质,应控制的最佳温度在_____ K左右。
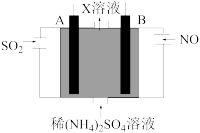
(4)利用电解原理也可以处理NO。下图为工业生产模拟装置。其中A、B为多孔电极(外接电源未画出),则B为___________ 极(填“正”“负”“阴”或“阳”,),A电极反应式为______________________ 。
(1)用还原法将NO转化为无污染的物质。已知:
2C(s)+O2(g)
 2CO △H1=-221.0KJ/mol
2CO △H1=-221.0KJ/molN2(g)+O2(g)
 2NO △H2=+180.5KJ/mol
2NO △H2=+180.5KJ/mol2NO+C(s)
 CO2(g)+N2(g) △H3=-573.75KJ/mol
CO2(g)+N2(g) △H3=-573.75KJ/mol请写出CO与NO生成无污染气体CO2与N2的热化学方程式
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器的反应温度分别为T甲= 500℃、T乙= 500℃、T丙= a℃

甲容器中,该反应的平衡常数K=
(3)某研究性小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。

①若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为
②在n(NO)/n(CO)=1的条件下,为更好的除去NO物质,应控制的最佳温度在
(4)利用电解原理也可以处理NO。下图为工业生产模拟装置。其中A、B为多孔电极(外接电源未画出),则B为

您最近一年使用:0次
名校
9 . “温室效应”是全球关注的环境问题之一,CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有___ (填字母)。
a.减少化石燃料的使用
b.植树造林,增大植被面积
c.采用节能技术
d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2+6H2O C6H12O6(葡萄糖)+6O2
C6H12O6(葡萄糖)+6O2
b.CO2+3H2 CH3OH+H2O
CH3OH+H2O
c.CO2+CH4 CH3COOH
CH3COOH
d.2CO2+6H2 CH2=CH2+4H2O
CH2=CH2+4H2O
以上反应中,最节能的是___ ,原子利用率最高的是___ 。
(3)为了控制温室效应,各国科学家提出了不少设想。有人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底,以减少大气中的CO2。为使CO2液化,可采取的措施___ 。
a.减压、升温 b.增压、降温
c.减压、降温 d.增压、升温
(1)下列措施中,有利于降低大气中CO2浓度的有
a.减少化石燃料的使用
b.植树造林,增大植被面积
c.采用节能技术
d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2+6H2O
 C6H12O6(葡萄糖)+6O2
C6H12O6(葡萄糖)+6O2b.CO2+3H2
 CH3OH+H2O
CH3OH+H2Oc.CO2+CH4
 CH3COOH
CH3COOHd.2CO2+6H2
 CH2=CH2+4H2O
CH2=CH2+4H2O以上反应中,最节能的是
(3)为了控制温室效应,各国科学家提出了不少设想。有人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底,以减少大气中的CO2。为使CO2液化,可采取的措施
a.减压、升温 b.增压、降温
c.减压、降温 d.增压、升温
您最近一年使用:0次
10 . N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________ 。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH− 2
2 +H2O
+H2O
2NO2+2OH−
 +
+ +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是________ (填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl−和 ,其离子方程式为
,其离子方程式为________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________ 。

(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH−
 2
2 +H2O
+H2O2NO2+2OH−

 +
+ +H2O
+H2O①下列措施能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。①在酸性NaClO溶液中,HClO氧化NO生成Cl−和
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是

您最近一年使用:0次
2019-06-10更新
|
7458次组卷
|
32卷引用:湖南省长沙市第一中学2020届高三第一次月考化学试题
湖南省长沙市第一中学2020届高三第一次月考化学试题2019年江苏省高考化学试题河北省邯郸市2019-2020学年高三上学期期中考试化学试题2020届高三化学二轮冲刺新题专练——氮及其氧化物的性质(提升练)2019-2020学年新人教版必修2第5章第2节《氮及其化合物》作业专题3.2 非金属及其化合物(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升专题1.3 氧化还原反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升第2章 化学键化学反应规律 模拟高考——C挑战区 夯实基础(鲁科版(2019)第二册)第2章 化学键 化学反应与能量 模拟高考——C挑战区 夯实基础(鲁科版必修2)专题4 化学科学与人类文明——C挑战区 模拟高考(苏教版必修2)江苏省苏州新草桥中学2020届高三上学期10月月考化学试题(已下线)2020年高考化学押题预测卷01(新课标Ⅰ卷)--《2020年高考押题预测卷》(已下线)专题6.3 化学原理题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升江苏省扬州市江都区大桥高级中学2019-2020学年高二下学期期中考试化学试题江苏省启东中学2021届高三上学期期初考试化学试题鲁科版(2019)高一必修第一册第三章C 高考挑战区 过高考 3年真题强化闯关专题7 第三单元综合拔高练-高中化学必修第二册苏教版2019人教版2019必修第二册 第五章 第二~三节综合拔高练江苏省苏州市工业园区星海实验中学高一下学期3月月考化学试题(已下线)【苏州新东方】04 吴县中学重庆市凤鸣山中学2020-2021学年高一下学期期中考试化学试题湖北省广水市普通中学2020-2021学年高一下学期5月月考化学试题(已下线)第12讲 氮及其化合物(练) — 2022年高考化学一轮复习讲练测(新教材新高考)广东省潮州市饶平县第二中学2021-2022学年高一下学期月考(一)化学试题海南省海南枫叶国际学校2021-2022学年高三上学期第三次月考(1月)化学试题黑龙江省大庆市第四中学2018-2019学年高二下学期第三次月考化学试题(已下线)专题17 原理综合题(已下线)常见无机物的性质江苏省镇江市句容市南京人民中学等三市四校联考2022-2023学年高一下学期4月月考化学试题湖北省黄石市第二中学2023-2024学年高二上学期第三次统测化学试题江苏省常州市联盟校2023-2024学年高一下学期3月阶段调研化学试题江苏省南京市金陵中学2023-2024学年高一下学期3月月考化学试题



