1 . 下列有关合成氨工业的说法中正确的是
| A.铁触媒作催化剂可加快反应速率,且有利于化学平衡向合成氨的方向移动 |
| B.升高温度可以加快反应速率,且有利于化学平衡向合成氨的方向移动 |
| C.增大压强能缩短达到平衡状态所用的时间 |
| D.合成氨采用的压强是10~30MPa,因为该压强下铁触媒的活性最高 |
您最近一年使用:0次
2022-07-26更新
|
756次组卷
|
17卷引用:湖南省益阳市箴言中学2021-2022学年高二上学期10月月考化学试题
湖南省益阳市箴言中学2021-2022学年高二上学期10月月考化学试题湖南省怀化市第五中学2021-2022学年高二上学期期中考试化学试题吉林省长春外国语学校2021-2022学年高二上学期第一次月考化学试题(已下线)必考点04 化学反应的方向和调控-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题湖南省隆回县第二中学2022-2023学年高二上学期线上课程摸底(期中)考试化学试题黑龙江省哈尔滨市宾县第二中学2021-2022学年高二上学期第二次月考化学试题(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第12讲 化学反应的调控-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)2.4.1 合成氨生产适宜条件的选择-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)天津市第二十五中学2022 -2023学年高二上学期期中考试化学试题新疆昌吉州行知学校2022-2023学年高二上学期第一次线上月考化学试题重庆市为明学校2022-2023学年高二上学期期末检测化学试题第四节 化学反应的调控河南省周口市太康县2022-2023学年高二上学期11月期中考试化学试题第二章 第四节 化学反应的调控(已下线)专题06 化学反应的方向及调控【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
名校
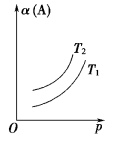
2 . 一定条件下,可逆反应aA(g) bB(g)+cC(g)达到平衡状态后,A的转化率α(A)与温度T(且T1<T2),压强(p)的关系如图所示。下列判断正确的是
bB(g)+cC(g)达到平衡状态后,A的转化率α(A)与温度T(且T1<T2),压强(p)的关系如图所示。下列判断正确的是
 bB(g)+cC(g)达到平衡状态后,A的转化率α(A)与温度T(且T1<T2),压强(p)的关系如图所示。下列判断正确的是
bB(g)+cC(g)达到平衡状态后,A的转化率α(A)与温度T(且T1<T2),压强(p)的关系如图所示。下列判断正确的是
| A.a<b+c | B.正反应为吸热反应 |
| C.该反应的平衡常数随温度的升高而增大 | D.该反应用于工业生产时,采用的压强越大越好 |
您最近一年使用:0次
2021-10-23更新
|
215次组卷
|
5卷引用:湖南常德淮阳中学2021-2022学年高二上学期期中考试化学试题
名校
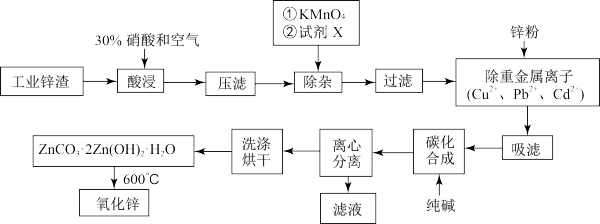
3 . 工业品氧化锌广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物及Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:
已知:相关金属离子[c(Mn+)=0.1 mol·L-1]生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)为保证锌渣酸浸的充分,需要保持酸过量,且c(H+)=0.5 mol·L-1左右。写出一种加快锌渣浸出的措施:___________ 。
(2)为调节溶液的pH,则试剂X为___________ (填化学式),调节溶液pH的范围是___________ 。
(3)除杂时加入高锰酸钾时发生反应的离子方程式为___________ 。
(4)“过滤”所得滤渣的主要成分是___________ (填化学式)。
(5)写出“碳化合成”的化学方程式:___________ ;“碳化合成”过程中纯碱需要稍过量,请设计实验方案证明纯碱过量:___________ 。

已知:相关金属离子[c(Mn+)=0.1 mol·L-1]生成氢氧化物沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ | Zn2+ | Cu2+ | Cd2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 3.4 | 8.1 | 6.2 | 6.0 | 7.4 |
| 完全沉淀的pH | 2.8 | 8.3 | 4.7 | 10.1 | 8.2 | 8.0 | 9.4 |
(1)为保证锌渣酸浸的充分,需要保持酸过量,且c(H+)=0.5 mol·L-1左右。写出一种加快锌渣浸出的措施:
(2)为调节溶液的pH,则试剂X为
(3)除杂时加入高锰酸钾时发生反应的离子方程式为
(4)“过滤”所得滤渣的主要成分是
(5)写出“碳化合成”的化学方程式:
您最近一年使用:0次
解题方法
4 . 碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠的过程如下:
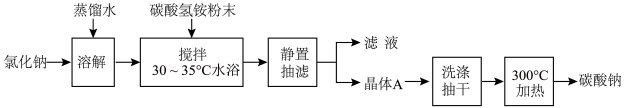
下列说法错误的是

下列说法错误的是
| A.“搅拌”的目的是为了提高反应速率 |
B.“搅拌”中主要发生的化学反应为: |
C.“抽滤”后滤液中大量存在的阳离子有 、 、 |
| D.“300℃加热”时发生的化学反应属于氧化还原反应 |
您最近一年使用:0次
解题方法
5 . 丙烯是三大合成材料的主要原料,丙烷脱氢制取丙烯是目前常用方法之一、丙烷脱氢制丙烯的主要反应如下:
直接裂解: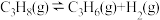
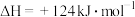
氧气氧化脱氢: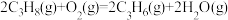
回答下列问题:
(1)目前直接裂解是丙烷脱氢制取丙烯的常用方法。直接裂解时,下列条件有利于提高 平衡转化率的是
平衡转化率的是___________ (填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)“氧气氧化脱氢”相比于“直接裂解”的优点是___________ (列举1点)。
(3)一定压强下,向一恒容密闭容器中充入1mol 和1molCO2,平衡时各物质的物质的量与温度的关系如图1所示;
和1molCO2,平衡时各物质的物质的量与温度的关系如图1所示;
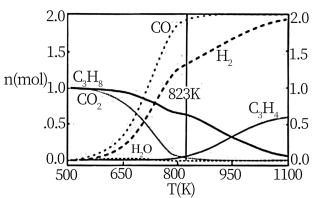
①在500~800K之间,主要发生的反应为___________ ;823K以上主要发生的反应为___________ 。
②一定压强下,向一密闭容器中充入一定量的 和CO2发生反应:
和CO2发生反应: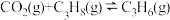
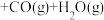
 。
。 的平衡转化率在不同投料比[
的平衡转化率在不同投料比[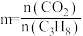 ]下与温度的关系如图2所示:
]下与温度的关系如图2所示:
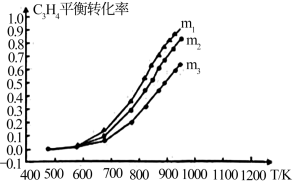

___________ (填“<”或“>”)0;投料比从小到大的顺序为___________ 。
(4)丙烷分别在0.1MPa和 MPa直接裂解,反应达到平衡时,丙烷和丙烯的物质的量分数随温度的变化关系如图3所示:
MPa直接裂解,反应达到平衡时,丙烷和丙烯的物质的量分数随温度的变化关系如图3所示:
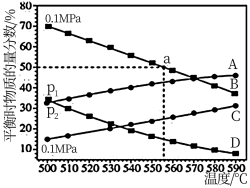
压强
___________ (填“<”或“>”)0.1;D为___________ (填化学式);a点温度下裂解反应的平衡常数
___________ MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
直接裂解:
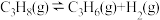
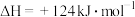
氧气氧化脱氢:
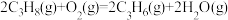
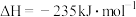
回答下列问题:
(1)目前直接裂解是丙烷脱氢制取丙烯的常用方法。直接裂解时,下列条件有利于提高
 平衡转化率的是
平衡转化率的是A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)“氧气氧化脱氢”相比于“直接裂解”的优点是
(3)一定压强下,向一恒容密闭容器中充入1mol
 和1molCO2,平衡时各物质的物质的量与温度的关系如图1所示;
和1molCO2,平衡时各物质的物质的量与温度的关系如图1所示;
①在500~800K之间,主要发生的反应为
②一定压强下,向一密闭容器中充入一定量的
 和CO2发生反应:
和CO2发生反应: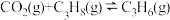
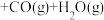
 。
。 的平衡转化率在不同投料比[
的平衡转化率在不同投料比[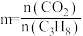 ]下与温度的关系如图2所示:
]下与温度的关系如图2所示:

(4)丙烷分别在0.1MPa和
 MPa直接裂解,反应达到平衡时,丙烷和丙烯的物质的量分数随温度的变化关系如图3所示:
MPa直接裂解,反应达到平衡时,丙烷和丙烯的物质的量分数随温度的变化关系如图3所示:
压强


您最近一年使用:0次
2021-05-20更新
|
449次组卷
|
3卷引用:湖南省永州市省重点中学2021届高三5月联考化学试题
6 . CO2作为未来重要的碳源,其选择性加氢合成醇燃料是研究的热点。
(1)CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为CO2捕获剂的是_____ (填标号)。
A.(NH4)2SO4溶液 B.NaOH溶液 C.CH3COCH3 D.石灰乳
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇。
 (g)+CO2(g)+3H2(g)→
(g)+CO2(g)+3H2(g)→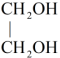 (g)+CH3OH(g) ΔH=-123.6kJ/mol
(g)+CH3OH(g) ΔH=-123.6kJ/mol
但若反应温度过高,乙二醇会深度加氢生成乙醇。
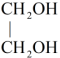 (g)+H2(g)→C2H5OH(g)+H2O(g) ΔH=-94.8kJ/mol
(g)+H2(g)→C2H5OH(g)+H2O(g) ΔH=-94.8kJ/mol
获取乙二醇的反应历程可分为如下2步:
Ⅰ. (g)+CO2(g)→
(g)+CO2(g)→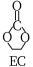 (g) ΔH=-61.3kJ/mol
(g) ΔH=-61.3kJ/mol
Ⅱ. EC加氢生成乙二醇与甲醇
①步骤Ⅱ的热化学方程式是_____ 。
②研究反应温度对EC加氢的影响(反应时间均为 小时)实验数据见下表:
小时)实验数据见下表:
温度过高,对提高乙二醇的产率反而不利,原因是_____ 。
(3)2017年采用中国自主知识产权的全球首套煤基乙醇工业化项目投产成功。某地煤制乙醇的过程表示如下。

过程a包括以下3个主要反应:
Ⅰ. CH3COOCH3(g)+2H2(g)⇌C2H5OH(g)+CH3OH(g)ΔH1
Ⅱ. CH3COOCH3+C2H5OH(g)⇌CH3COOC2H5(g)+CH3OH(g)ΔH2
Ⅲ. CH3COOCH3(g)+H2(g)⇌CH3CHO(g)+CH3OH(g)ΔH3
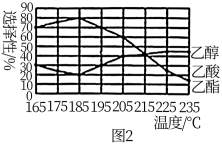
相同时间内,测得CH3COOCH3转化率、乙醇和乙酸乙酯的选择性(如乙醇选择性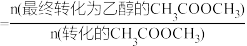 如下图所示。
如下图所示。
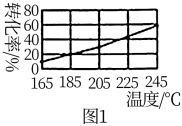
①随温度升高,反应Ⅰ化学平衡常数逐渐减小,可推知ΔH1_____ 0(填“<”或“=”或“>”)。
②下列说法合理 的是_____ 。
A.温度可影响催化剂的选择性,从而影响目标产物的选择性
B.增大H2的浓度,可以提高CH3COOCH3的转化率
C.225℃~235℃,反应Ⅰ处于平衡状态
③为防止副产物CH3CHO的生成,反应温度应控制的范围是_____ 。
④在205℃时,CH3COOCH3起始物质的量为5mol,转化率为30%,生成乙醇的物质的量是_____ 。
(1)CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为CO2捕获剂的是
A.(NH4)2SO4溶液 B.NaOH溶液 C.CH3COCH3 D.石灰乳
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇。
 (g)+CO2(g)+3H2(g)→
(g)+CO2(g)+3H2(g)→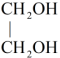 (g)+CH3OH(g) ΔH=-123.6kJ/mol
(g)+CH3OH(g) ΔH=-123.6kJ/mol但若反应温度过高,乙二醇会深度加氢生成乙醇。
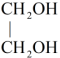 (g)+H2(g)→C2H5OH(g)+H2O(g) ΔH=-94.8kJ/mol
(g)+H2(g)→C2H5OH(g)+H2O(g) ΔH=-94.8kJ/mol获取乙二醇的反应历程可分为如下2步:
Ⅰ.
 (g)+CO2(g)→
(g)+CO2(g)→ (g) ΔH=-61.3kJ/mol
(g) ΔH=-61.3kJ/molⅡ. EC加氢生成乙二醇与甲醇
①步骤Ⅱ的热化学方程式是
②研究反应温度对EC加氢的影响(反应时间均为
 小时)实验数据见下表:
小时)实验数据见下表:| 反应温度/℃ | EC转化率/% | 产率/% | |
| 乙二醇 | 甲醇 | ||
| 160 | 23.9 | 23.2 | 12.9 |
| 180 | 63.1 | 60.9 | 31.5 |
| 200 | 99.9 | 94.7 | 62.3 |
| 220 | 99.9 | 92.4 | 46.1 |
(3)2017年采用中国自主知识产权的全球首套煤基乙醇工业化项目投产成功。某地煤制乙醇的过程表示如下。

过程a包括以下3个主要反应:
Ⅰ. CH3COOCH3(g)+2H2(g)⇌C2H5OH(g)+CH3OH(g)ΔH1
Ⅱ. CH3COOCH3+C2H5OH(g)⇌CH3COOC2H5(g)+CH3OH(g)ΔH2
Ⅲ. CH3COOCH3(g)+H2(g)⇌CH3CHO(g)+CH3OH(g)ΔH3
相同时间内,测得CH3COOCH3转化率、乙醇和乙酸乙酯的选择性(如乙醇选择性
 如下图所示。
如下图所示。

①随温度升高,反应Ⅰ化学平衡常数逐渐减小,可推知ΔH1
②下列说法
A.温度可影响催化剂的选择性,从而影响目标产物的选择性
B.增大H2的浓度,可以提高CH3COOCH3的转化率
C.225℃~235℃,反应Ⅰ处于平衡状态
③为防止副产物CH3CHO的生成,反应温度应控制的范围是
④在205℃时,CH3COOCH3起始物质的量为5mol,转化率为30%,生成乙醇的物质的量是
您最近一年使用:0次
7 . 工业生产排放的烟气中同时存在SO2、NOx和CO,利用它们的相互作用可将SO2、NOx还原成无害物质,一定条件下得到以下实验结果。图1为298K各气体分压与CO物质的量分数的关系,图2为CO物质的量分数为2.0%时,各气体分压与温度的关系。
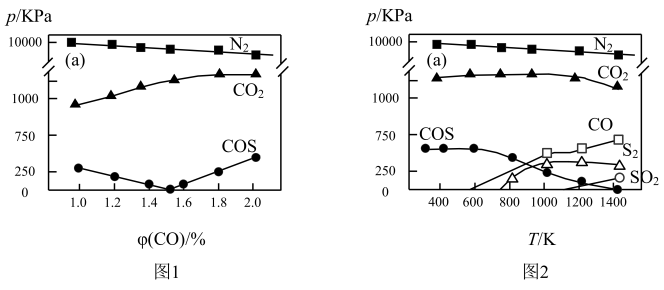
下列说法错误的是

下列说法错误的是
| A.不同温度下脱硝的产物为N2,脱硫的产物可能有多种 |
| B.温度越高脱硫脱硝的效果越好 |
| C.NOx比SO2更易被CO还原 |
| D.体系中可能发生反应:2COS⇌S2+2CO、4CO2+S2⇌4CO+2SO2 |
您最近一年使用:0次
8 . 人体内的血红蛋白(Hb)可与O2结合,更易与CO结合使人体中毒,涉及原理如下:
①Hb(aq)+O2(g) HbO2(aq) ΔH1<0
HbO2(aq) ΔH1<0
②Hb(aq)+CO(g) HbCO(aq) ΔH2<0
HbCO(aq) ΔH2<0
③HbO2(aq)+CO(g) HbCO(aq)+O2(g) ΔH3<0
HbCO(aq)+O2(g) ΔH3<0
下列说法错误的是
①Hb(aq)+O2(g)
 HbO2(aq) ΔH1<0
HbO2(aq) ΔH1<0②Hb(aq)+CO(g)
 HbCO(aq) ΔH2<0
HbCO(aq) ΔH2<0③HbO2(aq)+CO(g)
 HbCO(aq)+O2(g) ΔH3<0
HbCO(aq)+O2(g) ΔH3<0下列说法错误的是
| A.ΔH1<ΔH2 |
| B.反应①、②在一定温度下均能自发进行 |
| C.刚从平原到高原时,人体血液中c(HbO2)将降低,使人体因缺氧而不适 |
| D.将CO中毒的人转至高压氧仓中治疗,反应③平衡逆向移动而缓解症状 |
您最近一年使用:0次
9 . 十九大报告提出“要像对待生命一样对待生态环境”,对硫、氮、碳元素形成的有毒有害气体进行处理成为科学研究热点。请回答下列问题:
Ⅰ.氮元素的化合物种类繁多,研究氮氧化物的反应机理对于消除污染有重要指导作用。
(1)NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO。
已知:2SO2(g)+O2(g) 2SO3(g) ΔH1=-196.6 kJ·mol-1
2SO3(g) ΔH1=-196.6 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH2=-113.0 kJ·mol-1
则NO2氧化SO2的热化学方程式为_______ 。
(2)利用现代传感技术探究压强对2NO2 (g) N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图1所示。
N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图1所示。

①B、E两点对应的正反应速率大小为vB_______ vE(填“>”或“<”)。
②E、F、H三点对应气体的平均相对分子质量最大的点为_______ (填字母序号)。
(3)可用上图2装置将雾霾中的NO、SO2转化为(NH4)2SO4,则阴极的电极反应式为_______ ,物质A是 _______ (填化学式)。
Ⅱ.利用CO2制取甲醛可以缓解温室效应,反应方程式为CO2(g)+2H2(g) HCHO(g)+H2O(g)。请回答下列问题:
HCHO(g)+H2O(g)。请回答下列问题:
(4)T1℃时,将体积比为1: 2的CO2和H2混合气体充入恒容密闭容器中,每隔一定时间测得容器内气体压强如表所示:
①已知:vp(B)= 。前10 min,用H2的压强变化表示该反应的平均反应速率为
。前10 min,用H2的压强变化表示该反应的平均反应速率为_______ kPa∙min-1。
②T1℃时,反应的平衡常数Kp=_______ kPa-1(Kp为用各气体分压表示的平衡常数,分压=总压×物质的量分数;结果保留三位有效数字)。
Ⅰ.氮元素的化合物种类繁多,研究氮氧化物的反应机理对于消除污染有重要指导作用。
(1)NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO。
已知:2SO2(g)+O2(g)
 2SO3(g) ΔH1=-196.6 kJ·mol-1
2SO3(g) ΔH1=-196.6 kJ·mol-12NO(g)+O2(g)=2NO2(g) ΔH2=-113.0 kJ·mol-1
则NO2氧化SO2的热化学方程式为
(2)利用现代传感技术探究压强对2NO2 (g)
 N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图1所示。
N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图1所示。
①B、E两点对应的正反应速率大小为vB
②E、F、H三点对应气体的平均相对分子质量最大的点为
(3)可用上图2装置将雾霾中的NO、SO2转化为(NH4)2SO4,则阴极的电极反应式为
Ⅱ.利用CO2制取甲醛可以缓解温室效应,反应方程式为CO2(g)+2H2(g)
 HCHO(g)+H2O(g)。请回答下列问题:
HCHO(g)+H2O(g)。请回答下列问题:(4)T1℃时,将体积比为1: 2的CO2和H2混合气体充入恒容密闭容器中,每隔一定时间测得容器内气体压强如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
 。前10 min,用H2的压强变化表示该反应的平均反应速率为
。前10 min,用H2的压强变化表示该反应的平均反应速率为②T1℃时,反应的平衡常数Kp=
您最近一年使用:0次
10 . 工业上利用NH3对烟道气进行脱硝(除去氧化物)的SCR技术具有效率高、性能可靠的优势,SCR技术的原理为NH3和NO在催化剂(MnO2)表面转化为N2和H2O,反应进程中的相对能量变化如图所示。下列说法错误的是
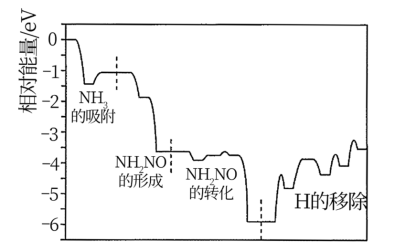

| A.达平衡时升高温度,脱硝反应的正反应速率的增大程度大于其逆反应速率的增大程度 |
| B.NH2NO是脱硝反应的活性中间体 |
C.NH3脱硝反应的化学方程式为 |
| D.决定脱硝反应速率的步骤为“NH2NO的转化” |
您最近一年使用:0次



