名校
解题方法
1 . 工业利用含镍废料(以镍铁钙合金为主)制取NiC2O4(草酸镍),再经过高温煅烧NiC2O4制取Ni2O3的流程如图1所示。
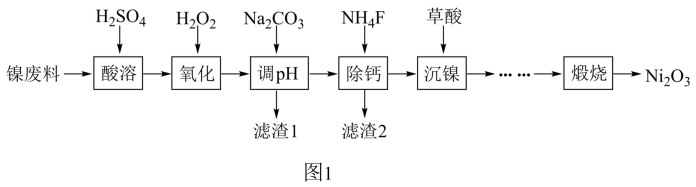
已知:NiC2O4、CaC2O4均难溶于水;Fe3+完全沉淀的pH约为3.2。
(1)“酸溶”时加快溶解速率的方法____ (写两种即可)。
(2)加入H2O2发生的主要反应的离子方程式为____ 。
(3)加入Na2CO3溶液调节pH至4.0~5.0,其目的为____ 。
(4)加入NH4F溶液可将Ca2+转化为CaF2沉淀除去,已知25℃时Ksp(CaF2)=1.6×10-10,要使溶液中Ca2+沉淀完全[c(Ca2+)≤1.0×10-5mol·L-1],则“除钙”时需控制NH4F的浓度至少为____ mol·L-1。
(5)隔绝空气高温煅烧NiC2O4可制得Ni2O3,NiC2O4受热分解的化学方程式为____ 。
(6)Ni2O3还可用于制备合成氨的催化剂ConNi1-nFe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图2:
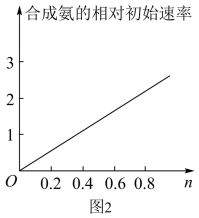
由图可知Co2+、Ni2+两种离子中催化效果更好的是____ 。

已知:NiC2O4、CaC2O4均难溶于水;Fe3+完全沉淀的pH约为3.2。
(1)“酸溶”时加快溶解速率的方法
(2)加入H2O2发生的主要反应的离子方程式为
(3)加入Na2CO3溶液调节pH至4.0~5.0,其目的为
(4)加入NH4F溶液可将Ca2+转化为CaF2沉淀除去,已知25℃时Ksp(CaF2)=1.6×10-10,要使溶液中Ca2+沉淀完全[c(Ca2+)≤1.0×10-5mol·L-1],则“除钙”时需控制NH4F的浓度至少为
(5)隔绝空气高温煅烧NiC2O4可制得Ni2O3,NiC2O4受热分解的化学方程式为
(6)Ni2O3还可用于制备合成氨的催化剂ConNi1-nFe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图2:

由图可知Co2+、Ni2+两种离子中催化效果更好的是
您最近一年使用:0次
2022-03-16更新
|
66次组卷
|
4卷引用:新疆疏附县第二中学2021-2022学年高三上学期11月月考化学试题
名校
2 . 甲醇是一种可再生能源,CO和CO2催化加氢制甲醇,是极具前景的温室气体资源化研究领域。
(1)已知在25℃,101kPa下:甲醇(l)的燃烧热为akJ·mol-1,CO(g)的燃烧热为bkJ·mol-1,H2O(g)=H2O(l) ΔH=+ckJ·mol-1。则甲醇(l)不完全燃烧生成一氧化碳和水蒸气的热化学方程式为___________ 。
(2)恒温恒压下,在容积可变的密闭容器中加入一定量的CO和H2发生反应
i.CO(g)+2H2(g) CH3OH(g) ΔH=-90.2 kJ·mol-1制备甲醇,测得平衡时CO的转化率(α)随温度、压强的变化如图所示:
CH3OH(g) ΔH=-90.2 kJ·mol-1制备甲醇,测得平衡时CO的转化率(α)随温度、压强的变化如图所示:
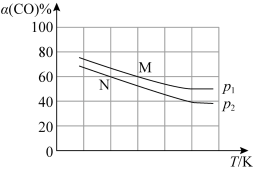
则P1___________ P2,M点的正反应速率___________ N点的逆反应速率。(填“>”、“<”或“=”)
(3)在某催化剂作用下,CO2和H2发生反应
ii: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1
iii:CO2(g)+H2(g) CO(g)+H2O(g) △H3=41.2 kJ·mol-1
CO(g)+H2O(g) △H3=41.2 kJ·mol-1
①维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
注:甲醇的选择性是指发生反应的CO2中转化为甲醇的百分比。
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是:___________ 。为减少副反应的发生,同时不降低CO2生成CH3OH的反应速率和平衡转化率,可采取的措施是___________ 。
(4)恒温恒压密闭容器中,加入2molCO2和4molH2,只发生反应ⅱ和反应ⅲ,初始压强为P0,在300℃发生反应,反应达平衡时,CO2的转化率为50%,容器体积减小25%,反应ⅱ的平衡常数Kp=___________ (kPa)-2(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
(5)以甲醇为原料,通过电化学法可以合成碳酸二甲酯[(CH3O)2CO],工作原理如图所示。

①阳极的电极反应式为___________ 。
②若以铅蓄电池为电源,B应与铅蓄电池的___________ (填“Pb”或“PbO2” )相连。
(1)已知在25℃,101kPa下:甲醇(l)的燃烧热为akJ·mol-1,CO(g)的燃烧热为bkJ·mol-1,H2O(g)=H2O(l) ΔH=+ckJ·mol-1。则甲醇(l)不完全燃烧生成一氧化碳和水蒸气的热化学方程式为
(2)恒温恒压下,在容积可变的密闭容器中加入一定量的CO和H2发生反应
i.CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.2 kJ·mol-1制备甲醇,测得平衡时CO的转化率(α)随温度、压强的变化如图所示:
CH3OH(g) ΔH=-90.2 kJ·mol-1制备甲醇,测得平衡时CO的转化率(α)随温度、压强的变化如图所示:
则P1
(3)在某催化剂作用下,CO2和H2发生反应
ii: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1iii:CO2(g)+H2(g)
 CO(g)+H2O(g) △H3=41.2 kJ·mol-1
CO(g)+H2O(g) △H3=41.2 kJ·mol-1①维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
| T(℃) | CO2实际转化率(%) | 甲醇选择性(%) |
| 243 | 12.3 | 42.3 |
| 253 | 15.3 | 39.1 |
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是:
(4)恒温恒压密闭容器中,加入2molCO2和4molH2,只发生反应ⅱ和反应ⅲ,初始压强为P0,在300℃发生反应,反应达平衡时,CO2的转化率为50%,容器体积减小25%,反应ⅱ的平衡常数Kp=
(5)以甲醇为原料,通过电化学法可以合成碳酸二甲酯[(CH3O)2CO],工作原理如图所示。

①阳极的电极反应式为
②若以铅蓄电池为电源,B应与铅蓄电池的
您最近一年使用:0次
2021-06-04更新
|
1195次组卷
|
8卷引用:新疆克拉玛依克拉玛依市独山子第二中学2021-2022学年高三上学期12月月考化学试题
新疆克拉玛依克拉玛依市独山子第二中学2021-2022学年高三上学期12月月考化学试题安徽省安庆市第一中学2021届高三第三次模拟考试理综化学试题(已下线)2021年秋季高三化学开学摸底考试卷03(广东专用)河北省实验中学2022届高三年级上学期开学考试化学试题河北省石家庄市第二中学2022届高三补偿诊断性考试新疆维吾尔自治区阿克苏地区第二中学2022-2023学年高三上学期第一次月考化学试题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-讲义陕西省西安工业大学附属中学2021-2022学年高三下学期第七次适应性训练理综化学试题
名校
3 . 钒元素用途广泛,如图是一种钒的化合物催化某反应的反应机理。下列叙述错误的是
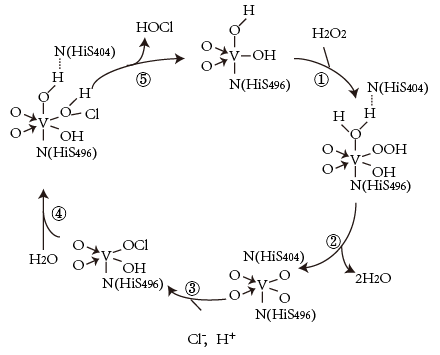

| A.H2O参与了该催化反应 |
| B.过程①中反应的原子利用率为100% |
| C.该催化循环过程中有氢氧键的断裂和形成 |
| D.每次循环的净反应为H2O2+2C1-=2HOCl+2e- |
您最近一年使用:0次
2021-04-24更新
|
1635次组卷
|
16卷引用:新疆石河子第一中学2021-2022学年高三上学期8月月考(A卷)化学试题
新疆石河子第一中学2021-2022学年高三上学期8月月考(A卷)化学试题安徽省皖南八校2021届高三4月第三次联考理综化学试题(已下线)押山东卷第13题 陌生反应机理选择题-备战2021年高考化学临考题号押题(山东卷)(已下线)2021年高考化学押题预测卷(山东卷)03(含考试版、答题卡、参考答案、全解全析)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)2022年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷B(已下线)考点01 物质的组成、分类及转化-备战2022年高考化学学霸纠错(全国通用)(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)(已下线)考点01 物质的分类和转化-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)2022年辽宁省高考真题变式题(16-19)江西省宜春市上高二中2021-2022学年高三下学期第十次月考(5月)理综化学试题(已下线)专题13 反应微观机理分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)2022年辽宁高考真题化学试题变式题(选择题6-10)(已下线)考点01 物质的分类和转化(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江西省南昌十九中2023-2024学年高三上学期第一次月考化学试卷
解题方法
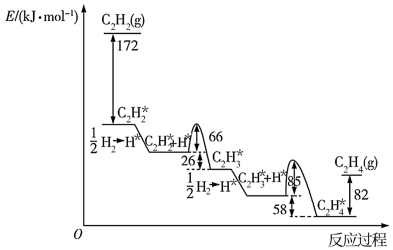
4 . 乙炔( )在
)在 表面选择加氢的反应历程如图所示。其中吸附在
表面选择加氢的反应历程如图所示。其中吸附在 表面上的物种用*标注。下列有关说法错误的是
表面上的物种用*标注。下列有关说法错误的是
 )在
)在 表面选择加氢的反应历程如图所示。其中吸附在
表面选择加氢的反应历程如图所示。其中吸附在 表面上的物种用*标注。下列有关说法错误的是
表面上的物种用*标注。下列有关说法错误的是
| A.从反应历程图可知,乙炔加氢的反应是放热反应 |
B.该历程中最大能垒(活化能)步骤的化学方程式是: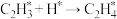 |
C.过程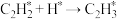 中只有化学键的形成 中只有化学键的形成 |
D.副反应生成的高聚物吸附在 的表面可能会使催化剂中毒 的表面可能会使催化剂中毒 |
您最近一年使用:0次
解题方法
5 . CO2引起的气候变化已经引起了全世界的关注,但同时CO2也是时持续的碳资源,将CO2转化为高附加值的燃料或化学品不仅可以解决CO2的问题,还可变废为宝得到有用的化学品。CO2加氢制甲醇是实现这一过程的理想选择之一、
(1)CO2加氢制甲醇的化学方程式是:CO2(g)+3H2(g) CH3OH(l)+H2O(l) ∆H, 相关物质的燃烧热数据如下表所示:
CH3OH(l)+H2O(l) ∆H, 相关物质的燃烧热数据如下表所示:
回答下列问题:
①∆H=___________ kJ∙mol−1
②320℃时,将含CO2体积分数10%的空气与H2按体积比5:2投入到密闭容器中,同时加入催化剂发生反应(此时体系内各物质均为气态),测得初始时压强为P,反应一段时间后达到平衡,测得CO2的平衡转化率为50%,则平衡时体系的压强为___________ ,反应的平衡常数___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)Fujta等学者开展了在Cu/ZnO催化剂上进行CO2+H2合成甲醇机理的研究。机理如下:
①过程3的化学方程式为___________ ; 研究表明,过程3的活化能小但实际反应速率慢,是控速步骤,导致该步反应速率小的原因可能是___________ 。
A.H2O对该反应有阻碍作用 B. CO2的存在削弱了同一吸附位上H2的吸附
C.温度变化导致活化能增大 D.温度变化导致平衡常数减小
②ZnO也有催化作用,催化机理与Cu相似,CH3O−Zn与___________ 反应可获得CH3OH。
(3)科学家设计了一种新的CO2−H2O可循环系统,可以实现温室气体的零排放,同时也回避了H2的难储存问题,装置如下:
①系统中的能量转化形式有___________ 。
②b电极上的电极反应式为___________ ,如果将电解质溶液换为KOH溶液,对合成甲醇造成的不良后果是___________ 。
(1)CO2加氢制甲醇的化学方程式是:CO2(g)+3H2(g)
 CH3OH(l)+H2O(l) ∆H, 相关物质的燃烧热数据如下表所示:
CH3OH(l)+H2O(l) ∆H, 相关物质的燃烧热数据如下表所示:| 物质 | H2(g) | CH3OH(1) |
| 燃烧热△H (kJ∙mol−1) | −284 | −726 |
①∆H=
②320℃时,将含CO2体积分数10%的空气与H2按体积比5:2投入到密闭容器中,同时加入催化剂发生反应(此时体系内各物质均为气态),测得初始时压强为P,反应一段时间后达到平衡,测得CO2的平衡转化率为50%,则平衡时体系的压强为
(2)Fujta等学者开展了在Cu/ZnO催化剂上进行CO2+H2合成甲醇机理的研究。机理如下:
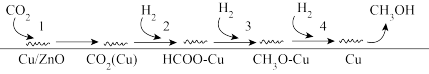
①过程3的化学方程式为
A.H2O对该反应有阻碍作用 B. CO2的存在削弱了同一吸附位上H2的吸附
C.温度变化导致活化能增大 D.温度变化导致平衡常数减小
②ZnO也有催化作用,催化机理与Cu相似,CH3O−Zn与
(3)科学家设计了一种新的CO2−H2O可循环系统,可以实现温室气体的零排放,同时也回避了H2的难储存问题,装置如下:
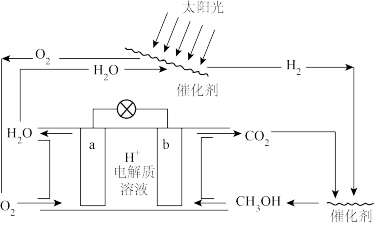
①系统中的能量转化形式有
②b电极上的电极反应式为
您最近一年使用:0次
2021-03-03更新
|
224次组卷
|
3卷引用:新疆维吾尔自治区2021届高三第二次联考理科综合能力测试化学试卷
新疆维吾尔自治区2021届高三第二次联考理科综合能力测试化学试卷湖北省宜昌英杰学校2021-2022学年高三上学期10月月考化学试题(已下线)压轴题13 化学反应原理综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
6 . 2007年诺贝尔化学奖授予了合成氨研究领域的科学家。关于合成氨的说法正确的是
| A.该反应为吸热反应 |
| B.原料N2主要来源于化石燃料 |
| C.合成氨工业生产在常温常压下进行 |
| D.合成氨工业生产通常会使用催化剂来加快反应速率 |
您最近一年使用:0次
2020-12-11更新
|
649次组卷
|
3卷引用:新疆阿勒泰地区2020-2021学年高二上学期期末考试化学试题
名校
解题方法
7 . 乙烯(C2H4)是重要的化工原料,乙炔(C2H2)选择性加氢合成乙烯是科学家当前关注的热点。
(1)C2H2加氢反应的能量变化示意图如下,乙炔加氢生成乙烯的热化学方程式为________ 。

(2)70℃时,反应C2H2(g)+H2(g)=C2H4(g)在刚性容器中达到平衡。
①下列说法正确的是___________ (填标号)。
A 选用合适的催化剂,可以增大平衡气体中C2H4的百分含量
B 投料时增大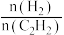 的值,该反应的平衡常数K不变
的值,该反应的平衡常数K不变
C 通入一定量He,可以缩短反应达到平衡的时间
D 升高温度,正反应速率和逆反应速率都增大,K减小
②测得在某催化剂上生成乙烯的速率方程为v=0.585[p(C2H2)]-0.36[p(H2)]0.85。p(H2)一定时,若p1(C2H2)>p2(C2H2),则v1_______ v2(填“>”、“<”或“=”)。
(3)在催化剂作用下,110℃时按体积比V(C2H2):V(H2)=1:4充入刚性容器中,发生反应C2H2+H2=C2H4、C2H2+2H2=C2H6。乙炔完全反应时,乙烯的体积分数为20%,则H2的转化率为___________ ,C2H4的选择性为___________ (C2H4的选择性 )。
)。
(4)科学家利用Pd、Pt作电极,电解催化乙炔合成乙烯,同时可得到副产品H2和O2,示意图如下:

“b”出口得到的副产品是_______________ ,Pd电极发生的电极反应有_______________ 。
(1)C2H2加氢反应的能量变化示意图如下,乙炔加氢生成乙烯的热化学方程式为

(2)70℃时,反应C2H2(g)+H2(g)=C2H4(g)在刚性容器中达到平衡。
①下列说法正确的是
A 选用合适的催化剂,可以增大平衡气体中C2H4的百分含量
B 投料时增大
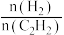 的值,该反应的平衡常数K不变
的值,该反应的平衡常数K不变C 通入一定量He,可以缩短反应达到平衡的时间
D 升高温度,正反应速率和逆反应速率都增大,K减小
②测得在某催化剂上生成乙烯的速率方程为v=0.585[p(C2H2)]-0.36[p(H2)]0.85。p(H2)一定时,若p1(C2H2)>p2(C2H2),则v1
(3)在催化剂作用下,110℃时按体积比V(C2H2):V(H2)=1:4充入刚性容器中,发生反应C2H2+H2=C2H4、C2H2+2H2=C2H6。乙炔完全反应时,乙烯的体积分数为20%,则H2的转化率为
 )。
)。(4)科学家利用Pd、Pt作电极,电解催化乙炔合成乙烯,同时可得到副产品H2和O2,示意图如下:

“b”出口得到的副产品是
您最近一年使用:0次
2020-09-21更新
|
216次组卷
|
3卷引用:新疆乌鲁木齐市第八中学2020-2021学年高二上学期期末考试化学试题
新疆乌鲁木齐市第八中学2020-2021学年高二上学期期末考试化学试题广东省广州市六区2021届高三9月教学质量检测(一)化学试题(已下线)江苏省运河中学、徐州市铜山区棠张中学2021届高三12月联考化学试题
解题方法
8 . 某空间站中宇航员的呼吸保障系统原理如图所示。

Sabatier系统中发生反应为:
反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g)△H1
CH4(g)+2H2O(g)△H1
反应II:CO2(g)+H2(g) CO(g)+H2O(g)△H2=+41.2kJ/mol
CO(g)+H2O(g)△H2=+41.2kJ/mol
(1)常温常压下,已知:
①H2和CH4的燃烧热(△H)分别为-285.5kJ·mol-1和-890.0kJ·mol-1;
②H2O(l)=H2O(g)△H3=+44.0kJ·mol-1。则△H1=__________ kJ·mol-1。
(2)按 =4的混合气体充入Sabatier系统,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图所示;不同压强时,CO2的平衡转化率如图所示:
=4的混合气体充入Sabatier系统,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图所示;不同压强时,CO2的平衡转化率如图所示:

①Sabatier系统中应选择适宜的温度是__________ 。
②200~550℃时,CO2的物质的量分数随温度升高而增大的原因是__________ 。
③当温度一定时,随压强升高,CO2的平衡转化率增大,其原因是__________ 。
(3)一种新的循环利用方案是用Bosch反应[CO2(g)+2H2(g) C(s)+2H2O(g)]代替Sabatier系统。
C(s)+2H2O(g)]代替Sabatier系统。
①分析Bosch反应的熵值变化为:△S__________ 0(选填“>”或“<”)。
②温度一定时,在2L密闭容器中按 =2投料进行Bosch反应,达到平衡时体系的压强为原来压强p0的0.7倍,该温度下反应平衡常数Kp为
=2投料进行Bosch反应,达到平衡时体系的压强为原来压强p0的0.7倍,该温度下反应平衡常数Kp为__________ (用含p0的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③下列措施能提高Bosch反应中CO2转化率的是_________ (填标号)。
A.加快反应器中气体的流速B.提高原料气中CO2所占比例
C.增大催化剂的表面积D.反应器前段加热,后段冷却

Sabatier系统中发生反应为:
反应I:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)△H1
CH4(g)+2H2O(g)△H1反应II:CO2(g)+H2(g)
 CO(g)+H2O(g)△H2=+41.2kJ/mol
CO(g)+H2O(g)△H2=+41.2kJ/mol(1)常温常压下,已知:
①H2和CH4的燃烧热(△H)分别为-285.5kJ·mol-1和-890.0kJ·mol-1;
②H2O(l)=H2O(g)△H3=+44.0kJ·mol-1。则△H1=
(2)按
 =4的混合气体充入Sabatier系统,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图所示;不同压强时,CO2的平衡转化率如图所示:
=4的混合气体充入Sabatier系统,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图所示;不同压强时,CO2的平衡转化率如图所示:
①Sabatier系统中应选择适宜的温度是
②200~550℃时,CO2的物质的量分数随温度升高而增大的原因是
③当温度一定时,随压强升高,CO2的平衡转化率增大,其原因是
(3)一种新的循环利用方案是用Bosch反应[CO2(g)+2H2(g)
 C(s)+2H2O(g)]代替Sabatier系统。
C(s)+2H2O(g)]代替Sabatier系统。①分析Bosch反应的熵值变化为:△S
②温度一定时,在2L密闭容器中按
 =2投料进行Bosch反应,达到平衡时体系的压强为原来压强p0的0.7倍,该温度下反应平衡常数Kp为
=2投料进行Bosch反应,达到平衡时体系的压强为原来压强p0的0.7倍,该温度下反应平衡常数Kp为③下列措施能提高Bosch反应中CO2转化率的是
A.加快反应器中气体的流速B.提高原料气中CO2所占比例
C.增大催化剂的表面积D.反应器前段加热,后段冷却
您最近一年使用:0次
2020-07-07更新
|
158次组卷
|
3卷引用:新疆维吾尔自治区巴州二中2021届高三第六次月考化学试题
新疆维吾尔自治区巴州二中2021届高三第六次月考化学试题湖南省衡阳市2020届高三下学期第二次联考(二模)理综化学试题(已下线)第六单元 化学反应速率和化学平衡测试题-2021年高考化学一轮复习名师精讲练【学科网名师堂】
名校
9 . 在“宏观——微观——符号”之间建立联系是化学学科特有的思维方式。如图是科研人员提出的HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程示意图(图中只画出了HAP的部分结构)。下列说法不正确的是
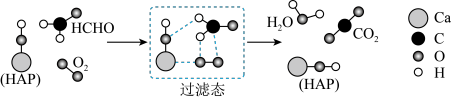

| A.HAP能降低HCHO与O2反应的活化能 |
B.该反应的化学方程式为HCHO+O2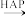 CO2+H2O CO2+H2O |
| C.反应过程中断裂或生成的的化学键类型均为极性共价键 |
| D.产物CO2分子中的氧原子不仅仅来源于O2 |
您最近一年使用:0次
2020-04-09更新
|
217次组卷
|
2卷引用:新疆乌鲁木齐市第八中学2020-2021学年高二上学期期末考试化学试题
名校
10 . 在合成氨工业中,能用勒夏特列原理解释的事实是
| A.催化剂使反应迅速达到平衡状态 | B.反应温度控制在500℃左右 |
| C.反应宜在高压下进行 | D.原料气需经过净化才能进入合成塔 |
您最近一年使用:0次
2019-10-24更新
|
326次组卷
|
4卷引用:新疆昌吉州教育共同体2020-2021学年高二上学期期末质量检测化学试题
新疆昌吉州教育共同体2020-2021学年高二上学期期末质量检测化学试题上海市金山中学2017-2018学年高二下学期期中考试(合格)化学试题上海市静安区2020届高三模拟化学试题(已下线)2.3.3 温度对化学平衡的影响(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)



