名校
1 . 下列说法正确的是
A. , , 的反应在温度低时不能自发进行 的反应在温度低时不能自发进行 |
| B.室温下冰自动融化成水,这是熵增的过程 |
| C.海水提溴:一般需要经过浓缩、氧化、用热空气吹出及冷凝、精制等步骤 |
D.硫酸工业:采用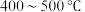 的高温,有利于增大反应正向进行的程度 的高温,有利于增大反应正向进行的程度 |
您最近一年使用:0次
名校
解题方法
2 . 湿法炼锌是当今世界最主要的炼锌方法,其产量占世界总锌产量的85%以上。一种利用ZnS精矿(含有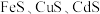 等杂质)提取锌的工艺流程如下:
等杂质)提取锌的工艺流程如下:
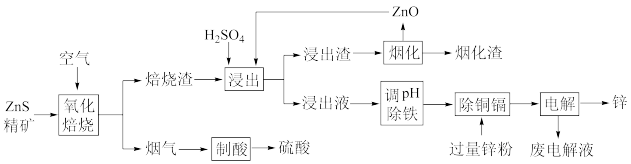
回答下列问题:
(1)工业上,“氧化焙烧”中常采用从底部通入高压空气使ZnS精矿处于“沸腾”状态,其目的是_______ 。
(2)烟气的主要成分是_______ 。
(3)焙烧渣中,铁元素以铁酸锌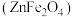 形式存在,铁酸锌在“浸出”步骤中反应的离子方程式为
形式存在,铁酸锌在“浸出”步骤中反应的离子方程式为_______ 。
(4)浸出渣可采用旋涡炉熔炼新工艺处理,在筒形炉体的上部切向送入高速热空气,使炉内形成高速旋转的旋涡,涡流在靠近炉壁侧为正压向下旋转,靠近中心部位为负压而且向上抽吸,这种新工艺的优点是_______ 。
(5)“调pH除铁”中,若将 沉淀完全,应调节至
沉淀完全,应调节至
_______ 。(已知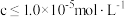 时认为沉淀完全,
时认为沉淀完全,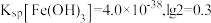 )
)
(6)“电解”时,锌在_______ (填“阳”或“阴”)极析出,废电解液酸性较大,应返回“_______ ”步骤使用,减少Zn的损失。
 等杂质)提取锌的工艺流程如下:
等杂质)提取锌的工艺流程如下:
回答下列问题:
(1)工业上,“氧化焙烧”中常采用从底部通入高压空气使ZnS精矿处于“沸腾”状态,其目的是
(2)烟气的主要成分是
(3)焙烧渣中,铁元素以铁酸锌
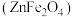 形式存在,铁酸锌在“浸出”步骤中反应的离子方程式为
形式存在,铁酸锌在“浸出”步骤中反应的离子方程式为(4)浸出渣可采用旋涡炉熔炼新工艺处理,在筒形炉体的上部切向送入高速热空气,使炉内形成高速旋转的旋涡,涡流在靠近炉壁侧为正压向下旋转,靠近中心部位为负压而且向上抽吸,这种新工艺的优点是
(5)“调pH除铁”中,若将
 沉淀完全,应调节至
沉淀完全,应调节至
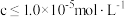 时认为沉淀完全,
时认为沉淀完全,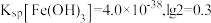 )
)(6)“电解”时,锌在
您最近一年使用:0次
名校
3 . 二氧化氯(ClO2)是一种重要的氧化剂,可用于某些污染物的处理。
(1)ClO2可由图1所示装置制备(电极不反应)。

①电解时阳极附近溶液的pH___ (填“减小”“增大”或“不变”)。
②阴极上产生ClO2的机理如图2所示(A、B均为含氯微粒,其他微粒未标出)。该机理可描述为___ 。
(2)ClO2可用于水体中Mn2+的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得Mn2+浓度随反应时间的变化如图3所示。

①pH=8.3时水体中Mn2+转化为MnO2,ClO2转化为ClO ,该反应的离子方程式为
,该反应的离子方程式为__ 。
②反应相同时间,水体中Mn2+浓度随pH增大而降低的原因是___ 。
(3)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=__ kcal·mol-1。

②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是____ ;添加NO时,SO2氧化率比不添加NO时高,其原因可能是___ 。
(1)ClO2可由图1所示装置制备(电极不反应)。

①电解时阳极附近溶液的pH
②阴极上产生ClO2的机理如图2所示(A、B均为含氯微粒,其他微粒未标出)。该机理可描述为
(2)ClO2可用于水体中Mn2+的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得Mn2+浓度随反应时间的变化如图3所示。

①pH=8.3时水体中Mn2+转化为MnO2,ClO2转化为ClO
 ,该反应的离子方程式为
,该反应的离子方程式为②反应相同时间,水体中Mn2+浓度随pH增大而降低的原因是
(3)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=

②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中
 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
您最近一年使用:0次
2021-09-22更新
|
645次组卷
|
6卷引用:安徽省安庆市第一中学2021-2022学年高三上学期10月月考化学试题
安徽省安庆市第一中学2021-2022学年高三上学期10月月考化学试题江苏省南京市2022届高三上学期9月学情调研化学试题江苏省扬州市扬州中学2022届高三开学考试化学试题2021年辽宁高考化学试题变式题11-19(已下线)黄金卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)押江苏卷第18题 化学反应原理综合题 -备战2022年高考化学临考题号押题(江苏卷)
名校
4 . 从砷盐净化渣(成分为Cu、As、Zn、ZnO、Co和SiO2)中回收有利用价值的金属,解决了长期以来影响砷盐净化工艺推广的技术难题,具有较强的实践指导意义。其工艺流程如图,请回答下列问题∶
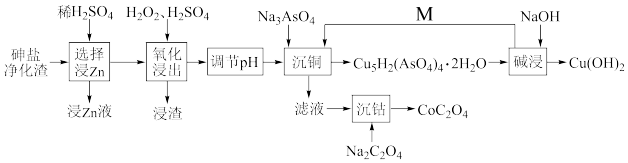
(1)在“选择浸Zn”之前,将砷盐净化渣进行球磨的目的是___ 。其他条件不变时,Zn和Co的浸出率随pH变化如图所示,则“选择浸Zn”过程中,最好控制溶液的pH=___ 。
(2)“氧化浸出”时,As被氧化为H3AsO4的化学方程式为___ 。
(3)用NaOH溶液调节氧化浸出液至弱酸性,再加入Na3AsO4进行“沉铜”,得到难溶性的Cu5H2(AsO4)4·2H2O,则“沉铜”的离子方程式为___ 。
(4)“碱浸”时,除回收得到Cu(OH)2外,还得到物质M,且M在该工艺流程中可循环利用,M的化学式为___ 。
(5)为测定草酸钴产品的纯度,现称取mg样品,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用cmol·L-1高锰酸钾标准液滴定,达到滴定终点时的现象为___ 。共用去VmL高锰酸钾标准液,则该草酸钴产品的纯度为___ 。

(1)在“选择浸Zn”之前,将砷盐净化渣进行球磨的目的是

(2)“氧化浸出”时,As被氧化为H3AsO4的化学方程式为
(3)用NaOH溶液调节氧化浸出液至弱酸性,再加入Na3AsO4进行“沉铜”,得到难溶性的Cu5H2(AsO4)4·2H2O,则“沉铜”的离子方程式为
(4)“碱浸”时,除回收得到Cu(OH)2外,还得到物质M,且M在该工艺流程中可循环利用,M的化学式为
(5)为测定草酸钴产品的纯度,现称取mg样品,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用cmol·L-1高锰酸钾标准液滴定,达到滴定终点时的现象为
您最近一年使用:0次
2021-09-15更新
|
147次组卷
|
2卷引用:安徽省宿松中学2021-2022学年高三上学期第一次联考化学试题
名校
5 . 甲醇是一种可再生能源,CO和CO2催化加氢制甲醇,是极具前景的温室气体资源化研究领域。
(1)已知在25℃,101kPa下:甲醇(l)的燃烧热为akJ·mol-1,CO(g)的燃烧热为bkJ·mol-1,H2O(g)=H2O(l) ΔH=+ckJ·mol-1。则甲醇(l)不完全燃烧生成一氧化碳和水蒸气的热化学方程式为___________ 。
(2)恒温恒压下,在容积可变的密闭容器中加入一定量的CO和H2发生反应
i.CO(g)+2H2(g) CH3OH(g) ΔH=-90.2 kJ·mol-1制备甲醇,测得平衡时CO的转化率(α)随温度、压强的变化如图所示:
CH3OH(g) ΔH=-90.2 kJ·mol-1制备甲醇,测得平衡时CO的转化率(α)随温度、压强的变化如图所示:
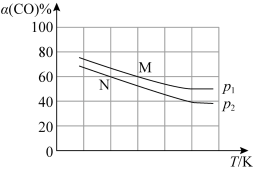
则P1___________ P2,M点的正反应速率___________ N点的逆反应速率。(填“>”、“<”或“=”)
(3)在某催化剂作用下,CO2和H2发生反应
ii: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1
iii:CO2(g)+H2(g) CO(g)+H2O(g) △H3=41.2 kJ·mol-1
CO(g)+H2O(g) △H3=41.2 kJ·mol-1
①维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
注:甲醇的选择性是指发生反应的CO2中转化为甲醇的百分比。
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是:___________ 。为减少副反应的发生,同时不降低CO2生成CH3OH的反应速率和平衡转化率,可采取的措施是___________ 。
(4)恒温恒压密闭容器中,加入2molCO2和4molH2,只发生反应ⅱ和反应ⅲ,初始压强为P0,在300℃发生反应,反应达平衡时,CO2的转化率为50%,容器体积减小25%,反应ⅱ的平衡常数Kp=___________ (kPa)-2(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
(5)以甲醇为原料,通过电化学法可以合成碳酸二甲酯[(CH3O)2CO],工作原理如图所示。

①阳极的电极反应式为___________ 。
②若以铅蓄电池为电源,B应与铅蓄电池的___________ (填“Pb”或“PbO2” )相连。
(1)已知在25℃,101kPa下:甲醇(l)的燃烧热为akJ·mol-1,CO(g)的燃烧热为bkJ·mol-1,H2O(g)=H2O(l) ΔH=+ckJ·mol-1。则甲醇(l)不完全燃烧生成一氧化碳和水蒸气的热化学方程式为
(2)恒温恒压下,在容积可变的密闭容器中加入一定量的CO和H2发生反应
i.CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.2 kJ·mol-1制备甲醇,测得平衡时CO的转化率(α)随温度、压强的变化如图所示:
CH3OH(g) ΔH=-90.2 kJ·mol-1制备甲醇,测得平衡时CO的转化率(α)随温度、压强的变化如图所示:
则P1
(3)在某催化剂作用下,CO2和H2发生反应
ii: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1iii:CO2(g)+H2(g)
 CO(g)+H2O(g) △H3=41.2 kJ·mol-1
CO(g)+H2O(g) △H3=41.2 kJ·mol-1①维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
| T(℃) | CO2实际转化率(%) | 甲醇选择性(%) |
| 243 | 12.3 | 42.3 |
| 253 | 15.3 | 39.1 |
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是:
(4)恒温恒压密闭容器中,加入2molCO2和4molH2,只发生反应ⅱ和反应ⅲ,初始压强为P0,在300℃发生反应,反应达平衡时,CO2的转化率为50%,容器体积减小25%,反应ⅱ的平衡常数Kp=
(5)以甲醇为原料,通过电化学法可以合成碳酸二甲酯[(CH3O)2CO],工作原理如图所示。

①阳极的电极反应式为
②若以铅蓄电池为电源,B应与铅蓄电池的
您最近一年使用:0次
2021-06-04更新
|
1188次组卷
|
8卷引用:安徽省安庆市第一中学2021届高三第三次模拟考试理综化学试题
安徽省安庆市第一中学2021届高三第三次模拟考试理综化学试题(已下线)2021年秋季高三化学开学摸底考试卷03(广东专用)河北省实验中学2022届高三年级上学期开学考试化学试题河北省石家庄市第二中学2022届高三补偿诊断性考试新疆克拉玛依克拉玛依市独山子第二中学2021-2022学年高三上学期12月月考化学试题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-讲义陕西省西安工业大学附属中学2021-2022学年高三下学期第七次适应性训练理综化学试题新疆维吾尔自治区阿克苏地区第二中学2022-2023学年高三上学期第一次月考化学试题
解题方法
6 . 固体界面上的吸附和离解是多相化学在环境、催化等科学领域研究的重要课题如图为气流中的CO2被捕获到固体界面催化加氢合成重要的化工原料甲酸的程示意图。下列叙述错误的是


| A.在捕获过程中,N(C2H5)3能够协助二氧化碳到达催化剂表面 |
| B.在固体界面因反应活化能降低使H2迅速参与反应 |
| C.CO2催化加氢合成甲酸是原子利用率几乎达100%的反应 |
| D.标准状况下,22.4L甲酸(HCOOH)中所含的共价键数目为5NA |
您最近一年使用:0次
7 . 关于水煤气变换反应CO(g)+H2O(g)⇌CO2(g)+H2(g)ΔH(简称WGS反应),目前普遍接受的表面氧化还原机理的可能基元反应(一步完成的反应)步骤如下:
①H2O+*⇌H2O*②H2O*+*⇌OH*+H*③OH*+*⇌O*+H*④2H*+*⇌H2+2*⑤CO+*⇌CO*⑥CO*+O*⇌CO2*+*⑦CO2*⇌CO2+*
其中*表示催化剂表面活性位,X*表示金属表面吸附物种。
WGS反应中可能基元反应步骤的活化能数值(单位:kJ·mol−1)如下表:
注:表中X(111)表示不同金属的同一晶面,110与111表示不同晶面。
下列说法正确的是
①H2O+*⇌H2O*②H2O*+*⇌OH*+H*③OH*+*⇌O*+H*④2H*+*⇌H2+2*⑤CO+*⇌CO*⑥CO*+O*⇌CO2*+*⑦CO2*⇌CO2+*
其中*表示催化剂表面活性位,X*表示金属表面吸附物种。
WGS反应中可能基元反应步骤的活化能数值(单位:kJ·mol−1)如下表:
| 基元反应 | 正反应(Ef) | 逆反应(Et) | ||||
| Cu(110) | Cu(111) | Pd(111) | Cu(110) | Cu(111) | Pd(111) | |
| ① | 0 | 0 | 0 | 58 | 58 | 42 |
| ② | 96 | 109 | 108 | 24 | 8 | 0 |
| ③ | 58 | 67 | 63 | 96 | 88 | 92 |
| ④ | 80 | 63 | 92 | 21 | 29 | 8 |
| ⑤ | 0 | 0 | 0 | 50 | 50 | 142 |
| ⑥ | 45 | 46 | 100 | 95 | 117 | 140 |
| ⑦ | 21 | 21 | 17 | 0 | 0 | 0 |
下列说法正确的是
| A.由表中数据可以得出催化剂通过改变反应的焓变影响反应速率 |
| B.由表中数据可计算Cu(111)催化WGS反应的焓变ΔH=+44kJ·mol−1 |
| C.由表格数据可以看出Cu(111)的催化效果优于Cu(110) |
| D.该机理中WGS反应的速率控制步骤是② |
您最近一年使用:0次
名校
8 . 高炉炼铁过程中发生的主要反应为Fe2O3(s)+CO(g) Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表所示:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表所示:
请回答下列问题:
(1)该反应的平衡常数表达式K=___________ ,ΔH___________ (填“>”“<”或“=”)0。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3各5.0mol;CO、CO2各1.0mol,反应经过10min后达到平衡则CO的平衡转化率=___________ 。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是___________ 。
A.减少Fe的量 B.移出部分CO2 C.增加Fe2O3的量 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
(4)1000℃时平衡时再向容器中充入2molCO2,则达到新平衡时CO2的浓度___________ 。
(5)对于反应2SO2(g)+O2(g) 2SO3(g)ΔH<0,则该反应在
2SO3(g)ΔH<0,则该反应在___________ 自发反应;对于反应SiO2(s)+Na2CO3(s) Na2SiO3(s)+CO2(g)ΔH>0,则该反应在
Na2SiO3(s)+CO2(g)ΔH>0,则该反应在___________ 自发反应。
 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表所示:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表所示:| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3各5.0mol;CO、CO2各1.0mol,反应经过10min后达到平衡则CO的平衡转化率=
(3)欲提高(2)中CO的平衡转化率,可采取的措施是
A.减少Fe的量 B.移出部分CO2 C.增加Fe2O3的量 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
(4)1000℃时平衡时再向容器中充入2molCO2,则达到新平衡时CO2的浓度
(5)对于反应2SO2(g)+O2(g)
 2SO3(g)ΔH<0,则该反应在
2SO3(g)ΔH<0,则该反应在 Na2SiO3(s)+CO2(g)ΔH>0,则该反应在
Na2SiO3(s)+CO2(g)ΔH>0,则该反应在
您最近一年使用:0次
名校
9 . 工业合成氨缓解了有限耕地与不断增长的人口对粮食大量需求之间的矛盾。
(1)N2分子通常条件下非常稳定,其本质原因是_____ ,工业上选择500℃主要出于两方面考虑,一是反应速率快;二是_____ 。
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
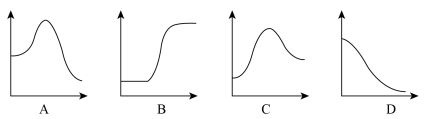
结合表中所给信息,下图中能正确表示合成氨反应过程中能量变化关系的是_____ 。
(3)一定条件下,氨与水的反应存在限度,氨水成弱碱性,用一个化学用语,表示氨与水反应及溶液显碱性的原因_____ 。
(4)硫酸铵是一种固态氮肥,俗称“肥田粉”。硫酸铵可由氨与硫酸反应生成,硫酸铵中含有的化学键类型有_____ 。
(5)氨氧化法可以用来生产硝酸,写出第一步和第三步的化学反应方程式_________________ 、_________________ 。
(1)N2分子通常条件下非常稳定,其本质原因是
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
| 共价键 | H-H | N≡N | N-H |
| 键能(kJ/mol) | 436 | 946 | 391 |
结合表中所给信息,下图中能正确表示合成氨反应过程中能量变化关系的是

(3)一定条件下,氨与水的反应存在限度,氨水成弱碱性,用一个化学用语,表示氨与水反应及溶液显碱性的原因
(4)硫酸铵是一种固态氮肥,俗称“肥田粉”。硫酸铵可由氨与硫酸反应生成,硫酸铵中含有的化学键类型有
(5)氨氧化法可以用来生产硝酸,写出第一步和第三步的化学反应方程式
您最近一年使用:0次
10 . 第19届亚洲运动会将于2022年在杭州举行,杭州的空气与水质量的提高越来越成为人们关注的问题。其中,烟气中的NOx与水中总氮含量(包括有机氮及NO3-、NO2-、NH4+等无机氮)都必须脱除(即脱硝)后才能排放。请回答下列问题:
已知空气的脱硝处理:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH 1= -890.3.kJ· mol-1;N2(g)+O2(g)=2NO(g) ΔH 2=+180.kJ· mol-1
⑴CH4可用于脱硝,其化学方程式为CH4(g)+4NO(g)⇌CO2(g)+2N2(g)+2H2O(l),ΔH=____ kJ· mol-1。在恒温,恒容的密闭容器中通入2mol CH4和4mol NO,下列说法正确的是____ 。
A.甲烷过量,可将NO完全转化为N2 B.从反应开始到平衡的过程中,NO的转化率一直增大
C.反应过程中,容器中的压强保持不变 D.平衡后,再通入一定量的甲烷,正反应速率增大
⑵C2H4也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对其NO去除率的影响,控制其他条件一定,实验结果如图1所示。为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是___ 、___ 。

已知空气的脱硝处理:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH 1= -890.3.kJ· mol-1;N2(g)+O2(g)=2NO(g) ΔH 2=+180.kJ· mol-1
⑴CH4可用于脱硝,其化学方程式为CH4(g)+4NO(g)⇌CO2(g)+2N2(g)+2H2O(l),ΔH=
A.甲烷过量,可将NO完全转化为N2 B.从反应开始到平衡的过程中,NO的转化率一直增大
C.反应过程中,容器中的压强保持不变 D.平衡后,再通入一定量的甲烷,正反应速率增大
⑵C2H4也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对其NO去除率的影响,控制其他条件一定,实验结果如图1所示。为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是

您最近一年使用:0次



