安徽省安庆市第十中学2020-2021学年高二下学期第一次月考化学试题
安徽
高二
阶段练习
2021-04-07
228次
整体难度:
容易
考查范围:
化学反应原理、化学与STSE、认识化学科学、化学实验基础
一、单选题 添加题型下试题
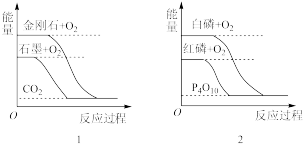
| A.石墨转变为金刚石是放热反应 |
| B.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH>0 |
| C.S(g)+O2(g)=SO2(g)ΔH1,S(s)+O2(g)=SO2(g)ΔH2则ΔH1>ΔH2 |
| D.红磷比白磷稳定 |
【知识点】 焓变 化学能与物质稳定性之间的关系解读 反应热大小比较解读
| A.-76.7kJ·mol-1 | B.-44.5kJ·mol-1 |
| C.+76.7kJ·mol-1 | D.+34.5kJ·mol-1 |
【知识点】 焓变 盖斯定律及其有关计算
A.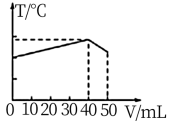 | B. |
C.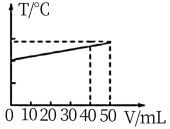 | D.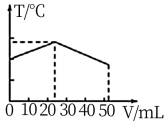 |
【知识点】 酸碱混合时的定性判断及计算解读
| A.久制的氯水溶液的酸性增强 |
| B.合成氨工业通常采用催化剂以提高经济效率 |
| C.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| D.氯气在饱和食盐水中的溶解度比在水中的小 |
| A.一定条件下,增大反应物的量会加快化学反应速率 |
| B.增大压强,一定会加快化学反应速率 |
| C.催化剂参与了化学反应降低了活化能,从而加快化学反应速率 |
| D.活化分子间的碰撞叫做有效碰撞 |
 C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④加入催化剂,B的转化率提高
⑤增大B的浓度,平衡向正反应方向移动,v(正)、v(逆)都增大
| A.③⑤ | B.①② | C.⑤ | D.④⑤ |
 bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积扩大到原来容积的两倍,当达到新平衡时,物质Y和Z的浓度均是原来的0.6倍。则下列叙述正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积扩大到原来容积的两倍,当达到新平衡时,物质Y和Z的浓度均是原来的0.6倍。则下列叙述正确的是| A.可逆反应的化学方程式的化学计量数:a<b+c |
| B.扩大容器的容积时,v正增大,v逆减小 |
| C.达到新平衡时,物质X的转化率减小 |
| D.达到新平衡时,混合物中Z的质量分数减小 |
【知识点】 压强对化学平衡移动的影响解读
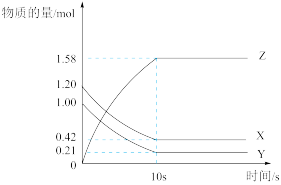
| A.反应开始到10s,用X表示的反应速率为0.158mol/(Ls) |
| B.反应开始到10s,X的物质的量浓度减少了0.395mol/L |
C.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
| D.反应开始到10s时,Y的转化率为79.0% |
 4C(g)+D(g),反应10min后达平衡,此时C的浓度为2mol/L。下列说法正确的是
4C(g)+D(g),反应10min后达平衡,此时C的浓度为2mol/L。下列说法正确的是| A.前10min反应的平均速率v(C)=0.10mol/L·min |
| B.10min后向容器中加入A,重新平衡时A的转化率一定大于50% |
| C.恒温下将反应容器体积缩小一半,则D的平衡浓度小于1.0mol/L |
| D.反应达平衡时B的平衡浓度是1.5mol/L |
【知识点】 化学反应的速率 化学平衡的移动及其影响因素 化学平衡的有关计算
 bG(g)温度和压强对该反应的影响如图所示,其中压强P1<P2,由此可判断
bG(g)温度和压强对该反应的影响如图所示,其中压强P1<P2,由此可判断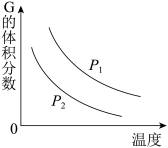
| A.正反应为放热反应 |
| B.增大压强,容器内气体质量不变 |
| C.R的转化率随温度升高而增大 |
| D.化学方程式中的计量数a>b |
 bB(s)+dD(g)ΔH,其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中不正确的是
bB(s)+dD(g)ΔH,其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中不正确的是 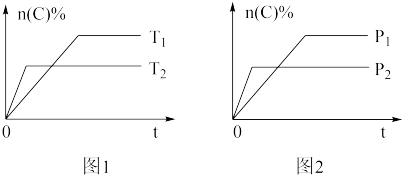
| A.升高温度、增大压强,平衡都向正反应方向移动 |
| B.使用催化剂,C的物质的量分数不变 |
| C.化学方程式系数a+c>b+d |
| D.ΔH>0,升高温度平衡常数K值增大 |
 FeO(s)+CO(g)ΔH=akJ/mol,反应②Fe(s)+H2O(g)
FeO(s)+CO(g)ΔH=akJ/mol,反应②Fe(s)+H2O(g) FeO(s)+H2(g)ΔH=bkJ/mol,以上两反应的平衡常数分别为K1和K2.在不同温度下,K1、K2的值如下,下列有关叙述正确的是
FeO(s)+H2(g)ΔH=bkJ/mol,以上两反应的平衡常数分别为K1和K2.在不同温度下,K1、K2的值如下,下列有关叙述正确的是| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| A.b>0 |
| B.在973K下增大压强,K2增大 |
| C.在1173K下反应①平衡后再充入CO2平衡正向移动,K1增大 |
| D.a>b |
【知识点】 化学平衡常数的影响因素及应用解读
 CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见表| 物质的量 | CO2 | H2 | CO | H2O |
| 甲 | amol | amol | 0mol | 0mol |
| 乙 | 2amol | amol | 0mol | 0mol |
| 丙 | 0mol | 0mol | 2amol | 2amol |
| 丁 | 0mol | 0mol | amol | amol |
| A.乙=丁>丙=甲 | B.乙>丁>甲>丙 | C.丁>乙>丙=甲 | D.丙>乙>丁=甲 |
【知识点】 等效平衡理论的综合应用解读
 PCl3g+Cl2g,此时平衡混合气体的压强为P1,再向容器中通入amolPCl5,恒温下再度达到平衡后压强变为P2,则P1与P2的关系是
PCl3g+Cl2g,此时平衡混合气体的压强为P1,再向容器中通入amolPCl5,恒温下再度达到平衡后压强变为P2,则P1与P2的关系是| A.2P1=P2 | B.2P1>P2 | C.2P1<P2 | D.P1=2P2 |
【知识点】 等效平衡 压强对化学平衡移动的影响解读
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
A.2HCOOH+ →2HCOO-+H2O+CO2↑ →2HCOO-+H2O+CO2↑ |
B.2CN-+H2O+CO2→2HCN+ |
| C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 |
| D.溶液浓度均0.1mol/L的HCOOH、HCN和H2CO3,HCOOH酸性最强 |
| A.c(CH3COOH)变为原来的1/10 |
B.c(H+)变为原来的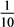 |
| C.c(CH3COO-)/c(CH3COOH)的比值增大 |
| D.溶液的导电性增强 |
【知识点】 浓度对电离平衡的影响解读
| 选项 | A | B | C | D |
| 强电解质 | NaHCO3 | 盐酸 | CaCO3 | HNO3 |
| 弱电解质 | 氨水 | CH3COOH | H3PO4 | Fe(OH)3 |
| 非电解质 | SO2 | BaSO4 | CH3CH2OH | 石墨 |
| A.A | B.B | C.C | D.D |
二、解答题 添加题型下试题
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
| 0.6mol·L-1H2C2O4溶液 | H2O | 3mol·L-1H2SO4溶液 | 0.05mol·L-1KMnO4溶液 | ||
| 1 | 6.0 | 7.0 | 4.0 | 3.0 | 1.5 |
| 2 | 4.0 | 9.0 | 4.0 | 3.0 | 2.7 |
| 3 | 6.0 | 3.0 | 8.0 | 3.0 | 1.0 |
(1)根据上表中的实验数据,可以得到的结论是
(2)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图甲所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。

①该小组同学提出的假设是
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 所加试剂 | 溶液褪至无色所需时间/min | |||
| 0.6mol·L-1H2C2O4溶液 | H2O | 3mol·L-1H2SO4溶液 | 0.05mol·L-1KMnO4溶液 | |||
| 4 | 7.0 | 4.0 | 3.0 | MnSO4 | t | |
三、填空题 添加题型下试题
 CH3COO-+H+
CH3COO-+H+(1)加入少量冰醋酸,醋酸电离程度
(2)加入少量0.5mol/L盐酸,上述平衡向
(3)加入一定量蒸馏水,上述平衡向
(4)加入少量的Na2CO3固体,醋酸电离程度
四、计算题 添加题型下试题
 SO3(g)+NO(g)。5分钟时达到平衡状态,测得容器中SO2(g)的转化率为50%。
SO3(g)+NO(g)。5分钟时达到平衡状态,测得容器中SO2(g)的转化率为50%。(1)化学平衡时化学平衡常数
(2)当达到的平衡状态时,继续向容器中充入2mol的SO2(g)、1mol的NO2(g)、2molSO3(g)和2molNO(g),则v正
(3)该温度下、该容器中,再继续加入2mol的SO2(g),则整个过程中,SO2的转化率由50%变为
【知识点】 化学平衡的移动及其影响因素 化学平衡的有关计算
五、解答题 添加题型下试题
 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表所示:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表所示:| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3各5.0mol;CO、CO2各1.0mol,反应经过10min后达到平衡则CO的平衡转化率=
(3)欲提高(2)中CO的平衡转化率,可采取的措施是
A.减少Fe的量 B.移出部分CO2 C.增加Fe2O3的量 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
(4)1000℃时平衡时再向容器中充入2molCO2,则达到新平衡时CO2的浓度
(5)对于反应2SO2(g)+O2(g)
 2SO3(g)ΔH<0,则该反应在
2SO3(g)ΔH<0,则该反应在 Na2SiO3(s)+CO2(g)ΔH>0,则该反应在
Na2SiO3(s)+CO2(g)ΔH>0,则该反应在试卷分析
试卷题型(共 22题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 吸热反应和放热反应 | |
| 2 | 0.85 | 焓变 化学能与物质稳定性之间的关系 反应热大小比较 | |
| 3 | 0.85 | 焓变 盖斯定律及其有关计算 | |
| 4 | 0.85 | 酸碱混合时的定性判断及计算 | |
| 5 | 0.85 | 勒夏特列原理的应用 氨的合成 氯碱工艺 | |
| 6 | 0.65 | 影响化学反应速率的外因 碰撞理论及活化能 活化能及其对反应速率的影响 | |
| 7 | 0.65 | 化学平衡的移动及其影响因素 温度对化学平衡移动的影响 压强对化学平衡移动的影响 | |
| 8 | 0.65 | 压强对化学平衡移动的影响 | |
| 9 | 0.65 | 化学反应速率计算 化学平衡图像分析 化学平衡题中基于图表数据的相关计算 | |
| 10 | 0.65 | 化学反应的速率 化学平衡的移动及其影响因素 化学平衡的有关计算 | |
| 11 | 0.65 | 化学平衡的移动及其影响因素 与物质百分含量变化有关图像的分析 | |
| 12 | 0.65 | 温度对化学平衡移动的影响 压强对化学平衡移动的影响 与物质百分含量变化有关图像的分析 产物的物质的量与温度、压强的图像关系分析 | |
| 13 | 0.65 | 化学平衡常数的影响因素及应用 | |
| 14 | 0.65 | 等效平衡理论的综合应用 | |
| 15 | 0.85 | 等效平衡 压强对化学平衡移动的影响 | |
| 16 | 0.65 | 弱电解质的电离平衡 电离平衡常数及影响因素 盐溶液中离子浓度大小的比较 | |
| 17 | 0.4 | 浓度对电离平衡的影响 | |
| 18 | 0.94 | 电解质与非电解质 非电解质、电解质物质类别判断 强电解质和弱电解质的判断 | |
| 二、解答题 | |||
| 19 | 0.65 | 浓度对化学反应速率的影响 催化剂对化学反应速率的影响 化学实验探究 | 实验探究题 |
| 22 | 0.65 | 化学平衡常数的影响因素及应用 化学平衡常数的有关计算 化学反应条件的控制及其应用 反应进行方向判据的应用 | 原理综合题 |
| 三、填空题 | |||
| 20 | 0.85 | 浓度对电离平衡的影响 同离子效应对电离的影响 加入酸或碱对电离平衡的影响 | |
| 四、计算题 | |||
| 21 | 0.65 | 化学平衡的移动及其影响因素 化学平衡的有关计算 | |



