名校
解题方法
1 . 过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面,如图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2) 的流程。
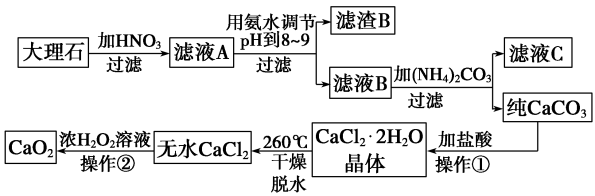
请回答下列问题:
(1)写出加硝酸后反应的离子方程式___________ 。
(2)操作①应包括的步骤是___________ 。
(3)用氨水调节pH至8~9的目的是___________ 。
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中 c( )
)___________ c( )(填“≥”、“≤”、“<”、“>”或“=”)。
)(填“≥”、“≤”、“<”、“>”或“=”)。
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出加氢氧化钠前该反应的化学方程式__________ ;用简要的文字解释用氢氧化钠调节pH至9~11的原因__________ 。
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率________ 。

请回答下列问题:
(1)写出加硝酸后反应的离子方程式
(2)操作①应包括的步骤是
(3)用氨水调节pH至8~9的目的是
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中 c(
 )
) )(填“≥”、“≤”、“<”、“>”或“=”)。
)(填“≥”、“≤”、“<”、“>”或“=”)。(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出加氢氧化钠前该反应的化学方程式
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率
您最近一年使用:0次
2020-09-09更新
|
172次组卷
|
2卷引用:安徽省滁州市定远县民族中学2021-2022学年高三上学期10月教学质量检测化学试题
名校
2 . 用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO 和 NO2不同配比混合气通入尿素溶液中,总氮还原率与配比关系如下图。

(1)用尿素[(NH2)2CO]水溶液吸收体积比为 1∶1 的 NO 和 NO2混合气,可将 N 元素转变为对环境无害的气体。写出该反应的化学方程式___________________ 。
(2)随着 NO 和 NO2配比的提高,总氮还原率降低的主要原因是__________________ 。

(1)用尿素[(NH2)2CO]水溶液吸收体积比为 1∶1 的 NO 和 NO2混合气,可将 N 元素转变为对环境无害的气体。写出该反应的化学方程式
(2)随着 NO 和 NO2配比的提高,总氮还原率降低的主要原因是
您最近一年使用:0次
名校
解题方法
3 . 2019年9月,我国科研人员研制出Ti-H-Fe双温区催化剂,其中Ti-H区域和Fe区域的温度差可超过100℃。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法错误的是( )
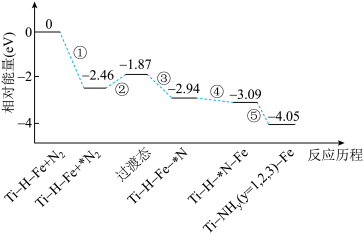

| A.①②③在高温区发生,④⑤在低温区发生 |
| B.该历程中能量变化最大的是2.46eV,是氮分子中氮氮三键的断裂过程 |
| C.在高温区加快了反应速率,低温区提高了氨的产率 |
| D.使用Ti-H-Fe双温区催化合成氨,不会改变合成氨反应的反应热 |
您最近一年使用:0次
2020-07-07更新
|
867次组卷
|
15卷引用:安徽省六安市舒城中学2019-2020学年高二下学期第三次月考化学试题
安徽省六安市舒城中学2019-2020学年高二下学期第三次月考化学试题(已下线)化学(九省联考考后提升卷,安徽卷)-2024年1月“九省联考”真题完全解读与考后提升河南省郑州市2020届高三第二次质检理综试卷湖南省长沙市雅礼中学2020届高考6月模拟卷(一)理综化学试题(已下线)第六单元 化学反应速率和化学平衡测试题-2021年高考化学一轮复习名师精讲练【学科网名师堂】重庆市2021届高三上学期第一次预测性考试化学试题黑龙江省大庆实验中学2020-2021学年高二10月月考化学试题江西省南昌市第二中学2020-2021学年高二上学期期中考试化学试题江苏省南通市新高考2021届高三上学期期中考试化学(ⅱ卷)试题(已下线)【南昌新东方】3. 2020 高二上 南昌二中 期中考试 吴丹江西省南昌市南昌县莲塘第三中学2020-2021学年高二上学期第二次月考化学试题河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题湖南省常德市第二中学2020届高三临考冲刺理科综合化学试题河南省重点高中2021-2022学年高二上学期阶段性调研联考二化学试题江西省景德镇市乐平中学20222-2023学年高二上学期第一次月考化学试题
名校
4 . 工业合成氨缓解了有限耕地与不断增长的人口对粮食大量需求之间的矛盾。
(1)N2分子通常条件下非常稳定,其本质原因是_____ ,工业上选择500℃主要出于两方面考虑,一是反应速率快;二是_____ 。
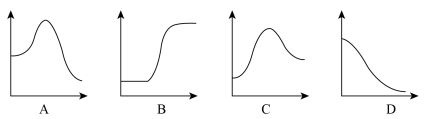
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
结合表中所给信息,下图中能正确表示合成氨反应过程中能量变化关系的是_____ 。
(3)一定条件下,氨与水的反应存在限度,氨水成弱碱性,用一个化学用语,表示氨与水反应及溶液显碱性的原因_____ 。
(4)硫酸铵是一种固态氮肥,俗称“肥田粉”。硫酸铵可由氨与硫酸反应生成,硫酸铵中含有的化学键类型有_____ 。
(5)氨氧化法可以用来生产硝酸,写出第一步和第三步的化学反应方程式_________________ 、_________________ 。
(1)N2分子通常条件下非常稳定,其本质原因是
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
| 共价键 | H-H | N≡N | N-H |
| 键能(kJ/mol) | 436 | 946 | 391 |
结合表中所给信息,下图中能正确表示合成氨反应过程中能量变化关系的是

(3)一定条件下,氨与水的反应存在限度,氨水成弱碱性,用一个化学用语,表示氨与水反应及溶液显碱性的原因
(4)硫酸铵是一种固态氮肥,俗称“肥田粉”。硫酸铵可由氨与硫酸反应生成,硫酸铵中含有的化学键类型有
(5)氨氧化法可以用来生产硝酸,写出第一步和第三步的化学反应方程式
您最近一年使用:0次
名校
5 . 工业上利用氢气与氮气在高温、高压、催化剂作用下制取氨气:N2+3H2 2NH3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )
2NH3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )
 2NH3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )
2NH3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )| A.使用催化剂是为了加快反应速率,提高生产效率 |
| B.在上述条件下,H2不可能100%的转化为NH3 |
| C.为了提高H2的转化率,应适当提高N2的浓度 |
| D.达到平衡时,N2的浓度和H2的浓度之比为1:3 |
您最近一年使用:0次
2020-06-08更新
|
506次组卷
|
4卷引用:安徽省肥东县圣泉中学2020-2021学年高二上学期期中考试化学试题
6 . 一种“氢氧化锶-氯化镁法”制备“牙膏用氯化锶(SrCl2·6H2O)”的工艺流程如图:
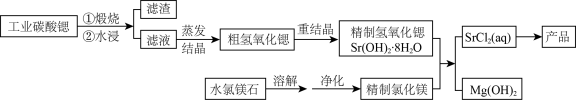
(1)锶与钙同主族。金属锶应保存在__ 中(填“水”、“乙醇”或“煤油”)。
(2)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为___ 。
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是___ 。
(4)“重结晶”时蒸馏水用量[以质量比m(H2O):m(SrO)表示]对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为___ ,当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是___ 。
(5)水氯镁石是盐湖提钾后的副产品,其中SO42-含量约为1%,“净化”过程中常使用SrCl2除杂,写出该过程的离子方程式___ 。
(6)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为___ 。

(1)锶与钙同主族。金属锶应保存在
(2)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是
(4)“重结晶”时蒸馏水用量[以质量比m(H2O):m(SrO)表示]对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为
| 质量mH2O:mSrO | 4:1 | 5:1 | 6:1 | 7:1 | 8:1 | 9:1 | 10:1 |
| Sr(OH)2·8H2O纯度% | 98.64 | 98.68 | 98.65 | 98.64 | 98.63 | 98.63 | 98.65 |
| Sr(OH)2·8H2O产率% | 17.91 | 53.36 | 63.50 | 72.66 | 92.17 | 89.65 | 88.93 |
(5)水氯镁石是盐湖提钾后的副产品,其中SO42-含量约为1%,“净化”过程中常使用SrCl2除杂,写出该过程的离子方程式
(6)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为
您最近一年使用:0次
2020-06-05更新
|
149次组卷
|
2卷引用:安徽省滁州市定远县育才学校2023-2024学年高二上学期期末化学模拟试卷
7 . 第19届亚洲运动会将于2022年在杭州举行,杭州的空气与水质量的提高越来越成为人们关注的问题。其中,烟气中的NOx与水中总氮含量(包括有机氮及NO3-、NO2-、NH4+等无机氮)都必须脱除(即脱硝)后才能排放。请回答下列问题:
已知空气的脱硝处理:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH 1= -890.3.kJ· mol-1;N2(g)+O2(g)=2NO(g) ΔH 2=+180.kJ· mol-1
⑴CH4可用于脱硝,其化学方程式为CH4(g)+4NO(g)⇌CO2(g)+2N2(g)+2H2O(l),ΔH=____ kJ· mol-1。在恒温,恒容的密闭容器中通入2mol CH4和4mol NO,下列说法正确的是____ 。
A.甲烷过量,可将NO完全转化为N2 B.从反应开始到平衡的过程中,NO的转化率一直增大
C.反应过程中,容器中的压强保持不变 D.平衡后,再通入一定量的甲烷,正反应速率增大
⑵C2H4也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对其NO去除率的影响,控制其他条件一定,实验结果如图1所示。为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是___ 、___ 。

已知空气的脱硝处理:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH 1= -890.3.kJ· mol-1;N2(g)+O2(g)=2NO(g) ΔH 2=+180.kJ· mol-1
⑴CH4可用于脱硝,其化学方程式为CH4(g)+4NO(g)⇌CO2(g)+2N2(g)+2H2O(l),ΔH=
A.甲烷过量,可将NO完全转化为N2 B.从反应开始到平衡的过程中,NO的转化率一直增大
C.反应过程中,容器中的压强保持不变 D.平衡后,再通入一定量的甲烷,正反应速率增大
⑵C2H4也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对其NO去除率的影响,控制其他条件一定,实验结果如图1所示。为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是

您最近一年使用:0次
8 . 某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。
(1)查阅资料知,NaHSO3与过量KIO3反应分两步进行,第一步为IO3-+3HSO3-=3SO42-+3H++I-,则第二步反应的离子方程式为_____ ;
(2)通过测定溶液变蓝所用时间探究浓度和温度对该反应的化学反应速率的影响。调节反应物浓度和温度进行对比实验.记录如下表:
实验①②是探究______ 对化学反应速率的影响,表中a=______ mL;实验①③是探究温度对化学反应速率的影响,则表中b=______ mL,c=______ mL;
(3)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段化学反应速率逐渐增大,一段时间后化学反应速率又逐渐减小。课题组对起始阶段化学反应速率逐渐增大的原因提出如下假设,请你完成假设三:
假设一:反应生成的SO42-对反应起催化作用,SO42-浓度越大化学反应速率越快;
假设二:反应生成的H+对反应起催化作用,H+浓度越大化学反应速率越快;
假设三:______ ;
……
(4)请你设计实验验证上述假设一,完成下表中内容(化学反应速率可用测速仪测定)______ 。
(1)查阅资料知,NaHSO3与过量KIO3反应分两步进行,第一步为IO3-+3HSO3-=3SO42-+3H++I-,则第二步反应的离子方程式为
(2)通过测定溶液变蓝所用时间探究浓度和温度对该反应的化学反应速率的影响。调节反应物浓度和温度进行对比实验.记录如下表:
| 实验编号 | 0.02mol/LNaHSO3溶液(mL) | 0.02mol/LKIO3溶液(mL) | H2O(mL) | 反应温度(℃) | 溶液变蓝的时间(s) |
| ① | 15 | 20 | 10 | 15 | t1 |
| ② | a | 30 | 0 | 15 | t2 |
| ③ | 15 | b | c | 30 | t3 |
实验①②是探究
(3)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段化学反应速率逐渐增大,一段时间后化学反应速率又逐渐减小。课题组对起始阶段化学反应速率逐渐增大的原因提出如下假设,请你完成假设三:
假设一:反应生成的SO42-对反应起催化作用,SO42-浓度越大化学反应速率越快;
假设二:反应生成的H+对反应起催化作用,H+浓度越大化学反应速率越快;
假设三:
……
(4)请你设计实验验证上述假设一,完成下表中内容(化学反应速率可用测速仪测定)
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
您最近一年使用:0次
2020-05-21更新
|
242次组卷
|
4卷引用:2015届安徽省安庆五校联盟高三下学期3月联考理综化学试卷
2015届安徽省安庆五校联盟高三下学期3月联考理综化学试卷(已下线)二轮复习 专题14 化学实验综合 押题专练北京市通州区2020届高三第一次模拟考试化学试题(已下线)第七章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测
解题方法
9 . 最近,中国科学院大连化物所“CO2催化转化为CO的研究”获得新进展。如图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化,下列说法不合理的是()


| A.•CO2经还原反应得到•COOH |
| B.该研究成果将有利于缓解温室效应,并解决能源转化问题 |
| C.相同基团的物种分别吸附在NiPc和CoPc表面,其能量可能不同 |
| D.催化剂可以改变CO2转化为CO反应的焓变 |
您最近一年使用:0次
2020-05-11更新
|
472次组卷
|
5卷引用:安徽省芜湖市示范高中2020届高三5月联考理综化学试题
安徽省芜湖市示范高中2020届高三5月联考理综化学试题山东省泰安市肥城市2020届高三适应性训练(三)化学试题(已下线)课时28 焓变与热化学方程式-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第六章 化学反应与能量 第33练 反应热(已下线)题型22 反应历程—活化能—催化剂的定性和定量分析
名校
解题方法
10 . 甲醇是重要的有机化工原料,目前世界甲醇年产量超过2.1×107吨,在能源紧张的今天,甲醇的需求也在增大。甲醇的合成方法是:
(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH=-90.1kJ·mol-1
另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
(ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0kJ·mol-1
回答下列问题:
(1)甲醇的燃烧热为__ kJ·mol-1。
(2)在碱性条件下利用一氯甲烷(CH3Cl)水解也可制备少量的甲醇,该反应的化学方程式为__ 。
(3)若反应在密闭恒容绝热容器中进行,反应(iv)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.1kJ·mol-1对合成甲醇反应中CO的转化率的影响是( )
a.增大 b.减小 c.无影响 d.无法判断
(4)在恒温恒容的密闭容器中发生反应(ⅰ),各物质的浓度如下表:
①x=__ 。
②前2min内H2的平均反应速率为v(H2)=__ 。该温度下,反应(ⅰ)的平衡常数K=__ 。(保留1位小数)
③反应进行到第2min时,改变了反应条件,改变的这个条件可能是( )
a.使用催化剂 b.降低温度 c.增加H2的浓度
(5)如图是温度、压强与反应(ⅰ)中CO转化率的关系:

由图象可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400℃和10MPa的条件,其原因是__ 。
(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH=-90.1kJ·mol-1
另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
(ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0kJ·mol-1
回答下列问题:
(1)甲醇的燃烧热为
(2)在碱性条件下利用一氯甲烷(CH3Cl)水解也可制备少量的甲醇,该反应的化学方程式为
(3)若反应在密闭恒容绝热容器中进行,反应(iv)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.1kJ·mol-1对合成甲醇反应中CO的转化率的影响是
a.增大 b.减小 c.无影响 d.无法判断
(4)在恒温恒容的密闭容器中发生反应(ⅰ),各物质的浓度如下表:
| 浓度/mol·L-1 时间/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | x | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
①x=
②前2min内H2的平均反应速率为v(H2)=
③反应进行到第2min时,改变了反应条件,改变的这个条件可能是
a.使用催化剂 b.降低温度 c.增加H2的浓度
(5)如图是温度、压强与反应(ⅰ)中CO转化率的关系:

由图象可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400℃和10MPa的条件,其原因是
您最近一年使用:0次



