名校
1 . 下列说法正确的是
A. , , 的反应在温度低时不能自发进行 的反应在温度低时不能自发进行 |
| B.室温下冰自动融化成水,这是熵增的过程 |
| C.海水提溴:一般需要经过浓缩、氧化、用热空气吹出及冷凝、精制等步骤 |
D.硫酸工业:采用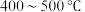 的高温,有利于增大反应正向进行的程度 的高温,有利于增大反应正向进行的程度 |
您最近一年使用:0次
名校
2 . I.在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g)  2SO3(g) ΔH=—196.6kJ•mol-1(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)。表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g) ΔH=—196.6kJ•mol-1(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)。表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是________ 。
(2)在实际生产中,选定的温度为400~500℃,原因是___________ 。
(3)在实际生产中,采用的压强为常压,原因是___________ 。
(4)在实际生产中,通入过量的空气,原因是___________ 。
(5)尾气中SO2必须回收,原因是___________ 。
II.Bodenstein研究了反应:2HI(g) H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:
H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:
(6)根据上述实验结果,该反应的平衡常数K的计算式为___________ 。
(7)上述反应中,正反应速率v正=k正x2(HI),逆反应速率v逆=k逆x(H2)•x(I2),其中k正、k逆为正、逆反应速率常数,则k逆为___________ (用含K和k正的代数式表示)。
III.在刚性容器压强为1.01MPa时,乙酸甲酯与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g) CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3):n(H2)=1:10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3):n(H2)=1:10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
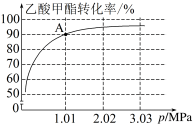
(8)A点时,CH3CH2OH(g)的体积分数为___________ %(保留一位小数)。
(9)此温度下,该反应的化学平衡常数Kp=___________ MPa-1(Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
 2SO3(g) ΔH=—196.6kJ•mol-1(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)。表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g) ΔH=—196.6kJ•mol-1(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)。表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是
(2)在实际生产中,选定的温度为400~500℃,原因是
(3)在实际生产中,采用的压强为常压,原因是
(4)在实际生产中,通入过量的空气,原因是
(5)尾气中SO2必须回收,原因是
II.Bodenstein研究了反应:2HI(g)
 H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:
H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.6 | 0.73 | 0.773 | 0.78 | 0.784 |
(6)根据上述实验结果,该反应的平衡常数K的计算式为
(7)上述反应中,正反应速率v正=k正x2(HI),逆反应速率v逆=k逆x(H2)•x(I2),其中k正、k逆为正、逆反应速率常数,则k逆为
III.在刚性容器压强为1.01MPa时,乙酸甲酯与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g)
 CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3):n(H2)=1:10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3):n(H2)=1:10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
(8)A点时,CH3CH2OH(g)的体积分数为
(9)此温度下,该反应的化学平衡常数Kp=
您最近一年使用:0次
名校
解题方法
3 . 合成氨工业中,在催化剂作用下发生反应 。下列说法正确的是
。下列说法正确的是
 。下列说法正确的是
。下列说法正确的是| A.该反应的反应物键能总和大于生成物的键能总和 |
| B.实际生产中通常选择200℃、100Mpa条件下合成氨 |
| C.采取迅速冷却的方法,使气态氨变为液态氨后及时从平衡混合物中分离出去,可提高氨的产量 |
| D.增大催化剂的表面积,可有效加快反应速率和提高平衡转化率 |
您最近一年使用:0次
2023-11-21更新
|
249次组卷
|
2卷引用:安徽省六安第一中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
4 . 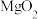 可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备
可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备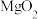 以及含量测定的实验。已知:常温下
以及含量测定的实验。已知:常温下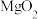 不溶于水,较稳定,与酸反应生成
不溶于水,较稳定,与酸反应生成 ;加热时会分解生成
;加热时会分解生成 和
和 。
。
请回答下列问题:
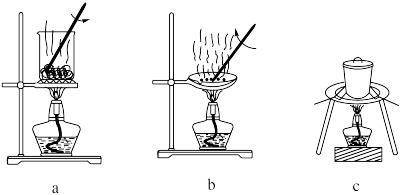
(1)灼烧。灼烧 制
制 时,可使用的实验装置有
时,可使用的实验装置有___________ (填字母)。
(2)转化。向 中先加入稳定剂和
中先加入稳定剂和 溶液,充分反应后,过滤、洗涤、干燥,可得粗品
溶液,充分反应后,过滤、洗涤、干燥,可得粗品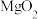 。
。
①写出制备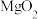 时发生反应的化学方程式:
时发生反应的化学方程式:___________ 。
②“转化”阶段有大量热量放出,为了提高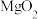 的产率,添加
的产率,添加 溶液时,比较理想的操作方法为
溶液时,比较理想的操作方法为___________ 。
(3)测定。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中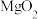 的含量。
的含量。

①实验时在稀盐酸中加入 溶液的作用是
溶液的作用是___________ (用化学方程式表示)。
②为了减小实验误差,在每次读数前需要进行的操作是___________ 、___________ 。
③该小组记录的实验数据如下:样品的质量为 ;反应开始前量气管的读数为
;反应开始前量气管的读数为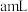 ;反应结束冷却到室温后量气管的读数为
;反应结束冷却到室温后量气管的读数为 ,已知:室温条件下气体摩尔体积为
,已知:室温条件下气体摩尔体积为 ,则样品中过氧化镁的质量分数为
,则样品中过氧化镁的质量分数为___________  (用含
(用含 的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得
的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得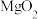 的质量分数
的质量分数___________ (填“偏大”“偏小”或“无影响”)。
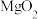 可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备
可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备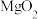 以及含量测定的实验。已知:常温下
以及含量测定的实验。已知:常温下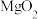 不溶于水,较稳定,与酸反应生成
不溶于水,较稳定,与酸反应生成 ;加热时会分解生成
;加热时会分解生成 和
和 。
。请回答下列问题:
(1)灼烧。灼烧
 制
制 时,可使用的实验装置有
时,可使用的实验装置有
(2)转化。向
 中先加入稳定剂和
中先加入稳定剂和 溶液,充分反应后,过滤、洗涤、干燥,可得粗品
溶液,充分反应后,过滤、洗涤、干燥,可得粗品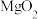 。
。①写出制备
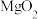 时发生反应的化学方程式:
时发生反应的化学方程式:②“转化”阶段有大量热量放出,为了提高
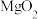 的产率,添加
的产率,添加 溶液时,比较理想的操作方法为
溶液时,比较理想的操作方法为(3)测定。某研究小组拟用下图装置测定样品(含
 杂质)中
杂质)中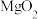 的含量。
的含量。
①实验时在稀盐酸中加入
 溶液的作用是
溶液的作用是②为了减小实验误差,在每次读数前需要进行的操作是
③该小组记录的实验数据如下:样品的质量为
 ;反应开始前量气管的读数为
;反应开始前量气管的读数为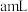 ;反应结束冷却到室温后量气管的读数为
;反应结束冷却到室温后量气管的读数为 ,已知:室温条件下气体摩尔体积为
,已知:室温条件下气体摩尔体积为 ,则样品中过氧化镁的质量分数为
,则样品中过氧化镁的质量分数为 (用含
(用含 的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得
的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得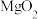 的质量分数
的质量分数
您最近一年使用:0次
2023-10-06更新
|
799次组卷
|
5卷引用:安徽省巢湖市第一中学2024届高三10月月考化学试题
名校
5 . 在硫酸工业中,通过下列反应使SO2氧化为SO3:2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是___________ 。
(2)在实际生产中,选定的温度为400℃~500℃,原因是___________
(3)在实际生产中,采用的压强为常压,原因是___________
(4)在实际生产中,通入过量的空气,原因是___________
(5)尾气中的SO2必须回收,原因是___________ 。
(6)在550℃、1MPa下,若SO2的起始浓度为2mol/L,O2的起始浓度为1mol/L,试求该条件下的平衡常数K=___________ 。
 2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 95.0 | 97.7 | 98.3 |
(2)在实际生产中,选定的温度为400℃~500℃,原因是
(3)在实际生产中,采用的压强为常压,原因是
(4)在实际生产中,通入过量的空气,原因是
(5)尾气中的SO2必须回收,原因是
(6)在550℃、1MPa下,若SO2的起始浓度为2mol/L,O2的起始浓度为1mol/L,试求该条件下的平衡常数K=
您最近一年使用:0次
名校
解题方法
6 . 工业上制备硫酸的一步重要反应是 在400~500℃下的催化氧化反应:
在400~500℃下的催化氧化反应: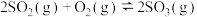
 。下列有关说法错误的是
。下列有关说法错误的是
 在400~500℃下的催化氧化反应:
在400~500℃下的催化氧化反应: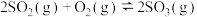
 。下列有关说法错误的是
。下列有关说法错误的是A.常通入过量的空气,以提高 的平衡转化率 的平衡转化率 |
| B.为提高反应速率和平衡转化率,采用的压强越大越好 |
| C.控制温度为400~500℃既能提升反应速率,又能使催化剂有较高的活性 |
| D.要综合考虑影响速率与平衡的各种因素、设备条件和经济成本等,寻找适宜的生产条件 |
您最近一年使用:0次
2023-08-12更新
|
410次组卷
|
8卷引用:安徽省六安市裕安区新安中学2023-2024学年高二下学期第一次月考化学试题
安徽省六安市裕安区新安中学2023-2024学年高二下学期第一次月考化学试题河南省周口市无锡天一企业管理有限公司等2校2022-2023学年高二上学期12月期末考试化学试题山东省鄄城县第一中学2023-2024学年高二上学期9月月考化学试题黑龙江省哈尔滨市第一中学校2023-2024学年高二上学期第一次质量检测化学试题(已下线)专题05 化学反应的方向 化学反应的调控 -【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)天津市天津中学2023-2024学年高二上学期第一次月考化学试题(已下线)寒假作业04 化学反应的方向及调控-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)四川省宜宾市叙州区第二中学校2023-2024学年高二上学期12月月考化学试题
解题方法
7 . 硫氰化钾(KSCN)可用作洗涤剂中的缓蚀剂,也常用作分析试剂,用于鉴定三价铁、铜、银等。某小组以二硫化碳(CS2)和液氨为原料制备KSCN晶体:将固体催化剂、二硫化碳和稍过量的液氨在反应釜中混合,在5.88×105Pa、100℃下,反应20h,再经减压脱硫蒸发转化等步骤制得KSCN产品,其实验流程如下。

已知:i.NH4SCN在高于170℃时易分解。
ii.(NH4)2CO3在105℃时分解为NH3和CO2。
请回答下列问题:
(1)反应釜中,除生成NH4SCN外,还有一种产物(属于无氧酸式盐)。
①NH4SCN中阴、阳离子的空间构型依次为___________ 和___________ 。
②写出反应釜中主要反应的化学方程式:___________ 。
③反应釜中温度越高越易反应,但控制温度不过高的原因是___________ 。
(2)写出步骤I减压脱硫蒸发的化学方程式:___________ 。
(3)步骤Ⅱ中,工业上用K2CO3溶液而不用KOH溶液的原因有两种:一是K2CO3比KOH便宜;二是有效降低KSCN中K2S杂质的含量,试分析K2CO3能降低K2S杂质含量的原因是___________ 。
(4)实验流程中可以循环使用的物质除催化剂外,还有___________ 。(填化学式)。
(5)用KSCN滴定法可以测定银的含量,其步骤如下:称取0.2000g粗银(假设杂质不参与反应),加入10mL6mol·L-1硝酸中加热溶解,煮沸后,用蒸馏水稀释至100mL并转移至锥形瓶中,加入5mL硫酸铁铵溶液[NH4Fe(SO4)2]作指示剂,用0.1mol·L-1KSCN标准溶液滴定,至终点时消耗18mLKSCN标准溶液。
已知:i.氮的氧化物遇KSCN溶液呈红色。
ii.SCN—+Ag+=AgSCN↓(白色)。
①实验步骤中“煮沸”的目的是___________ 。
②滴定终点的标志是:加入最后半滴标准溶液时,___________ 。
③粗银中Ag的质量分数为___________ %。

已知:i.NH4SCN在高于170℃时易分解。
ii.(NH4)2CO3在105℃时分解为NH3和CO2。
请回答下列问题:
(1)反应釜中,除生成NH4SCN外,还有一种产物(属于无氧酸式盐)。
①NH4SCN中阴、阳离子的空间构型依次为
②写出反应釜中主要反应的化学方程式:
③反应釜中温度越高越易反应,但控制温度不过高的原因是
(2)写出步骤I减压脱硫蒸发的化学方程式:
(3)步骤Ⅱ中,工业上用K2CO3溶液而不用KOH溶液的原因有两种:一是K2CO3比KOH便宜;二是有效降低KSCN中K2S杂质的含量,试分析K2CO3能降低K2S杂质含量的原因是
(4)实验流程中可以循环使用的物质除催化剂外,还有
(5)用KSCN滴定法可以测定银的含量,其步骤如下:称取0.2000g粗银(假设杂质不参与反应),加入10mL6mol·L-1硝酸中加热溶解,煮沸后,用蒸馏水稀释至100mL并转移至锥形瓶中,加入5mL硫酸铁铵溶液[NH4Fe(SO4)2]作指示剂,用0.1mol·L-1KSCN标准溶液滴定,至终点时消耗18mLKSCN标准溶液。
已知:i.氮的氧化物遇KSCN溶液呈红色。
ii.SCN—+Ag+=AgSCN↓(白色)。
①实验步骤中“煮沸”的目的是
②滴定终点的标志是:加入最后半滴标准溶液时,
③粗银中Ag的质量分数为
您最近一年使用:0次
名校
解题方法
8 . 湿法炼锌是当今世界最主要的炼锌方法,其产量占世界总锌产量的85%以上。一种利用ZnS精矿(含有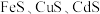 等杂质)提取锌的工艺流程如下:
等杂质)提取锌的工艺流程如下:
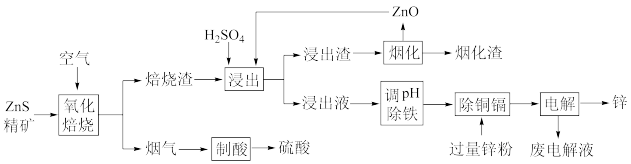
回答下列问题:
(1)工业上,“氧化焙烧”中常采用从底部通入高压空气使ZnS精矿处于“沸腾”状态,其目的是_______ 。
(2)烟气的主要成分是_______ 。
(3)焙烧渣中,铁元素以铁酸锌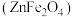 形式存在,铁酸锌在“浸出”步骤中反应的离子方程式为
形式存在,铁酸锌在“浸出”步骤中反应的离子方程式为_______ 。
(4)浸出渣可采用旋涡炉熔炼新工艺处理,在筒形炉体的上部切向送入高速热空气,使炉内形成高速旋转的旋涡,涡流在靠近炉壁侧为正压向下旋转,靠近中心部位为负压而且向上抽吸,这种新工艺的优点是_______ 。
(5)“调pH除铁”中,若将 沉淀完全,应调节至
沉淀完全,应调节至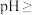
_______ 。(已知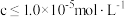 时认为沉淀完全,
时认为沉淀完全,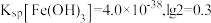 )
)
(6)“电解”时,锌在_______ (填“阳”或“阴”)极析出,废电解液酸性较大,应返回“_______ ”步骤使用,减少Zn的损失。
 等杂质)提取锌的工艺流程如下:
等杂质)提取锌的工艺流程如下:
回答下列问题:
(1)工业上,“氧化焙烧”中常采用从底部通入高压空气使ZnS精矿处于“沸腾”状态,其目的是
(2)烟气的主要成分是
(3)焙烧渣中,铁元素以铁酸锌
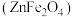 形式存在,铁酸锌在“浸出”步骤中反应的离子方程式为
形式存在,铁酸锌在“浸出”步骤中反应的离子方程式为(4)浸出渣可采用旋涡炉熔炼新工艺处理,在筒形炉体的上部切向送入高速热空气,使炉内形成高速旋转的旋涡,涡流在靠近炉壁侧为正压向下旋转,靠近中心部位为负压而且向上抽吸,这种新工艺的优点是
(5)“调pH除铁”中,若将
 沉淀完全,应调节至
沉淀完全,应调节至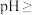
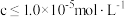 时认为沉淀完全,
时认为沉淀完全,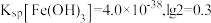 )
)(6)“电解”时,锌在
您最近一年使用:0次
9 . 氮气在催化剂 表面,经过电催化制备
表面,经过电催化制备 的不同机理如下图所示,下列说法错误的是
的不同机理如下图所示,下列说法错误的是

 表面,经过电催化制备
表面,经过电催化制备 的不同机理如下图所示,下列说法错误的是
的不同机理如下图所示,下列说法错误的是
| A.机理一与机理二步骤中,都有加成反应 |
| B.机理一与机理二的慢反应分别是反应③和反应⑥ |
| C.消耗等物质的量氮气,机理二产生的氨气是机理一的2倍 |
| D.氨气在阴极区生成 |
您最近一年使用:0次
10 . CO2综合利用有利于实现碳中和目标,对于构建低碳社会具有重要意义。
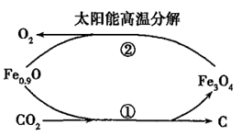
(1)在太阳能的作用下,缺铁氧化物[如Fe0.9O]能分解CO2,其过程如图所示。过程①的化学方程式是___________ 。在过程②中每产生1molO2,转移电子___________ mol。
(2)CO2与H2一起直接制备甲醇,其中的主要过程包括以下反应:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=—49.0kJ·mol−1
CH3OH(g)+H2O(g) ΔH=—49.0kJ·mol−1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.1kJ·mol−1
CO(g)+H2O(g) ΔH=+41.1kJ·mol−1
研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按n(CO2):n(H2)=1:3(总量为amol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)
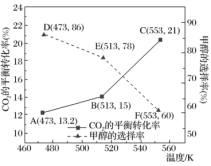
①根据图中数据,温度选择___________ K,达到平衡时,反应体系内甲醇的产量最高。
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因___________ 。
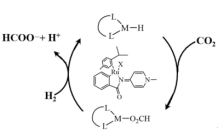
(3)利用CO2在新型钌配合物催化剂下加氢合成甲酸,反应机理如图所示,图中含Ru配合物的某段结构用M表示。中间体为___________ ,研究表明,极性溶剂有助于促进CO2插入M-H键,使用极性溶剂后极大地提高了整个反应的合成效率,原因是___________
(1)在太阳能的作用下,缺铁氧化物[如Fe0.9O]能分解CO2,其过程如图所示。过程①的化学方程式是

(2)CO2与H2一起直接制备甲醇,其中的主要过程包括以下反应:
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=—49.0kJ·mol−1
CH3OH(g)+H2O(g) ΔH=—49.0kJ·mol−1②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.1kJ·mol−1
CO(g)+H2O(g) ΔH=+41.1kJ·mol−1研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按n(CO2):n(H2)=1:3(总量为amol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)

①根据图中数据,温度选择
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因
(3)利用CO2在新型钌配合物催化剂下加氢合成甲酸,反应机理如图所示,图中含Ru配合物的某段结构用M表示。中间体为

您最近一年使用:0次
2021-10-10更新
|
349次组卷
|
2卷引用:安徽省池州市江南中学2021-2022学年高二上学期11月月考化学试题



