解题方法
1 . 甘肃矿产资源丰富,镍、钴、铂等金属储量全国领先,有色金属冶炼在国民经济发展有着重要作用。利用紫硫镍铁矿石提取粗镍并回收铁、铜、钴等元素的工艺流程如下:
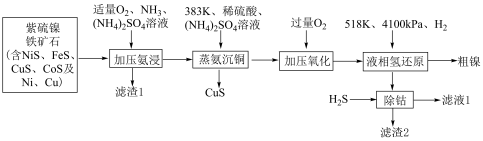
已知:①“加压氨浸”过程中镍硫化物发生反应的方程式为: ;在此过程中,钴硫化物的反应与镍硫化物相似。
;在此过程中,钴硫化物的反应与镍硫化物相似。
②以上流程中均无SO2产生。
请回答:
(1)滤渣1的主要成分为___________ 。
(2)结合下列图表选择“加压氨浸”的最佳条件___________ 。

(3)“加压氨浸”过程中“加压”的目的是___________ 、___________ ;Cu发生反应的化学方程式为___________ 。
(4)“加压氧化”的目的是氧化残留的___________ (填离子符号)。
(5)“除钴”过程中发生反应的离子方程式为___________ 。
(6)流程中可以循环利用的物质有___________ (填化学式)。

已知:①“加压氨浸”过程中镍硫化物发生反应的方程式为:
 ;在此过程中,钴硫化物的反应与镍硫化物相似。
;在此过程中,钴硫化物的反应与镍硫化物相似。②以上流程中均无SO2产生。
请回答:
(1)滤渣1的主要成分为
(2)结合下列图表选择“加压氨浸”的最佳条件

(3)“加压氨浸”过程中“加压”的目的是
(4)“加压氧化”的目的是氧化残留的
(5)“除钴”过程中发生反应的离子方程式为
(6)流程中可以循环利用的物质有
您最近一年使用:0次
23-24高三上·天津·阶段练习
名校
2 . 某温度下发生反应:3H2(g)+N2(g)⇌2NH3(g) ΔH=-92.4kJ/mol,N2的转化率(α)与体系总压强(p)的关系如图所示,下列说法中正确的是
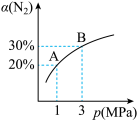

| A.将1molN2、3molH2置于1L密闭容器中发生反应,放出的热量为92.4kJ |
| B.平衡状态由A变到B时,平衡常数KA<KB |
| C.上述反应在达到平衡后,增大压强,H2的转化率增大 |
| D.合成氨工业中常采用400~500℃的高温以提高原料的转化率 |
您最近一年使用:0次
23-24高三上·贵州贵阳·阶段练习
名校
解题方法
3 . “中国芯”的发展离不开单晶硅,工业上制高纯硅,先制得粗硅,再制高纯硅。
Ⅰ.请回答:
(1)工业制粗硅反应的化学方程式为___________ 。
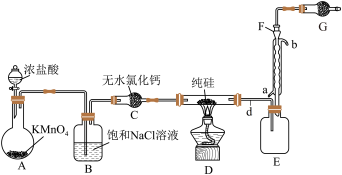
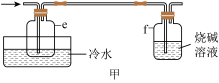
Ⅱ.某小组拟在实验室用如图所示装置模拟探究四氯化硅的制备和应用(夹持装置已省略)。
① ,
, ;
;
② 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为
的熔点、沸点分别为 、
、 。
。
请回答下列问题:
(2)装无水氯化钙的仪器名称是___________ 。
(3)若拆去B装置,可能的后果是___________ (写出一个即可)。
(4)有同学最初将E、F、G装置设计成图甲所示装置,图甲装置的主要缺点是___________ (写出一个即可)。 在高温条件下易分解生成
在高温条件下易分解生成 和
和 。利用
。利用 和
和 制备新型无机非金属材料(
制备新型无机非金属材料(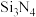 )的装置如图乙,写出该反应的化学方程式:
)的装置如图乙,写出该反应的化学方程式:___________ 。利用尾气制备盐酸,宜选择下列装置中的___________ (填序号)。
(6) 也是制取高纯硅的重要原料,它在浓的
也是制取高纯硅的重要原料,它在浓的 溶液中的反应方程式为
溶液中的反应方程式为___________ 。
Ⅰ.请回答:
(1)工业制粗硅反应的化学方程式为
Ⅱ.某小组拟在实验室用如图所示装置模拟探究四氯化硅的制备和应用(夹持装置已省略)。
①
 ,
, ;
;②
 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为
的熔点、沸点分别为 、
、 。
。请回答下列问题:
(2)装无水氯化钙的仪器名称是
(3)若拆去B装置,可能的后果是
(4)有同学最初将E、F、G装置设计成图甲所示装置,图甲装置的主要缺点是
 在高温条件下易分解生成
在高温条件下易分解生成 和
和 。利用
。利用 和
和 制备新型无机非金属材料(
制备新型无机非金属材料(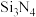 )的装置如图乙,写出该反应的化学方程式:
)的装置如图乙,写出该反应的化学方程式: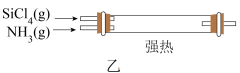

(6)
 也是制取高纯硅的重要原料,它在浓的
也是制取高纯硅的重要原料,它在浓的 溶液中的反应方程式为
溶液中的反应方程式为
您最近一年使用:0次
2024-01-06更新
|
1074次组卷
|
4卷引用:专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)贵州省贵阳市第一中学2023-2024学年高三上学期11月高考适应性月考化学试卷(三)(已下线)题型17 化学实验综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)河北省廊坊市2023-2024学年高一下学期3月月考化学试题
4 .  既是一种重要的能源,也是一种重要的化工原料。回答下列问题:
既是一种重要的能源,也是一种重要的化工原料。回答下列问题:
(1)甲烷在高温条件下可分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是___________ 。
(2)以 为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图1所示,则通入
为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图1所示,则通入 的电极为
的电极为___________ (填“正极”或“负极”),通入 的电极反应式为
的电极反应式为___________ (质子交换膜只允许 通过)。
通过)。

(3)在一定温度和催化剂作用下, 与
与 可直接转化成乙酸,这是实现“减排”的一种研究方向。
可直接转化成乙酸,这是实现“减排”的一种研究方向。
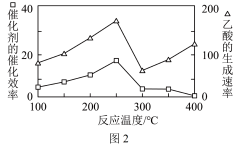
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图2所示,则该反应的最佳温度应控制在___________ 左右。
② 与
与 可直接转化成乙酸的原子利用率为
可直接转化成乙酸的原子利用率为___________ 。
(4)碳正离子[例如: 、
、 、
、 等]是有机反应中间体,
等]是有机反应中间体, 碳正离子是由
碳正离子是由 在“超强酸”中获得一个
在“超强酸”中获得一个 而得到,而
而得到,而 失去
失去 可得
可得 。
。 去掉
去掉 后生成电中性有机分子,该分子的结构简式为
后生成电中性有机分子,该分子的结构简式为___________ 。
(5) 与
与 在光照条件下可发生反应。
在光照条件下可发生反应。
①实验室中用如图3所示的装置进行实验。

在光照条件下反应一段时间后,可观察到试管中的现象为___________ 。
② 与
与 生成
生成 的反应过程,中间态物质的能量关系见图4。有关说法不正确的是
的反应过程,中间态物质的能量关系见图4。有关说法不正确的是___________ (填字母)。
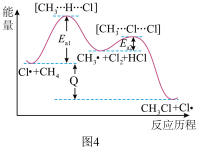
A.Cl是 在光照下化学键断裂生成的,该过程可表示为
在光照下化学键断裂生成的,该过程可表示为
B.反应过程一定无 生成
生成
C.图示 到
到 的反应过程放出热量
的反应过程放出热量
D. 转化为
转化为 ,
, 键发生了断裂
键发生了断裂
 既是一种重要的能源,也是一种重要的化工原料。回答下列问题:
既是一种重要的能源,也是一种重要的化工原料。回答下列问题:(1)甲烷在高温条件下可分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是
(2)以
 为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图1所示,则通入
为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图1所示,则通入 的电极为
的电极为 的电极反应式为
的电极反应式为 通过)。
通过)。
(3)在一定温度和催化剂作用下,
 与
与 可直接转化成乙酸,这是实现“减排”的一种研究方向。
可直接转化成乙酸,这是实现“减排”的一种研究方向。①在不同温度下,催化剂的催化效率与乙酸的生成速率如图2所示,则该反应的最佳温度应控制在

②
 与
与 可直接转化成乙酸的原子利用率为
可直接转化成乙酸的原子利用率为(4)碳正离子[例如:
 、
、 、
、 等]是有机反应中间体,
等]是有机反应中间体, 碳正离子是由
碳正离子是由 在“超强酸”中获得一个
在“超强酸”中获得一个 而得到,而
而得到,而 失去
失去 可得
可得 。
。 去掉
去掉 后生成电中性有机分子,该分子的结构简式为
后生成电中性有机分子,该分子的结构简式为(5)
 与
与 在光照条件下可发生反应。
在光照条件下可发生反应。①实验室中用如图3所示的装置进行实验。

在光照条件下反应一段时间后,可观察到试管中的现象为
②
 与
与 生成
生成 的反应过程,中间态物质的能量关系见图4。有关说法不正确的是
的反应过程,中间态物质的能量关系见图4。有关说法不正确的是
A.Cl是
 在光照下化学键断裂生成的,该过程可表示为
在光照下化学键断裂生成的,该过程可表示为
B.反应过程一定无
 生成
生成C.图示
 到
到 的反应过程放出热量
的反应过程放出热量D.
 转化为
转化为 ,
, 键发生了断裂
键发生了断裂
您最近一年使用:0次
名校
解题方法
5 . 下列有关合成氨工业的说法正确的是
| A.合成氨工业的反应温度控制在400~500℃,目的是使化学平衡向正反应方向移动 |
| B.合成氨厂一般采用的压强为10MPa~30MPa,因为该压强下铁触媒的活性最高 |
| C.增大压强,正反应速率和逆反应速率均增大,但对正反应的反应速率影响更大 |
D. 的量越多, 的量越多, 的转化率越大,因此,充入的 的转化率越大,因此,充入的 越多越有利于 越多越有利于 的合成 的合成 |
您最近一年使用:0次
名校
6 . 下列说法中正确的是
A.已知 t1℃时,反应 C(g)+CO2(g)  2CO(g) ΔH >0 的速率为 υ,若升高温度,逆反应速率减小 2CO(g) ΔH >0 的速率为 υ,若升高温度,逆反应速率减小 |
B.恒压容器中发生反应 N2(g)+O2(g)  2NO(g),若在容器中充入 He,正逆反应速率均不变 2NO(g),若在容器中充入 He,正逆反应速率均不变 |
| C.当一定量的锌粉和过量的 6mol•L-1盐酸反应时,为了减慢反应速率,又不影响产生 H2的总量,可向反应器中加入少量的 CuSO4溶液 |
D.对于工业合成氨反应 N2(g)+3H2(g)  2NH3(g) ΔH﹤0,选用 450℃主要为了提高催化剂(铁触媒)的催化效率 2NH3(g) ΔH﹤0,选用 450℃主要为了提高催化剂(铁触媒)的催化效率 |
您最近一年使用:0次
名校
7 . Burns和Dainton研究发现Cl2与CO合成COCl2的反应机理如下:
①Cl2(g)⇌2Cl•(g) 快
②CO(g)+Cl•(g)⇌COCl•(g) 快
③COCl•(g)+Cl2(g)⇌COCl2(g)+Cl•(g) 慢
反应②的速率方程为v正=k正c(CO)×c(Cl•),v逆=k逆c(COCl•)。下列说法错误的是
①Cl2(g)⇌2Cl•(g) 快
②CO(g)+Cl•(g)⇌COCl•(g) 快
③COCl•(g)+Cl2(g)⇌COCl2(g)+Cl•(g) 慢
反应②的速率方程为v正=k正c(CO)×c(Cl•),v逆=k逆c(COCl•)。下列说法错误的是
| A.反应①的活化能大于反应③的活化能 |
B.反应②的平衡常数K= |
| C.要提高合成COCl2的速率,关键是提高反应③的速率 |
| D.选择合适的催化剂能提高单位时间内COCl2的产率 |
您最近一年使用:0次
2021-01-28更新
|
597次组卷
|
7卷引用:甘肃省金昌市永昌县第一高级中学2022-2023学年高二上学期第一次月考化学试题
8 . 由H、C、N、O、S等元素形成的多种化合物在生产生活中有着重要应用。
Ⅰ.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+ O2(g)===CO(g)+2H2(g) ΔH1=-36 kJ·mol-1
O2(g)===CO(g)+2H2(g) ΔH1=-36 kJ·mol-1
②CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH2=+216 kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,产生1 mol CO,转移电子的数目为__________ 。
(2)甲醇催化脱氢可制得重要的化工产品——甲醛,制备过程中能量的转化关系如图所示。
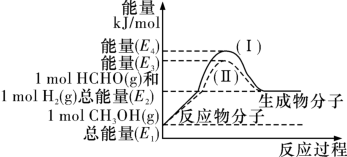
①写出上述反应的热化学方程式_______ 。
②反应热大小比较:过程Ⅰ______ (填“大于”“小于”或“等于”)过程Ⅱ。
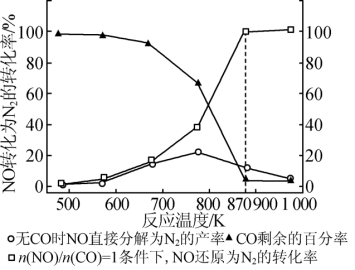
Ⅱ.(3)汽车使用乙醇汽油并不能减少NOx的排放,这使得NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以AgZSM5为催化剂,则得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775 K,发现NO的分解率降低。其可能的原因为_______ ,在n(NO)/n(CO)=1的条件下,为更好地除去NOx物质,应控制的最佳温度在_______ K左右。
Ⅲ.研究表明,在催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
反应Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol-1;
CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol-1;
反应Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1,
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1,
(4)T1时,将1.00 mol CO2和3.00 mol H2充入体积为1.00 L的恒容密闭容器中发生反应Ⅰ,容器起始压强为p0。
①充分反应达到平衡后,若CO2的转化率为a,则容器的压强与起始压强之比为_______ (用含a的代数式表示)。
②若经过3h反应达到平衡,平衡后,混合气体的物质的量为3.00 mol,则该过程中H2的平均反应速率为___________ ;平衡常数K可用反应体系中气体物质分压表示,即用平衡分压代替平衡浓度,分压=总压×物质的量分数。则上述反应的平衡常数Kp=______ (用含p0的代数式表示)。
Ⅰ.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+
 O2(g)===CO(g)+2H2(g) ΔH1=-36 kJ·mol-1
O2(g)===CO(g)+2H2(g) ΔH1=-36 kJ·mol-1②CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH2=+216 kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,产生1 mol CO,转移电子的数目为
(2)甲醇催化脱氢可制得重要的化工产品——甲醛,制备过程中能量的转化关系如图所示。

①写出上述反应的热化学方程式
②反应热大小比较:过程Ⅰ
Ⅱ.(3)汽车使用乙醇汽油并不能减少NOx的排放,这使得NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以AgZSM5为催化剂,则得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775 K,发现NO的分解率降低。其可能的原因为

Ⅲ.研究表明,在催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
反应Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol-1;
CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol-1;反应Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1,
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1,(4)T1时,将1.00 mol CO2和3.00 mol H2充入体积为1.00 L的恒容密闭容器中发生反应Ⅰ,容器起始压强为p0。
①充分反应达到平衡后,若CO2的转化率为a,则容器的压强与起始压强之比为
②若经过3h反应达到平衡,平衡后,混合气体的物质的量为3.00 mol,则该过程中H2的平均反应速率为
您最近一年使用:0次
2020-11-26更新
|
117次组卷
|
2卷引用:甘肃省庆阳市等3地2022-2023学年高二上学期12月期中化学试题
名校
解题方法
9 . 关于合成氨工业的下列说法正确的是( )
| A.从合成塔出来的气体,其中氨气一般占15%,所以生产氨的工业效率都很低 |
B.由于 易液化, 易液化, 、 、 可循环使用,则总的说来,氨的产率很高 可循环使用,则总的说来,氨的产率很高 |
| C.合成氨工业的反应温度控制在400~500℃左右,目的是使平衡向正反应方向进行 |
D.合成氨工业采用 ,是因为该条件下催化剂的活性最好 ,是因为该条件下催化剂的活性最好 |
您最近一年使用:0次
2020-09-20更新
|
880次组卷
|
8卷引用:甘肃省兰州第一中学2022-2023学年高二上学期期中考试化学试题
甘肃省兰州第一中学2022-2023学年高二上学期期中考试化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第4节 化学反应条件的优化——工业合成氨高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第四节 化学反应的调控(已下线)第六章 化学反应与能量(培优提升卷)-2020-2021学年高一化学章末集训必刷卷(人教版2019必修第二册)(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)河南省通许县一中2022—2023年高二上学期第一次月考化学试题(已下线)课时5化学反应条件的控制第4节 化学反应条件的优化——工业合成氨
10 . 在加热、催化剤作用下2SO2(g)+O2(g) 2SO3(g)下列说法不正确的是( )
2SO3(g)下列说法不正确的是( )
 2SO3(g)下列说法不正确的是( )
2SO3(g)下列说法不正确的是( )| A.在相同条件下,该反应中分别用SO2和O2表示的v,数值不同,但该反应的快慢程度是一致的 |
| B.该反应加入催化剂的目的是为了加快反应速率 |
| C.为了提高SO2的转化率,减少污染物的排放,常常在实际生产中,O2和SO2的投入量之比大于1:2 |
| D.在密闭容器中,投入2 mol SO2和l mol O2,反应结束时生成的2 mol SO3 |
您最近一年使用:0次



