23-24高三上·陕西汉中·阶段练习
解题方法
1 .  (简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、
(简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、 、LiCl和
、LiCl和 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
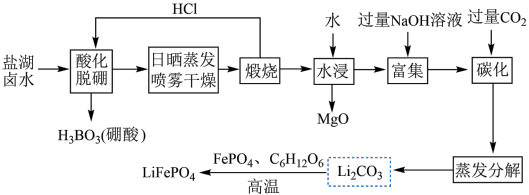
注:日晒蒸发、喷雾干燥后固体含NaCl、LiCl、 等。
等。
(1) 中Li在元素周期表中的位置为第
中Li在元素周期表中的位置为第___________ 周期___________ 族。
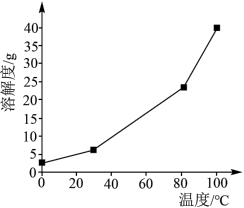
(2)硼酸在水中的溶解度随温度的变化关系如图所示。
已知: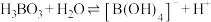
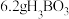 最多与
最多与___________  溶液完全反应。“酸化脱硼”中采用
溶液完全反应。“酸化脱硼”中采用___________ (填“加热”或“冷却”),采用该操作的目的是___________ 。
(3)“煅烧”过程中,常需要搅拌,搅拌的目的是___________ 。
(4)“蒸发分解”的化学方程式为___________ 。
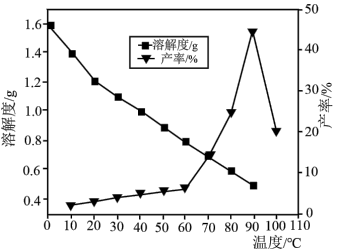
(5)已知不同温度下蒸发分解得到 的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是
的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是___________ ,制得 后需要洗涤,具体操作为
后需要洗涤,具体操作为___________ 。
(6)用 、
、 、
、 制备
制备 时,有
时,有 产生,则参与反应的
产生,则参与反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
 (简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、
(简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、 、LiCl和
、LiCl和 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
注:日晒蒸发、喷雾干燥后固体含NaCl、LiCl、
 等。
等。(1)
 中Li在元素周期表中的位置为第
中Li在元素周期表中的位置为第(2)硼酸在水中的溶解度随温度的变化关系如图所示。

已知:
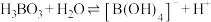
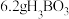 最多与
最多与 溶液完全反应。“酸化脱硼”中采用
溶液完全反应。“酸化脱硼”中采用(3)“煅烧”过程中,常需要搅拌,搅拌的目的是
(4)“蒸发分解”的化学方程式为
(5)已知不同温度下蒸发分解得到
 的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是
的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是 后需要洗涤,具体操作为
后需要洗涤,具体操作为
(6)用
 、
、 、
、 制备
制备 时,有
时,有 产生,则参与反应的
产生,则参与反应的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
2 .  可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备
可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备 以及含量测定的实验。已知:常温下
以及含量测定的实验。已知:常温下 不溶于水,较稳定,与酸反应生成
不溶于水,较稳定,与酸反应生成 ;加热时会分解生成
;加热时会分解生成 和
和 。
。
请回答下列问题:
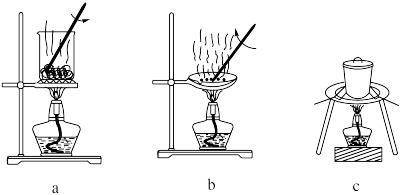
(1)灼烧。灼烧 制
制 时,可使用的实验装置有
时,可使用的实验装置有___________ (填字母)。
(2)转化。向 中先加入稳定剂和
中先加入稳定剂和 溶液,充分反应后,过滤、洗涤、干燥,可得粗品
溶液,充分反应后,过滤、洗涤、干燥,可得粗品 。
。
①写出制备 时发生反应的化学方程式:
时发生反应的化学方程式:___________ 。
②“转化”阶段有大量热量放出,为了提高 的产率,添加
的产率,添加 溶液时,比较理想的操作方法为
溶液时,比较理想的操作方法为___________ 。
(3)测定。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中 的含量。
的含量。

①实验时在稀盐酸中加入 溶液的作用是
溶液的作用是___________ (用化学方程式表示)。
②为了减小实验误差,在每次读数前需要进行的操作是___________ 、___________ 。
③该小组记录的实验数据如下:样品的质量为 ;反应开始前量气管的读数为
;反应开始前量气管的读数为 ;反应结束冷却到室温后量气管的读数为
;反应结束冷却到室温后量气管的读数为 ,已知:室温条件下气体摩尔体积为
,已知:室温条件下气体摩尔体积为 ,则样品中过氧化镁的质量分数为
,则样品中过氧化镁的质量分数为___________  (用含
(用含 的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得
的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得 的质量分数
的质量分数___________ (填“偏大”“偏小”或“无影响”)。
 可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备
可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备 以及含量测定的实验。已知:常温下
以及含量测定的实验。已知:常温下 不溶于水,较稳定,与酸反应生成
不溶于水,较稳定,与酸反应生成 ;加热时会分解生成
;加热时会分解生成 和
和 。
。请回答下列问题:
(1)灼烧。灼烧
 制
制 时,可使用的实验装置有
时,可使用的实验装置有
(2)转化。向
 中先加入稳定剂和
中先加入稳定剂和 溶液,充分反应后,过滤、洗涤、干燥,可得粗品
溶液,充分反应后,过滤、洗涤、干燥,可得粗品 。
。①写出制备
 时发生反应的化学方程式:
时发生反应的化学方程式:②“转化”阶段有大量热量放出,为了提高
 的产率,添加
的产率,添加 溶液时,比较理想的操作方法为
溶液时,比较理想的操作方法为(3)测定。某研究小组拟用下图装置测定样品(含
 杂质)中
杂质)中 的含量。
的含量。
①实验时在稀盐酸中加入
 溶液的作用是
溶液的作用是②为了减小实验误差,在每次读数前需要进行的操作是
③该小组记录的实验数据如下:样品的质量为
 ;反应开始前量气管的读数为
;反应开始前量气管的读数为 ;反应结束冷却到室温后量气管的读数为
;反应结束冷却到室温后量气管的读数为 ,已知:室温条件下气体摩尔体积为
,已知:室温条件下气体摩尔体积为 ,则样品中过氧化镁的质量分数为
,则样品中过氧化镁的质量分数为 (用含
(用含 的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得
的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得 的质量分数
的质量分数
您最近一年使用:0次
2023-10-06更新
|
799次组卷
|
5卷引用:安徽省巢湖市第一中学2024届高三10月月考化学试题
解题方法
3 . 硫氰化钾(KSCN)可用作洗涤剂中的缓蚀剂,也常用作分析试剂,用于鉴定三价铁、铜、银等。某小组以二硫化碳(CS2)和液氨为原料制备KSCN晶体:将固体催化剂、二硫化碳和稍过量的液氨在反应釜中混合,在5.88×105Pa、100℃下,反应20h,再经减压脱硫蒸发转化等步骤制得KSCN产品,其实验流程如下。

已知:i.NH4SCN在高于170℃时易分解。
ii.(NH4)2CO3在105℃时分解为NH3和CO2。
请回答下列问题:
(1)反应釜中,除生成NH4SCN外,还有一种产物(属于无氧酸式盐)。
①NH4SCN中阴、阳离子的空间构型依次为___________ 和___________ 。
②写出反应釜中主要反应的化学方程式:___________ 。
③反应釜中温度越高越易反应,但控制温度不过高的原因是___________ 。
(2)写出步骤I减压脱硫蒸发的化学方程式:___________ 。
(3)步骤Ⅱ中,工业上用K2CO3溶液而不用KOH溶液的原因有两种:一是K2CO3比KOH便宜;二是有效降低KSCN中K2S杂质的含量,试分析K2CO3能降低K2S杂质含量的原因是___________ 。
(4)实验流程中可以循环使用的物质除催化剂外,还有___________ 。(填化学式)。
(5)用KSCN滴定法可以测定银的含量,其步骤如下:称取0.2000g粗银(假设杂质不参与反应),加入10mL6mol·L-1硝酸中加热溶解,煮沸后,用蒸馏水稀释至100mL并转移至锥形瓶中,加入5mL硫酸铁铵溶液[NH4Fe(SO4)2]作指示剂,用0.1mol·L-1KSCN标准溶液滴定,至终点时消耗18mLKSCN标准溶液。
已知:i.氮的氧化物遇KSCN溶液呈红色。
ii.SCN—+Ag+=AgSCN↓(白色)。
①实验步骤中“煮沸”的目的是___________ 。
②滴定终点的标志是:加入最后半滴标准溶液时,___________ 。
③粗银中Ag的质量分数为___________ %。

已知:i.NH4SCN在高于170℃时易分解。
ii.(NH4)2CO3在105℃时分解为NH3和CO2。
请回答下列问题:
(1)反应釜中,除生成NH4SCN外,还有一种产物(属于无氧酸式盐)。
①NH4SCN中阴、阳离子的空间构型依次为
②写出反应釜中主要反应的化学方程式:
③反应釜中温度越高越易反应,但控制温度不过高的原因是
(2)写出步骤I减压脱硫蒸发的化学方程式:
(3)步骤Ⅱ中,工业上用K2CO3溶液而不用KOH溶液的原因有两种:一是K2CO3比KOH便宜;二是有效降低KSCN中K2S杂质的含量,试分析K2CO3能降低K2S杂质含量的原因是
(4)实验流程中可以循环使用的物质除催化剂外,还有
(5)用KSCN滴定法可以测定银的含量,其步骤如下:称取0.2000g粗银(假设杂质不参与反应),加入10mL6mol·L-1硝酸中加热溶解,煮沸后,用蒸馏水稀释至100mL并转移至锥形瓶中,加入5mL硫酸铁铵溶液[NH4Fe(SO4)2]作指示剂,用0.1mol·L-1KSCN标准溶液滴定,至终点时消耗18mLKSCN标准溶液。
已知:i.氮的氧化物遇KSCN溶液呈红色。
ii.SCN—+Ag+=AgSCN↓(白色)。
①实验步骤中“煮沸”的目的是
②滴定终点的标志是:加入最后半滴标准溶液时,
③粗银中Ag的质量分数为
您最近一年使用:0次
4 . 某镍矿石的主要成分为NiO,另含CoO、FeO、Fe2O3、Al2O3、MgO、CaO和SiO2等杂质,按以下流程可制备NiSO4•6H2O晶体和金属钴。

回答下列问题:
(1)“预处理”时需将Fe2+全部氧化为Fe3+,试剂X最好选用_______ (填序号),写出发生反应的化学方程式_______ 。
a.稀硝酸 b.双氧水 c.高锰酸钾溶液 d.新制氯水
(2)常温下,一些金属难溶氢氧化物的溶解度(用阳离子的浓度表示)与pH的关系图如图:

加入NiO调pH=5可除去_______ (填金属离子符号)。
(3)滤渣Z的成分为MgF2和CaF2。若原溶液中c(Ca2+)=1.0×10-3mol/L,沉淀后溶液中c(Mg2+)=1.5×10-6mol/L,则除钙率为_______ (忽略沉淀前后溶液体积变化)。(已知:Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11)
(4)影响P507萃取率的因素有很多,在其他条件相同时,根据如图分析分离镍、钴的最佳条件:相比(油相O:水相A)=_______ ;P507萃取金属离子的原理为nHR(Org)+Mn+(aq) MRn(Org)+nH+(aq),在一定范围内,随着pH升高,萃取率升高的原因是
MRn(Org)+nH+(aq),在一定范围内,随着pH升高,萃取率升高的原因是_______ 。

(5)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
从NiSO4溶液获得稳定的NiSO4•6H2O晶体的操作a依次是_______ 。

回答下列问题:
(1)“预处理”时需将Fe2+全部氧化为Fe3+,试剂X最好选用
a.稀硝酸 b.双氧水 c.高锰酸钾溶液 d.新制氯水
(2)常温下,一些金属难溶氢氧化物的溶解度(用阳离子的浓度表示)与pH的关系图如图:

加入NiO调pH=5可除去
(3)滤渣Z的成分为MgF2和CaF2。若原溶液中c(Ca2+)=1.0×10-3mol/L,沉淀后溶液中c(Mg2+)=1.5×10-6mol/L,则除钙率为
(4)影响P507萃取率的因素有很多,在其他条件相同时,根据如图分析分离镍、钴的最佳条件:相比(油相O:水相A)=
 MRn(Org)+nH+(aq),在一定范围内,随着pH升高,萃取率升高的原因是
MRn(Org)+nH+(aq),在一定范围内,随着pH升高,萃取率升高的原因是
(5)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
| 温度 | 低于30.8℃ | 30.8℃—53.8℃ | 53.8℃—280℃ | 高于280℃ |
| 晶体形态 | NiSO4•7H2O | NiSO4•6H2O | 多种结晶水合物 | NiSO4 |
您最近一年使用:0次
解题方法
5 . 我国提出2060年前实现碳中和,降低大气中CO2含量是当今世界重要科研课题之一,以CO2为原料制备甲烷、戊烷、甲醇等能源物质具有较好的发展前景。问答下列问题:
(1)CO2在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH1=-156.9kJ·mol-1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.1kJ·mol-1
①已知2H2(g)+O2(g)=2H2O(g) ΔH3=-395.6kJ·mol-1,则CH4燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=___________
②加氢合成甲烷时,通常控制温度为500℃左右,其原因为该温度下有较高的化学反应速率和___________
③500℃时,向1L恒容密闭容器中充入4molCO2和12molH2,初始压强为p,20min时主、副反应都达到平衡状态,测得c(H2O)=5mol·L-1,体系压强为 ,则0~20min内v(CH4)=
,则0~20min内v(CH4)=___________ mol·L-lmin-1,平衡时CH4选择性=___________ (CH4选择性=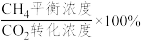 )。
)。
(2)我国科研人员将CO2和H2在Na-Fe3O4/HZSM-5催化下转变为汽油(C5~C11的烃),反应过程如下图所示。
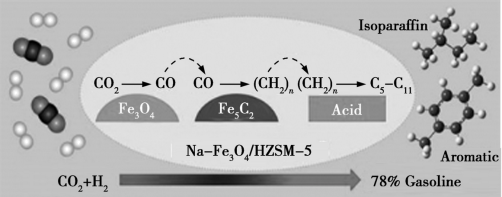
①若CO2在该条件下转化为戊烷(C5H12),则该反应的化学方程式为___________
②催化剂中的Fe3O4可用电解法制备。电解时以Fe做电极,电解质溶液为稀硫酸,其阳极反应式为___________
(3)甲醇催化制取乙烯的过程中发生如下反应:
反应1:3CH3OH⇌C3H6(g)+H2O(g);
反应2:2CH3OH(g)⇌C2H4(g)+2H2O(g)
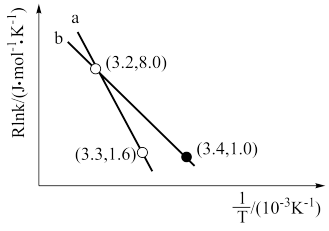
反应I的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式Rlnk= (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能(10K)Ea=
(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能(10K)Ea=___________ kJ·mol-1。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是___________
(1)CO2在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH1=-156.9kJ·mol-1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.1kJ·mol-1
①已知2H2(g)+O2(g)=2H2O(g) ΔH3=-395.6kJ·mol-1,则CH4燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=
②加氢合成甲烷时,通常控制温度为500℃左右,其原因为该温度下有较高的化学反应速率和
③500℃时,向1L恒容密闭容器中充入4molCO2和12molH2,初始压强为p,20min时主、副反应都达到平衡状态,测得c(H2O)=5mol·L-1,体系压强为
 ,则0~20min内v(CH4)=
,则0~20min内v(CH4)=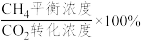 )。
)。(2)我国科研人员将CO2和H2在Na-Fe3O4/HZSM-5催化下转变为汽油(C5~C11的烃),反应过程如下图所示。

①若CO2在该条件下转化为戊烷(C5H12),则该反应的化学方程式为
②催化剂中的Fe3O4可用电解法制备。电解时以Fe做电极,电解质溶液为稀硫酸,其阳极反应式为
(3)甲醇催化制取乙烯的过程中发生如下反应:
反应1:3CH3OH⇌C3H6(g)+H2O(g);
反应2:2CH3OH(g)⇌C2H4(g)+2H2O(g)
反应I的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式Rlnk=
 (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能(10K)Ea=
(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能(10K)Ea=
您最近一年使用:0次
2022-02-02更新
|
893次组卷
|
4卷引用:安徽省马鞍山市 2021-2022学年高三第一次教学质量监测理综化学试题
安徽省马鞍山市 2021-2022学年高三第一次教学质量监测理综化学试题(已下线)押江苏卷第18题 化学反应原理综合题 -备战2022年高考化学临考题号押题(江苏卷)四川省成都附属实验中学2021-2022学年高三下学期第一次模拟考试理科综合化学试题(已下线)题型26 多反应体系中的化学平衡
6 . 氮气在催化剂 表面,经过电催化制备
表面,经过电催化制备 的不同机理如下图所示,下列说法错误的是
的不同机理如下图所示,下列说法错误的是

 表面,经过电催化制备
表面,经过电催化制备 的不同机理如下图所示,下列说法错误的是
的不同机理如下图所示,下列说法错误的是
| A.机理一与机理二步骤中,都有加成反应 |
| B.机理一与机理二的慢反应分别是反应③和反应⑥ |
| C.消耗等物质的量氮气,机理二产生的氨气是机理一的2倍 |
| D.氨气在阴极区生成 |
您最近一年使用:0次
名校
7 . 二氧化氯(ClO2)是一种重要的氧化剂,可用于某些污染物的处理。
(1)ClO2可由图1所示装置制备(电极不反应)。

①电解时阳极附近溶液的pH___ (填“减小”“增大”或“不变”)。
②阴极上产生ClO2的机理如图2所示(A、B均为含氯微粒,其他微粒未标出)。该机理可描述为___ 。
(2)ClO2可用于水体中Mn2+的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得Mn2+浓度随反应时间的变化如图3所示。

①pH=8.3时水体中Mn2+转化为MnO2,ClO2转化为ClO ,该反应的离子方程式为
,该反应的离子方程式为__ 。
②反应相同时间,水体中Mn2+浓度随pH增大而降低的原因是___ 。
(3)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=__ kcal·mol-1。

②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是____ ;添加NO时,SO2氧化率比不添加NO时高,其原因可能是___ 。
(1)ClO2可由图1所示装置制备(电极不反应)。

①电解时阳极附近溶液的pH
②阴极上产生ClO2的机理如图2所示(A、B均为含氯微粒,其他微粒未标出)。该机理可描述为
(2)ClO2可用于水体中Mn2+的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得Mn2+浓度随反应时间的变化如图3所示。

①pH=8.3时水体中Mn2+转化为MnO2,ClO2转化为ClO
 ,该反应的离子方程式为
,该反应的离子方程式为②反应相同时间,水体中Mn2+浓度随pH增大而降低的原因是
(3)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=

②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中
 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
您最近一年使用:0次
2021-09-22更新
|
645次组卷
|
6卷引用:安徽省安庆市第一中学2021-2022学年高三上学期10月月考化学试题
安徽省安庆市第一中学2021-2022学年高三上学期10月月考化学试题江苏省南京市2022届高三上学期9月学情调研化学试题江苏省扬州市扬州中学2022届高三开学考试化学试题2021年辽宁高考化学试题变式题11-19(已下线)黄金卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)押江苏卷第18题 化学反应原理综合题 -备战2022年高考化学临考题号押题(江苏卷)
名校
8 . 从砷盐净化渣(成分为Cu、As、Zn、ZnO、Co和SiO2)中回收有利用价值的金属,解决了长期以来影响砷盐净化工艺推广的技术难题,具有较强的实践指导意义。其工艺流程如图,请回答下列问题∶
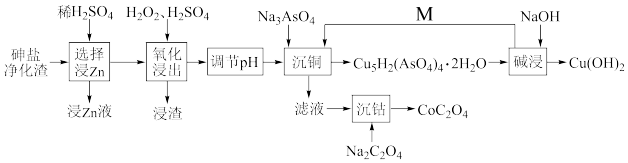
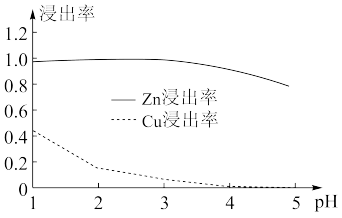
(1)在“选择浸Zn”之前,将砷盐净化渣进行球磨的目的是___ 。其他条件不变时,Zn和Co的浸出率随pH变化如图所示,则“选择浸Zn”过程中,最好控制溶液的pH=___ 。
(2)“氧化浸出”时,As被氧化为H3AsO4的化学方程式为___ 。
(3)用NaOH溶液调节氧化浸出液至弱酸性,再加入Na3AsO4进行“沉铜”,得到难溶性的Cu5H2(AsO4)4·2H2O,则“沉铜”的离子方程式为___ 。
(4)“碱浸”时,除回收得到Cu(OH)2外,还得到物质M,且M在该工艺流程中可循环利用,M的化学式为___ 。
(5)为测定草酸钴产品的纯度,现称取mg样品,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用cmol·L-1高锰酸钾标准液滴定,达到滴定终点时的现象为___ 。共用去VmL高锰酸钾标准液,则该草酸钴产品的纯度为___ 。

(1)在“选择浸Zn”之前,将砷盐净化渣进行球磨的目的是

(2)“氧化浸出”时,As被氧化为H3AsO4的化学方程式为
(3)用NaOH溶液调节氧化浸出液至弱酸性,再加入Na3AsO4进行“沉铜”,得到难溶性的Cu5H2(AsO4)4·2H2O,则“沉铜”的离子方程式为
(4)“碱浸”时,除回收得到Cu(OH)2外,还得到物质M,且M在该工艺流程中可循环利用,M的化学式为
(5)为测定草酸钴产品的纯度,现称取mg样品,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用cmol·L-1高锰酸钾标准液滴定,达到滴定终点时的现象为
您最近一年使用:0次
2021-09-15更新
|
147次组卷
|
2卷引用:安徽省宿松中学2021-2022学年高三上学期第一次联考化学试题
9 . 氮氧化物气体是造成光化学污染的主要气体,降低氮氧化物气体的排放是环境保护的重要课题。
(1)用 氧化可脱除氮氧化物。
氧化可脱除氮氧化物。
已知:①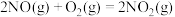
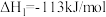
②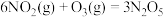
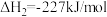
③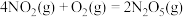
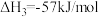
用 氧化脱除NO的总反应是:
氧化脱除NO的总反应是: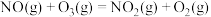 的
的
_______ ,该反应在热力学上趋势大,其原因是_______ 。
(2)氮氧化物间的相互转化,已知 的反应历程分两步:
的反应历程分两步:
第一步: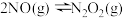 (快反应)
(快反应)
第二步: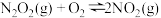 (慢反应)
(慢反应)
①总反应的速率由_______ 决定(填“第一步”或“第二步”)。
②用 表示的速率方程为
表示的速率方程为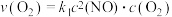 ;
; 表示的速率方程为
表示的速率方程为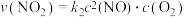 ,
, 与
与 分别表示速率常数,则
分别表示速率常数,则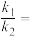
_______ (填数值)。
③下列关于反应 的说法正确的是
的说法正确的是_______ (填序号)。
A.反应的总活化能等于第一步和第二步反应的活化能之和
B.使压强增大,反应速率常数一定增大
C.第一步反应的活化能小于第二步反应的活化能
(3)电解氧化吸收法可将废气中的 转变为硝态氮。分别向
转变为硝态氮。分别向 溶液和
溶液和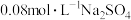 溶液(起始pH均调至9)中通入NO,测得电流强度与NO的脱除率的关系如图1所示。电解
溶液(起始pH均调至9)中通入NO,测得电流强度与NO的脱除率的关系如图1所示。电解 溶液时,溶液中相关成分的浓度变化与电流强度的关系如图2所示。
溶液时,溶液中相关成分的浓度变化与电流强度的关系如图2所示。
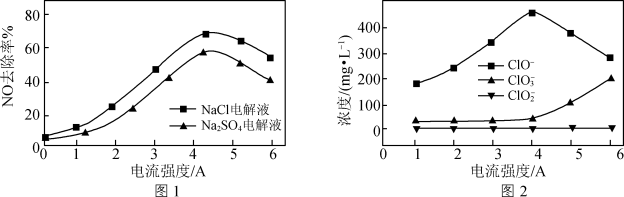
①电解 溶液时产生
溶液时产生 ,
, 氧化吸收NO的离子方程式为
氧化吸收NO的离子方程式为_______ 。
②电解NaCl溶液作吸收液时,NO的去除率始终比 溶液的大,原因是
溶液的大,原因是_______ 。
③随着电流强度的增大,电解NaCl溶液时NO去除率下降的原因是_______ 。
(1)用
 氧化可脱除氮氧化物。
氧化可脱除氮氧化物。已知:①
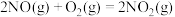
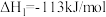
②
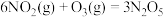
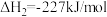
③
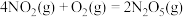
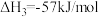
用
 氧化脱除NO的总反应是:
氧化脱除NO的总反应是: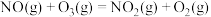 的
的
(2)氮氧化物间的相互转化,已知
 的反应历程分两步:
的反应历程分两步:第一步:
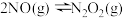 (快反应)
(快反应)第二步:
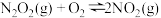 (慢反应)
(慢反应)①总反应的速率由
②用
 表示的速率方程为
表示的速率方程为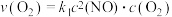 ;
; 表示的速率方程为
表示的速率方程为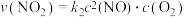 ,
, 与
与 分别表示速率常数,则
分别表示速率常数,则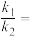
③下列关于反应
 的说法正确的是
的说法正确的是A.反应的总活化能等于第一步和第二步反应的活化能之和
B.使压强增大,反应速率常数一定增大
C.第一步反应的活化能小于第二步反应的活化能
(3)电解氧化吸收法可将废气中的
 转变为硝态氮。分别向
转变为硝态氮。分别向 溶液和
溶液和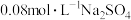 溶液(起始pH均调至9)中通入NO,测得电流强度与NO的脱除率的关系如图1所示。电解
溶液(起始pH均调至9)中通入NO,测得电流强度与NO的脱除率的关系如图1所示。电解 溶液时,溶液中相关成分的浓度变化与电流强度的关系如图2所示。
溶液时,溶液中相关成分的浓度变化与电流强度的关系如图2所示。
①电解
 溶液时产生
溶液时产生 ,
, 氧化吸收NO的离子方程式为
氧化吸收NO的离子方程式为②电解NaCl溶液作吸收液时,NO的去除率始终比
 溶液的大,原因是
溶液的大,原因是③随着电流强度的增大,电解NaCl溶液时NO去除率下降的原因是
您最近一年使用:0次
2021·江西抚州·模拟预测
名校
10 . 丙烯是三大合成材料的基本原料之一,其用量最大的是生产聚丙烯。另外,丙烯可制备1,2-二氯丙烷,丙烯醛等。回答下列问题:
I.工业上用丙烯加成法制备1,2-二氯丙烷,主要副产物为3-氯丙烯,反应原理为:
①CH2=CHCH3(g)+Cl2(g)⇌CH2ClCHClCH3(g) △H1=-134kJ∙mol-1
②CH2=CHCH3(g)+Cl2(g)⇌CH2=CHCH2Cl(g)+HCl(g) △H2=-102kJ∙mol-1
(1)已知CH2=CHCH2Cl(g)+HCl(g)⇌CH2ClCHClCH3(g)的活化能Ea(逆)为164kJ∙mol-1,则该反应的活化能Ea(正)为_______ kJ∙mol-1
(2)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g),在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。
用单位时间内气体分压的变化来表示反应速率,即ν=△p/△t,则反应①前180min内平均反应速率ν(CH2ClCHClCH3)=_____ Kpa/min-1(保留小数点后2位)。
II.丙烯的制备方法
方法一:丙烷无氧脱氢法制备丙烯反应:C3H8(g)⇌C3H6(g)+H2(g) △H=+124kJ∙mol-1
(3)①某温度下,在刚性容器中充入C3H8,起始压强为10kpa,平衡时总压强为14kpa,C3H8(的平衡转化率为____ 。该反应的平衡常数Kp=____ Kpa(保留小数点后2位)
②总压分别为100kpa和10kpa时发生该反应,平衡体系中C3H8和C3H6的物质的量分数随温度变化关系如图所示。

10kpa时C3H8和C3H6的物质的量分数随温度变化关系的曲线分别是____ 、____ 。
③高温下,丙烷生成丙烯的反应在初期阶段的速率方程为:r=k×c(C3H8),其中k为反应速率常数。对于处于初期阶段的该反应,下列说法正确的是____ 。
A.增加丙烷浓度,r增大 B.增加H2浓度,r增大
C.丙烯的生成速率逐渐增大 D.降低反应温度,k减小
方法二:丙烷氧化脱氢法制备丙烯还生成CO、CO2等副产物,制备丙烯的反应:C3H8(g)+1/2O2(g)⇌ C3H6(g)+H2O(g) △H=-118kJ∙mol-1,在催化剂的作用下C3H8的转化率和C3H6的产率随温度变化关系如图2所示。

(4)图中C3H8的转化率随温度升高而上升的原因是_____ ,观察图2,回答能提高C3H6选择性的措施是___ (C3H6的选择性= )
)
I.工业上用丙烯加成法制备1,2-二氯丙烷,主要副产物为3-氯丙烯,反应原理为:
①CH2=CHCH3(g)+Cl2(g)⇌CH2ClCHClCH3(g) △H1=-134kJ∙mol-1
②CH2=CHCH3(g)+Cl2(g)⇌CH2=CHCH2Cl(g)+HCl(g) △H2=-102kJ∙mol-1
(1)已知CH2=CHCH2Cl(g)+HCl(g)⇌CH2ClCHClCH3(g)的活化能Ea(逆)为164kJ∙mol-1,则该反应的活化能Ea(正)为
(2)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g),在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。
| 时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
| 压强/KPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
用单位时间内气体分压的变化来表示反应速率,即ν=△p/△t,则反应①前180min内平均反应速率ν(CH2ClCHClCH3)=
II.丙烯的制备方法
方法一:丙烷无氧脱氢法制备丙烯反应:C3H8(g)⇌C3H6(g)+H2(g) △H=+124kJ∙mol-1
(3)①某温度下,在刚性容器中充入C3H8,起始压强为10kpa,平衡时总压强为14kpa,C3H8(的平衡转化率为
②总压分别为100kpa和10kpa时发生该反应,平衡体系中C3H8和C3H6的物质的量分数随温度变化关系如图所示。

10kpa时C3H8和C3H6的物质的量分数随温度变化关系的曲线分别是
③高温下,丙烷生成丙烯的反应在初期阶段的速率方程为:r=k×c(C3H8),其中k为反应速率常数。对于处于初期阶段的该反应,下列说法正确的是
A.增加丙烷浓度,r增大 B.增加H2浓度,r增大
C.丙烯的生成速率逐渐增大 D.降低反应温度,k减小
方法二:丙烷氧化脱氢法制备丙烯还生成CO、CO2等副产物,制备丙烯的反应:C3H8(g)+1/2O2(g)⇌ C3H6(g)+H2O(g) △H=-118kJ∙mol-1,在催化剂的作用下C3H8的转化率和C3H6的产率随温度变化关系如图2所示。

(4)图中C3H8的转化率随温度升高而上升的原因是
 )
)
您最近一年使用:0次
2021-06-15更新
|
956次组卷
|
4卷引用:安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试平行卷
(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试平行卷江西省临川一中暨临川一中实验学校2021届高三第三次模拟理科综合能力测试化学试题(已下线)2020年山东卷化学高考真题变式题16-20四川省成都石室中学2022—2023学年高二上学期期中考试化学试题



