名校
1 . NiSO4、NiCl2是制取高纯镍和电镀行业的重要原料,回答下列问题:
(1)碱性条件下利用肼(N2H2)还原NiCl2溶液可生成高纯Ni纳米粒子和某气体单质,写出反应的离子方程式_________________________________ 。温度对反应时间和Ni粒径的影响如图所示,温度为___________ (选填字母)℃时,很难形成纳米级别的Ni(已知纳米级别的Ni与胶体分散质的大小一致)。

A.43 B.50 C.64 D.79
(2)利用某含镍废料(主要成分为Ni,还含有铝、铁的氧化物)可制备硫酸镍晶体(NiSO4·7H2O),其流程如图所示:

已知:Ksp[Ni(OH)2]=2.0×10-15 K sp[Fe(OH)2]=8.0×10-16
K sp[Fe(OH)3]=4.0×10-38
①写出“氧化”步骤中发生反应的化学方程式_________________________________ ,步骤需要控制温度40℃左右,其目的是_________________________________ 。
②已知“酸浸”所得滤液中c(Ni2+)=1mol/L,c(Fe2+)=0.1mol/L,试通过计算证明“氧化”步骤的必要性__________________________________________________________________ (离子浓度小于1×10-5mol/L时可认为沉淀完全,要有计算过程和合理的文字叙述)。
③“系列操作”包括__________ 、冷却结晶、过滤、乙醇洗涤、干燥等操作,其中利用乙醇洗涤硫酸镍晶体的优点是____________________________________________ 。
(1)碱性条件下利用肼(N2H2)还原NiCl2溶液可生成高纯Ni纳米粒子和某气体单质,写出反应的离子方程式

A.43 B.50 C.64 D.79
(2)利用某含镍废料(主要成分为Ni,还含有铝、铁的氧化物)可制备硫酸镍晶体(NiSO4·7H2O),其流程如图所示:

已知:Ksp[Ni(OH)2]=2.0×10-15 K sp[Fe(OH)2]=8.0×10-16
K sp[Fe(OH)3]=4.0×10-38
①写出“氧化”步骤中发生反应的化学方程式
②已知“酸浸”所得滤液中c(Ni2+)=1mol/L,c(Fe2+)=0.1mol/L,试通过计算证明“氧化”步骤的必要性
③“系列操作”包括
您最近一年使用:0次
解题方法
2 . 下列说法错误的是
| A.合成氨反应采取循环操作主要是为了提高化学反应速率 |
B.  、 、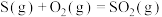  ,则 ,则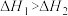 |
C.反应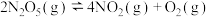  ,能自发进行的原因是 ,能自发进行的原因是 |
D.一定温度下,对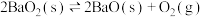 平衡体系缩小体积,再次达到平衡时 平衡体系缩小体积,再次达到平衡时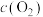 不变 不变 |
您最近一年使用:0次
2023-02-21更新
|
189次组卷
|
6卷引用:安徽省明光市第二中学2023-2024学年高二上学期期中考试化学试卷
安徽省明光市第二中学2023-2024学年高二上学期期中考试化学试卷 河南省商开大联考2022~2023学年高二上学期期末考试化学试题(已下线)专题05 化学反应的方向 化学反应的调控 -【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)河北省沧州市2023-2024学年高二上学期12月月考化学试题江西省部分学校2023-2024学年高二下学期开学考试化学试题陕西省榆林市府谷县府谷中学2023-2024学年高二下学期开学化学试题
名校
解题方法
3 . 2019年9月,我国科研人员研制出Ti-H-Fe双温区催化剂,其中Ti-H区域和Fe区域的温度差可超过100℃。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法错误的是( )

| A.①②③在高温区发生,④⑤在低温区发生 |
| B.该历程中能量变化最大的是2.46eV,是氮分子中氮氮三键的断裂过程 |
| C.在高温区加快了反应速率,低温区提高了氨的产率 |
| D.使用Ti-H-Fe双温区催化合成氨,不会改变合成氨反应的反应热 |
您最近一年使用:0次
2020-07-07更新
|
867次组卷
|
15卷引用:安徽省六安市舒城中学2019-2020学年高二下学期第三次月考化学试题
安徽省六安市舒城中学2019-2020学年高二下学期第三次月考化学试题(已下线)化学(九省联考考后提升卷,安徽卷)-2024年1月“九省联考”真题完全解读与考后提升河南省郑州市2020届高三第二次质检理综试卷湖南省长沙市雅礼中学2020届高考6月模拟卷(一)理综化学试题(已下线)第六单元 化学反应速率和化学平衡测试题-2021年高考化学一轮复习名师精讲练【学科网名师堂】重庆市2021届高三上学期第一次预测性考试化学试题黑龙江省大庆实验中学2020-2021学年高二10月月考化学试题江西省南昌市第二中学2020-2021学年高二上学期期中考试化学试题江苏省南通市新高考2021届高三上学期期中考试化学(ⅱ卷)试题(已下线)【南昌新东方】3. 2020 高二上 南昌二中 期中考试 吴丹江西省南昌市南昌县莲塘第三中学2020-2021学年高二上学期第二次月考化学试题河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题湖南省常德市第二中学2020届高三临考冲刺理科综合化学试题河南省重点高中2021-2022学年高二上学期阶段性调研联考二化学试题江西省景德镇市乐平中学20222-2023学年高二上学期第一次月考化学试题
名校
解题方法
4 . 工业上制备硫酸的一步重要反应是 在400~500℃下的催化氧化反应:
在400~500℃下的催化氧化反应:
 。下列有关说法错误的是
。下列有关说法错误的是
 在400~500℃下的催化氧化反应:
在400~500℃下的催化氧化反应:
 。下列有关说法错误的是
。下列有关说法错误的是A.常通入过量的空气,以提高 的平衡转化率 的平衡转化率 |
| B.为提高反应速率和平衡转化率,采用的压强越大越好 |
| C.控制温度为400~500℃既能提升反应速率,又能使催化剂有较高的活性 |
| D.要综合考虑影响速率与平衡的各种因素、设备条件和经济成本等,寻找适宜的生产条件 |
您最近一年使用:0次
2023-08-12更新
|
410次组卷
|
8卷引用:安徽省六安市裕安区新安中学2023-2024学年高二下学期第一次月考化学试题
安徽省六安市裕安区新安中学2023-2024学年高二下学期第一次月考化学试题河南省周口市无锡天一企业管理有限公司等2校2022-2023学年高二上学期12月期末考试化学试题山东省鄄城县第一中学2023-2024学年高二上学期9月月考化学试题黑龙江省哈尔滨市第一中学校2023-2024学年高二上学期第一次质量检测化学试题(已下线)专题05 化学反应的方向 化学反应的调控 -【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)天津市天津中学2023-2024学年高二上学期第一次月考化学试题(已下线)寒假作业04 化学反应的方向及调控-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)四川省宜宾市叙州区第二中学校2023-2024学年高二上学期12月月考化学试题
5 . 氮气在催化剂 表面,经过电催化制备
表面,经过电催化制备 的不同机理如下图所示,下列说法错误的是
的不同机理如下图所示,下列说法错误的是

 表面,经过电催化制备
表面,经过电催化制备 的不同机理如下图所示,下列说法错误的是
的不同机理如下图所示,下列说法错误的是
| A.机理一与机理二步骤中,都有加成反应 |
| B.机理一与机理二的慢反应分别是反应③和反应⑥ |
| C.消耗等物质的量氮气,机理二产生的氨气是机理一的2倍 |
| D.氨气在阴极区生成 |
您最近一年使用:0次
名校
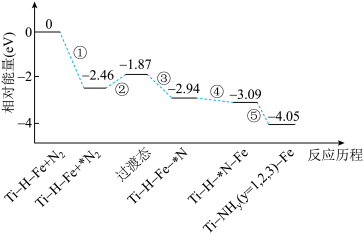
6 . 合成氨的反应历程有多种,有一种反应历程如图所示,吸附在催化剂表面的物质用*表示。下列说法错误的是

| A.催化剂的使用,并不能提高反应物的转化率 |
| B.N2生成NH3是通过多步氧化反应生成的 |
| C.两个氮原子上的加氢过程分步进行 |
| D.大量氨分子吸附在催化剂表面,将减缓反应速率 |
您最近一年使用:0次
2021-10-11更新
|
329次组卷
|
3卷引用:安徽省池州市江南中学2021-2022学年高二上学期11月月考化学试题
7 . 在自然界中有很多循环过程,其中部分无机物循环过程如下图,则下列说法不正确的是


| A.金属离子和硝酸根离子进入生物圈可能形成环境污染 |
| B.碳元素在自然界中的循环主要是通过CO2的生成和消耗来实现的 |
| C.自然界中不存在硫及其化合物的循环,因为在示意图中没能体现 |
| D.雷雨天氮气和氧气的反应属于自然固氮的一种方式 |
您最近一年使用:0次
名校
解题方法
8 . 下列说法中正确的是
| A.合成氨反应选择在400~500℃进行的重要原因是催化剂在500℃左右时的活性最大 |
| B.在工业生产条件优化时,只考虑经济性就行,不用考虑环保 |
| C.工业合成氨的反应是∆H<0、∆S<0的反应,在任何温度下都可自发进行 |
| D.在合成氨中,为增加H2的转化率,充入的N2越多越好 |
您最近一年使用:0次
2020-11-16更新
|
285次组卷
|
5卷引用:安徽省黄山市屯溪第一中学2020-2021学年高二上学期期中考试化学试题
名校
9 . 在一定条件下,利用CO2合成CH3OH的反应为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1,研究发现,反应过程中会发生副反应为CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2,温度对CH3OH、CO的产率影响如图所示。下列说法中不正确的是
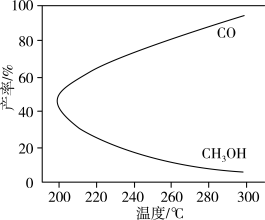

| A.△H1<0,△H2>0 |
| B.增大压强有利于加快合成反应的速率 |
| C.选用合适的催化剂可以减弱副反应的发生 |
| D.生产过程中,温度越高越有利于提高CH3OH的产率 |
您最近一年使用:0次
2020-10-18更新
|
757次组卷
|
14卷引用:安徽师范大学附属中学2020-2021学年高二上学期期中考查化学试题
安徽师范大学附属中学2020-2021学年高二上学期期中考查化学试题山东省实验中学2021届高三上学期第一次诊断考试化学试题山东省济南市莱芜一中2021届高三1月份月考化学试题选择性必修1 专题2 第三单元 课时1 影响化学平衡的因素(已下线)2.4 化学反应的调控-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)第2章 化学反应速率和化学平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)山东省栖霞市第一中学2021-2022学年高三上学期开学摸底考试化学试题(已下线)2.4 化学反应的调控(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)内蒙古霍林郭勒市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)2.4.1 合成氨生产适宜条件的选择-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)河南省南乐县第一高级中学2021-2022学年高二上学期9月半月考化学试题山东省蓬莱第二中学2021-2022学年高三上学期第一次月考化学试题微项目 探讨如何利用工业废气中的二氧化碳合成甲醇河南省商丘市宁陵县高级中学2023-2024学年高二上学期第一次考试化学试题
10 . 氮氧化物气体是造成光化学污染的主要气体,降低氮氧化物气体的排放是环境保护的重要课题。
(1)用 氧化可脱除氮氧化物。
氧化可脱除氮氧化物。
已知:①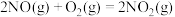
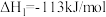
②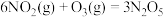
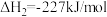
③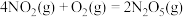
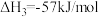
用 氧化脱除NO的总反应是:
氧化脱除NO的总反应是: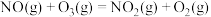 的
的
_______ ,该反应在热力学上趋势大,其原因是_______ 。
(2)氮氧化物间的相互转化,已知 的反应历程分两步:
的反应历程分两步:
第一步: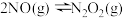 (快反应)
(快反应)
第二步: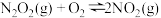 (慢反应)
(慢反应)
①总反应的速率由_______ 决定(填“第一步”或“第二步”)。
②用 表示的速率方程为
表示的速率方程为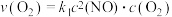 ;
; 表示的速率方程为
表示的速率方程为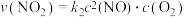 ,
, 与
与 分别表示速率常数,则
分别表示速率常数,则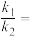
_______ (填数值)。
③下列关于反应 的说法正确的是
的说法正确的是_______ (填序号)。
A.反应的总活化能等于第一步和第二步反应的活化能之和
B.使压强增大,反应速率常数一定增大
C.第一步反应的活化能小于第二步反应的活化能
(3)电解氧化吸收法可将废气中的 转变为硝态氮。分别向
转变为硝态氮。分别向 溶液和
溶液和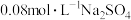 溶液(起始pH均调至9)中通入NO,测得电流强度与NO的脱除率的关系如图1所示。电解
溶液(起始pH均调至9)中通入NO,测得电流强度与NO的脱除率的关系如图1所示。电解 溶液时,溶液中相关成分的浓度变化与电流强度的关系如图2所示。
溶液时,溶液中相关成分的浓度变化与电流强度的关系如图2所示。
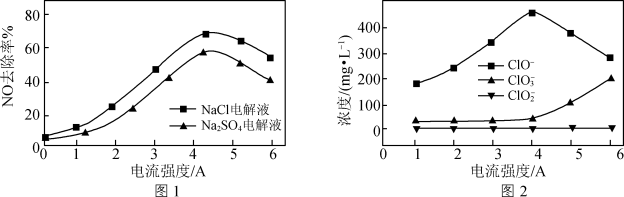
①电解 溶液时产生
溶液时产生 ,
, 氧化吸收NO的离子方程式为
氧化吸收NO的离子方程式为_______ 。
②电解NaCl溶液作吸收液时,NO的去除率始终比 溶液的大,原因是
溶液的大,原因是_______ 。
③随着电流强度的增大,电解NaCl溶液时NO去除率下降的原因是_______ 。
(1)用
 氧化可脱除氮氧化物。
氧化可脱除氮氧化物。已知:①
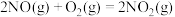
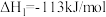
②
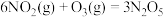
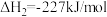
③
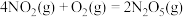
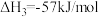
用
 氧化脱除NO的总反应是:
氧化脱除NO的总反应是: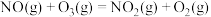 的
的
(2)氮氧化物间的相互转化,已知
 的反应历程分两步:
的反应历程分两步:第一步:
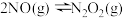 (快反应)
(快反应)第二步:
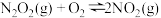 (慢反应)
(慢反应)①总反应的速率由
②用
 表示的速率方程为
表示的速率方程为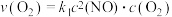 ;
; 表示的速率方程为
表示的速率方程为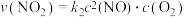 ,
, 与
与 分别表示速率常数,则
分别表示速率常数,则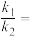
③下列关于反应
 的说法正确的是
的说法正确的是A.反应的总活化能等于第一步和第二步反应的活化能之和
B.使压强增大,反应速率常数一定增大
C.第一步反应的活化能小于第二步反应的活化能
(3)电解氧化吸收法可将废气中的
 转变为硝态氮。分别向
转变为硝态氮。分别向 溶液和
溶液和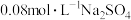 溶液(起始pH均调至9)中通入NO,测得电流强度与NO的脱除率的关系如图1所示。电解
溶液(起始pH均调至9)中通入NO,测得电流强度与NO的脱除率的关系如图1所示。电解 溶液时,溶液中相关成分的浓度变化与电流强度的关系如图2所示。
溶液时,溶液中相关成分的浓度变化与电流强度的关系如图2所示。
①电解
 溶液时产生
溶液时产生 ,
, 氧化吸收NO的离子方程式为
氧化吸收NO的离子方程式为②电解NaCl溶液作吸收液时,NO的去除率始终比
 溶液的大,原因是
溶液的大,原因是③随着电流强度的增大,电解NaCl溶液时NO去除率下降的原因是
您最近一年使用:0次



