1 . 碳单质及其化合物在生产生活中用途广泛。
I.单质碳经常应用于化学反应中。回答以下问题:
(1)炭黑可以活化氧分子得到活化氧(O*),活化氧可以快速氧化SO2,从而消除雾霾。其活化过程中的能量变化如图所示,则生成活化氧的△H=______ 0(填“>”、“<”或“=”),活化过程中有水时的活化能降低了______ eV。

(2)以焦炭为原料,在高温下与水蒸气反应可制得水煤气,涉及反应如下:
a.C(s)+H2O(g)=CO(g)+H2(g) ΔH1
b.C(s)+2H20(g)=CO2(g)+2H2(g) ΔH2=+90.3kJ·mol-1
c.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.0kJ·mol-1
①ΔH1=______ kJ·mol-1。
②对于反应a,测得在不同温度下H2O(g)的转化率如图所示,图中T1、T2、T3的大小关系为______ 。用物质的平衡分压代替物质的量浓度也可以表示化学反应的平衡常数(Kp),在T1℃、50 MPa时,反应a的平衡常数Kp=______ MPa(已知气体分压=气体总压×各气体的体积分数,结果保留两位小数)。

II.甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:CO(g)+2H2(g)=CH3OH(g)。原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
(3)在一定条件下,反应温度越高,碳转化率______ 。
(4)CO2对甲醇合成的影响是______ 。
Ⅲ.甲醇可以制备二甲醚:2CH3OH(g)=CH3OCH3(g)+H2O(g)。经查阅资料:该反应压强平衡常数的计算式为:lnKp=-2.205+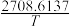 (T为热力学温度:热力学温度=摄氏度+273)。
(T为热力学温度:热力学温度=摄氏度+273)。
(5)在一定温度范围内,随温度升高,甲醇生成二甲醚的倾向______ 。(填“增大”、“减小”或“不变”)。
(6)200℃时,在密闭容器中加入一定量甲醇,反应达到平衡状态时,体系中二甲醚的物质的量分数是______ 。
A.> B.
B.  C.
C.  ~
~ D.
D.  E.<
E.< 
I.单质碳经常应用于化学反应中。回答以下问题:
(1)炭黑可以活化氧分子得到活化氧(O*),活化氧可以快速氧化SO2,从而消除雾霾。其活化过程中的能量变化如图所示,则生成活化氧的△H=

(2)以焦炭为原料,在高温下与水蒸气反应可制得水煤气,涉及反应如下:
a.C(s)+H2O(g)=CO(g)+H2(g) ΔH1
b.C(s)+2H20(g)=CO2(g)+2H2(g) ΔH2=+90.3kJ·mol-1
c.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.0kJ·mol-1
①ΔH1=
②对于反应a,测得在不同温度下H2O(g)的转化率如图所示,图中T1、T2、T3的大小关系为

II.甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:CO(g)+2H2(g)=CH3OH(g)。原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
| CO2%-CO%-H2% (体积分数) | 0-30-70 | 4-26-70 | 8-22-70 | 20-10-70 | |||||||||
| 反应温度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | |
| 碳转化率(%) | CH3OH | 4.9 | 8.8 | 11.0 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 | 8.0 | 12.0 | 22.6 |
| CH4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2.8 | 2.8 | 2.8 | |
(3)在一定条件下,反应温度越高,碳转化率
(4)CO2对甲醇合成的影响是
Ⅲ.甲醇可以制备二甲醚:2CH3OH(g)=CH3OCH3(g)+H2O(g)。经查阅资料:该反应压强平衡常数的计算式为:lnKp=-2.205+
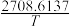 (T为热力学温度:热力学温度=摄氏度+273)。
(T为热力学温度:热力学温度=摄氏度+273)。(5)在一定温度范围内,随温度升高,甲醇生成二甲醚的倾向
(6)200℃时,在密闭容器中加入一定量甲醇,反应达到平衡状态时,体系中二甲醚的物质的量分数是
A.>
 B.
B.  C.
C.  ~
~ D.
D.  E.<
E.< 
您最近一年使用:0次
名校
2 . 钒元素用途广泛,如图是一种钒的化合物催化某反应的反应机理。下列叙述错误的是
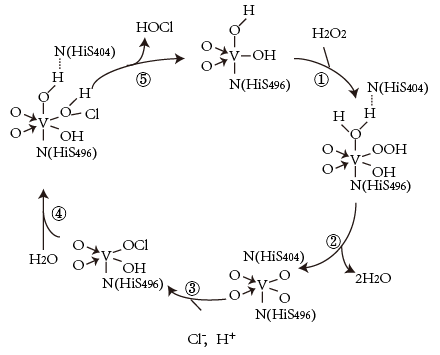

| A.H2O参与了该催化反应 |
| B.过程①中反应的原子利用率为100% |
| C.该催化循环过程中有氢氧键的断裂和形成 |
| D.每次循环的净反应为H2O2+2C1-=2HOCl+2e- |
您最近一年使用:0次
2021-04-24更新
|
1612次组卷
|
16卷引用:安徽省皖南八校2021届高三4月第三次联考理综化学试题
安徽省皖南八校2021届高三4月第三次联考理综化学试题(已下线)押山东卷第13题 陌生反应机理选择题-备战2021年高考化学临考题号押题(山东卷)(已下线)2021年高考化学押题预测卷(山东卷)03(含考试版、答题卡、参考答案、全解全析)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)2022年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷B(已下线)考点01 物质的组成、分类及转化-备战2022年高考化学学霸纠错(全国通用)新疆石河子第一中学2021-2022学年高三上学期8月月考(A卷)化学试题(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)(已下线)考点01 物质的分类和转化-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)2022年辽宁省高考真题变式题(16-19)江西省宜春市上高二中2021-2022学年高三下学期第十次月考(5月)理综化学试题(已下线)专题13 反应微观机理分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)2022年辽宁高考真题化学试题变式题(选择题6-10)(已下线)考点01 物质的分类和转化(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江西省南昌十九中2023-2024学年高三上学期第一次月考化学试卷
名校
解题方法
3 . 丙烯等不饱和烃在有机化工领域有重要的用途,工业上常采用“丙烷脱氢法”制取丙烯,反应的原理为:C3H8(g) C3H6(g)+H2(g) ΔH=+123kJ/mol
C3H6(g)+H2(g) ΔH=+123kJ/mol
回答下列问题:
(1)在石油工业中可通过___ 工艺获得丙烯等不饱和烃(填一种工艺的名称)。
(2)已知:
表中的a=___ 。
(3)工业上进行该反应时,常在丙烷中掺入稀有气体作为稀释剂,在体积可变的反应容器中,维持恒温,并使总压强恒定为0.1MPa,掺入稀有气体作为稀释剂的优点是___ ,试从平衡角度加以解释___ 。
(4)在某密闭容器中充入适量的丙烷,测得丙烷的转化率随温度和压强变化如图所示:
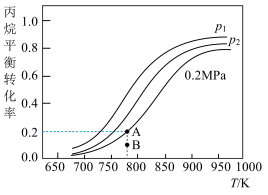
①压强p1___ p2(填“>”、“<”或“=”)。
②图中A点平衡常数Kp=___ (用平衡分压代替平衡浓度,分压=总压×物质的量分数,结果保留三位有效数字)。
③B点若达到A点所示的平衡状态则在建立平衡过程中v正___ v逆(填“>”、“<”或“=”)。
④写出一条提高丙烷平衡转化率的措施___ 。
 C3H6(g)+H2(g) ΔH=+123kJ/mol
C3H6(g)+H2(g) ΔH=+123kJ/mol回答下列问题:
(1)在石油工业中可通过
(2)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能(kJ/mol) | 412 | 348 | a | 436 |
(3)工业上进行该反应时,常在丙烷中掺入稀有气体作为稀释剂,在体积可变的反应容器中,维持恒温,并使总压强恒定为0.1MPa,掺入稀有气体作为稀释剂的优点是
(4)在某密闭容器中充入适量的丙烷,测得丙烷的转化率随温度和压强变化如图所示:

①压强p1
②图中A点平衡常数Kp=
③B点若达到A点所示的平衡状态则在建立平衡过程中v正
④写出一条提高丙烷平衡转化率的措施
您最近一年使用:0次
名校
解题方法
4 . 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
Ⅰ.CO可用于高炉炼铁,已知
Fe3O4(s)+4CO(g)====3Fe(s)+4CO2 △H1=akJ/mol
3Fe2O3(s)+ CO(g)====2Fe3O4(s)+CO2(g) △H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)的△H3=___________ kJ/mol(用含a、b的代数式表示)
Ⅱ.光气(COCl2)在塑料、制革、制药等工业中有许多用途。工业上常利用废气CO2通过反应:C(s)+CO2(g) +2CO(g) △H>0,制取合成光气的原料气CO。在体积可变的恒压(pa)密闭容器中充入1 mol CO2与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
+2CO(g) △H>0,制取合成光气的原料气CO。在体积可变的恒压(pa)密闭容器中充入1 mol CO2与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:

(1)①T℃时,在容器中若充入稀有气体,平衡___________ 移动(填“正向”“逆向”或“不”,下同);若充入等体积的CO2和CO,平衡___________ 移动。
②CO体积分数为80%时,CO2的转化率为___________ 。
③已知:气体分压(p分)=气体总压×体积分数。T℃时用平衡分压代替平衡浓度表示平衡常数Kp=___________ (用含p总的代数式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g) C6H5CH=CH2(g)+CO(g)+H2O(g)△H”中乙苯的平衡转化率影响如下图所示:
C6H5CH=CH2(g)+CO(g)+H2O(g)△H”中乙苯的平衡转化率影响如下图所示:

则△H___________ 0(填“>”“<”或“=”),压强p1、p2、p3从大到小的顺序是___________ 。
Ⅰ.CO可用于高炉炼铁,已知
Fe3O4(s)+4CO(g)====3Fe(s)+4CO2 △H1=akJ/mol
3Fe2O3(s)+ CO(g)====2Fe3O4(s)+CO2(g) △H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)的△H3=
Ⅱ.光气(COCl2)在塑料、制革、制药等工业中有许多用途。工业上常利用废气CO2通过反应:C(s)+CO2(g)
 +2CO(g) △H>0,制取合成光气的原料气CO。在体积可变的恒压(pa)密闭容器中充入1 mol CO2与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
+2CO(g) △H>0,制取合成光气的原料气CO。在体积可变的恒压(pa)密闭容器中充入1 mol CO2与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
(1)①T℃时,在容器中若充入稀有气体,平衡
②CO体积分数为80%时,CO2的转化率为
③已知:气体分压(p分)=气体总压×体积分数。T℃时用平衡分压代替平衡浓度表示平衡常数Kp=
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g)
 C6H5CH=CH2(g)+CO(g)+H2O(g)△H”中乙苯的平衡转化率影响如下图所示:
C6H5CH=CH2(g)+CO(g)+H2O(g)△H”中乙苯的平衡转化率影响如下图所示:
则△H
您最近一年使用:0次
名校
解题方法
5 . 近年来,硫化铜矿的湿法冶炼技术已经取得了很大的发展。现有一种催化氧化酸浸硫化铜矿的冶炼法,其工艺流程如图所示:
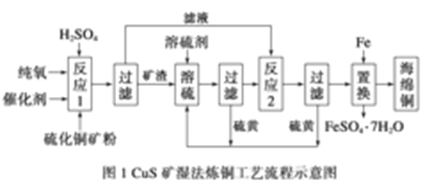
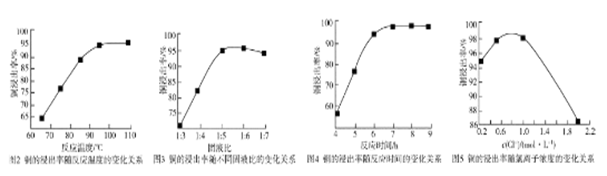
反应温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图2~如图5所示)。
回答下列问题:
(1)火法炼铜的主要反应:①2CuFeS2+4O2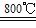 Cu2S+3SO2+2FeO(炉渣); ②2Cu2S+3O2
Cu2S+3SO2+2FeO(炉渣); ②2Cu2S+3O2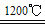 2Cu2O+2SO2;③2Cu2O+Cu2S
2Cu2O+2SO2;③2Cu2O+Cu2S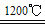 6Cu+SO2↑;则在反应①、②、③中被氧化的元素为
6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______ (填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________ NA;由amolCuFeS2生成a molCu,共消耗________ mol O2。
(2)写出反应1的化学方程式:________________ 。经查,硫黄、FeSO4·7H2O均可入药,用途广泛,湿法炼铜与火法炼铜相比,优点是_____________________ 。
(3)从溶液中得到FeSO4·7H2O晶体的操作是_______________________________ 。
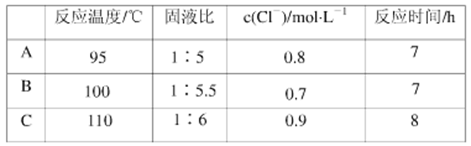
(4)根据实验以及工业生产的实验要求,从下表中得出的最佳工艺条件为________ (填字母代号)。

反应温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图2~如图5所示)。

回答下列问题:
(1)火法炼铜的主要反应:①2CuFeS2+4O2
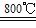 Cu2S+3SO2+2FeO(炉渣); ②2Cu2S+3O2
Cu2S+3SO2+2FeO(炉渣); ②2Cu2S+3O2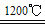 2Cu2O+2SO2;③2Cu2O+Cu2S
2Cu2O+2SO2;③2Cu2O+Cu2S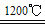 6Cu+SO2↑;则在反应①、②、③中被氧化的元素为
6Cu+SO2↑;则在反应①、②、③中被氧化的元素为(2)写出反应1的化学方程式:
(3)从溶液中得到FeSO4·7H2O晶体的操作是
(4)根据实验以及工业生产的实验要求,从下表中得出的最佳工艺条件为

您最近一年使用:0次
2017-03-16更新
|
255次组卷
|
3卷引用:安徽省定远县第三中学2018-2019学年高一下学期开学检测化学试题
安徽省定远县第三中学2018-2019学年高一下学期开学检测化学试题2017届湖南省长郡中学、衡阳八中等十三校重点中学高三第一次联考化学试卷(已下线)第5单元 常见的金属元素(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷



