1 .  既是一种重要的能源,也是一种重要的化工原料。回答下列问题:
既是一种重要的能源,也是一种重要的化工原料。回答下列问题:
(1)甲烷在高温条件下可分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是___________ 。
(2)以 为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图1所示,则通入
为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图1所示,则通入 的电极为
的电极为___________ (填“正极”或“负极”),通入 的电极反应式为
的电极反应式为___________ (质子交换膜只允许 通过)。
通过)。

(3)在一定温度和催化剂作用下, 与
与 可直接转化成乙酸,这是实现“减排”的一种研究方向。
可直接转化成乙酸,这是实现“减排”的一种研究方向。
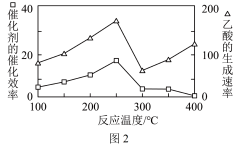
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图2所示,则该反应的最佳温度应控制在___________ 左右。
② 与
与 可直接转化成乙酸的原子利用率为
可直接转化成乙酸的原子利用率为___________ 。
(4)碳正离子[例如: 、
、 、
、 等]是有机反应中间体,
等]是有机反应中间体, 碳正离子是由
碳正离子是由 在“超强酸”中获得一个
在“超强酸”中获得一个 而得到,而
而得到,而 失去
失去 可得
可得 。
。 去掉
去掉 后生成电中性有机分子,该分子的结构简式为
后生成电中性有机分子,该分子的结构简式为___________ 。
(5) 与
与 在光照条件下可发生反应。
在光照条件下可发生反应。
①实验室中用如图3所示的装置进行实验。

在光照条件下反应一段时间后,可观察到试管中的现象为___________ 。
② 与
与 生成
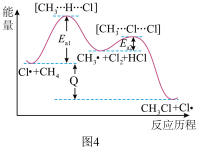
生成 的反应过程,中间态物质的能量关系见图4。有关说法不正确的是
的反应过程,中间态物质的能量关系见图4。有关说法不正确的是___________ (填字母)。
A.Cl是 在光照下化学键断裂生成的,该过程可表示为
在光照下化学键断裂生成的,该过程可表示为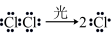
B.反应过程一定无 生成
生成
C.图示 到
到 的反应过程放出热量
的反应过程放出热量
D. 转化为
转化为 ,
, 键发生了断裂
键发生了断裂
 既是一种重要的能源,也是一种重要的化工原料。回答下列问题:
既是一种重要的能源,也是一种重要的化工原料。回答下列问题:(1)甲烷在高温条件下可分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是
(2)以
 为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图1所示,则通入
为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图1所示,则通入 的电极为
的电极为 的电极反应式为
的电极反应式为 通过)。
通过)。
(3)在一定温度和催化剂作用下,
 与
与 可直接转化成乙酸,这是实现“减排”的一种研究方向。
可直接转化成乙酸,这是实现“减排”的一种研究方向。①在不同温度下,催化剂的催化效率与乙酸的生成速率如图2所示,则该反应的最佳温度应控制在

②
 与
与 可直接转化成乙酸的原子利用率为
可直接转化成乙酸的原子利用率为(4)碳正离子[例如:
 、
、 、
、 等]是有机反应中间体,
等]是有机反应中间体, 碳正离子是由
碳正离子是由 在“超强酸”中获得一个
在“超强酸”中获得一个 而得到,而
而得到,而 失去
失去 可得
可得 。
。 去掉
去掉 后生成电中性有机分子,该分子的结构简式为
后生成电中性有机分子,该分子的结构简式为(5)
 与
与 在光照条件下可发生反应。
在光照条件下可发生反应。①实验室中用如图3所示的装置进行实验。

在光照条件下反应一段时间后,可观察到试管中的现象为
②
 与
与 生成
生成 的反应过程,中间态物质的能量关系见图4。有关说法不正确的是
的反应过程,中间态物质的能量关系见图4。有关说法不正确的是
A.Cl是
 在光照下化学键断裂生成的,该过程可表示为
在光照下化学键断裂生成的,该过程可表示为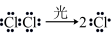
B.反应过程一定无
 生成
生成C.图示
 到
到 的反应过程放出热量
的反应过程放出热量D.
 转化为
转化为 ,
, 键发生了断裂
键发生了断裂
您最近一年使用:0次
23-24高三上·天津·阶段练习
名校
2 . 某温度下发生反应:3H2(g)+N2(g)⇌2NH3(g) ΔH=-92.4kJ/mol,N2的转化率(α)与体系总压强(p)的关系如图所示,下列说法中正确的是
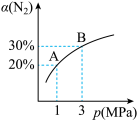

| A.将1molN2、3molH2置于1L密闭容器中发生反应,放出的热量为92.4kJ |
| B.平衡状态由A变到B时,平衡常数KA<KB |
| C.上述反应在达到平衡后,增大压强,H2的转化率增大 |
| D.合成氨工业中常采用400~500℃的高温以提高原料的转化率 |
您最近一年使用:0次
名校
解题方法
3 . 下列有关合成氨工业的说法正确的是
| A.合成氨工业的反应温度控制在400~500℃,目的是使化学平衡向正反应方向移动 |
| B.合成氨厂一般采用的压强为10MPa~30MPa,因为该压强下铁触媒的活性最高 |
| C.增大压强,正反应速率和逆反应速率均增大,但对正反应的反应速率影响更大 |
D. 的量越多, 的量越多, 的转化率越大,因此,充入的 的转化率越大,因此,充入的 越多越有利于 越多越有利于 的合成 的合成 |
您最近一年使用:0次
名校
解题方法
4 . 氧化铬绿(Cr2O3)的性质独特,在冶金、颜料等领域有着不可替代的地位。一种利用淀粉水热还原铬酸钠制备氧化铬绿的工艺流程如下:

已知:①向含少量Na2CO3的铬酸钠碱性溶液中通入CO2可制得不同碳化率的铬酸钠碳化母液;
②“还原”反应剧烈放热,可制得Cr(OH)3浆料。
(1)该工艺中“还原”反应最初使用的是蔗糖或甲醛,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式_________ 。
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误 的是_____ (填标号)。
A 该反应一定无需加热即可进行 B 必要时可使用冷却水进行温度控制
C 铬酸钠可适当过量,使淀粉充分反应 D 应建造废水回收池,回收含铬废水
(3)测得反应完成后在不同恒温温度、不同碳化率下Cr(Ⅵ)还原率如下图。实际生产过程中Cr(Ⅵ)还原率可高达99.5%以上,“还原”阶段采用的最佳反应条件为_________ 。
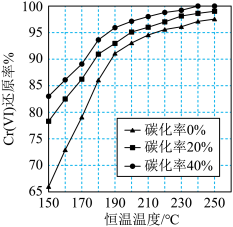
(4)滤液中所含溶质为_______ 。该水热法制备氧化铬绿工艺的优点有_________ 、________ (请写出两条)。
(5)由水热法制备的氢氧化铬为无定型氢氧化铬[Cr(OH)3·nH2O]。将洗涤并干燥后的氢氧化铬滤饼充分煅烧,质量损失与固体残留质量比为9:19,经计算得出n=_________ 。
(6)重铬酸钠(Na2Cr2O7·H2O)与硫酸铵热分解法也是一种生产氧化铬绿的方法,生产过程中产生的气体对环境无害,其化学反应方程式为_________ 。

已知:①向含少量Na2CO3的铬酸钠碱性溶液中通入CO2可制得不同碳化率的铬酸钠碳化母液;
②“还原”反应剧烈放热,可制得Cr(OH)3浆料。
(1)该工艺中“还原”反应最初使用的是蔗糖或甲醛,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法
A 该反应一定无需加热即可进行 B 必要时可使用冷却水进行温度控制
C 铬酸钠可适当过量,使淀粉充分反应 D 应建造废水回收池,回收含铬废水
(3)测得反应完成后在不同恒温温度、不同碳化率下Cr(Ⅵ)还原率如下图。实际生产过程中Cr(Ⅵ)还原率可高达99.5%以上,“还原”阶段采用的最佳反应条件为

(4)滤液中所含溶质为
(5)由水热法制备的氢氧化铬为无定型氢氧化铬[Cr(OH)3·nH2O]。将洗涤并干燥后的氢氧化铬滤饼充分煅烧,质量损失与固体残留质量比为9:19,经计算得出n=
(6)重铬酸钠(Na2Cr2O7·H2O)与硫酸铵热分解法也是一种生产氧化铬绿的方法,生产过程中产生的气体对环境无害,其化学反应方程式为
您最近一年使用:0次
2020-03-13更新
|
697次组卷
|
4卷引用:甘肃省兰州市第一中学2020届高三冲刺模拟考试(三)理科综合化学试题
甘肃省兰州市第一中学2020届高三冲刺模拟考试(三)理科综合化学试题广东省深圳市2020年普通高中高三年级线上统一测试(全国I卷)理综化学试题湖北省黄冈中学2020届高三化学测试(已下线)学科网2020年5月高三大联考考后强化卷(新课标Ⅰ卷)化学试题
名校
5 . 下列说法中正确的是
A.已知 t1℃时,反应 C(g)+CO2(g)  2CO(g) ΔH >0 的速率为 υ,若升高温度,逆反应速率减小 2CO(g) ΔH >0 的速率为 υ,若升高温度,逆反应速率减小 |
B.恒压容器中发生反应 N2(g)+O2(g)  2NO(g),若在容器中充入 He,正逆反应速率均不变 2NO(g),若在容器中充入 He,正逆反应速率均不变 |
| C.当一定量的锌粉和过量的 6mol•L-1盐酸反应时,为了减慢反应速率,又不影响产生 H2的总量,可向反应器中加入少量的 CuSO4溶液 |
D.对于工业合成氨反应 N2(g)+3H2(g)  2NH3(g) ΔH﹤0,选用 450℃主要为了提高催化剂(铁触媒)的催化效率 2NH3(g) ΔH﹤0,选用 450℃主要为了提高催化剂(铁触媒)的催化效率 |
您最近一年使用:0次
名校
6 . Burns和Dainton研究发现Cl2与CO合成COCl2的反应机理如下:
①Cl2(g)⇌2Cl•(g) 快
②CO(g)+Cl•(g)⇌COCl•(g) 快
③COCl•(g)+Cl2(g)⇌COCl2(g)+Cl•(g) 慢
反应②的速率方程为v正=k正c(CO)×c(Cl•),v逆=k逆c(COCl•)。下列说法错误的是
①Cl2(g)⇌2Cl•(g) 快
②CO(g)+Cl•(g)⇌COCl•(g) 快
③COCl•(g)+Cl2(g)⇌COCl2(g)+Cl•(g) 慢
反应②的速率方程为v正=k正c(CO)×c(Cl•),v逆=k逆c(COCl•)。下列说法错误的是
| A.反应①的活化能大于反应③的活化能 |
B.反应②的平衡常数K= |
| C.要提高合成COCl2的速率,关键是提高反应③的速率 |
| D.选择合适的催化剂能提高单位时间内COCl2的产率 |
您最近一年使用:0次
2021-01-28更新
|
597次组卷
|
7卷引用:甘肃省金昌市永昌县第一高级中学2022-2023学年高二上学期第一次月考化学试题
7 . 在加热、催化剤作用下2SO2(g)+O2(g) 2SO3(g)下列说法不正确的是( )
2SO3(g)下列说法不正确的是( )
 2SO3(g)下列说法不正确的是( )
2SO3(g)下列说法不正确的是( )| A.在相同条件下,该反应中分别用SO2和O2表示的v,数值不同,但该反应的快慢程度是一致的 |
| B.该反应加入催化剂的目的是为了加快反应速率 |
| C.为了提高SO2的转化率,减少污染物的排放,常常在实际生产中,O2和SO2的投入量之比大于1:2 |
| D.在密闭容器中,投入2 mol SO2和l mol O2,反应结束时生成的2 mol SO3 |
您最近一年使用:0次
名校
8 . 化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面的说法错误的是( )
| A.能够节约原料和能源 | B.能够提高产品的产量 |
| C.能够提高经济效益 | D.能够提高化学反应速率 |
您最近一年使用:0次
2016-12-09更新
|
1260次组卷
|
16卷引用:【全国百强校】甘肃省会宁县第一中学2017-2018学年高一下学期期中考试化学试题
【全国百强校】甘肃省会宁县第一中学2017-2018学年高一下学期期中考试化学试题【全国百强校】甘肃省会宁县第一中学2017-2018学年高一下学期期末考试化学试题(已下线)2010—2011学年江西省赣州市高一下学期十一县市期中联考化学试卷(已下线)2011-2012年浙江温州龙湾中学高一期中考试理科化学试卷贵州省毕节市纳雍县第一中学2018-2019学年高一下学期期末考试化学试题河北省宣化市第一中学2019-2020学年高一11月月考化学试题(已下线)2.4 化学反应的调控(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(已下线)6.2.2 化学反应的限度(练好题)(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)(已下线)第14讲 化学反应的限度(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)江苏省徐州市睢宁县2021-2022学年高一下学期期中考试(线上)化学试题宁夏吴忠中学2021-2022学年高一下学期期中考试化学试题广西桂林市第十九中学2021-2022学年高一下学期期中考试化学试题(已下线)课时5化学反应条件的控制河北省唐县第一中学2022-2023学年高一下学期3月月考化学试题第2课时 化学反应的限度、化学反应条件的控制1四川省兴文第二中学校2023-2024学年高二上学期11月期中考试化学试题
名校
9 . 硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产.下列对于反应 2SO2+O2  2SO3的说法中正确的是
2SO3的说法中正确的是
 2SO3的说法中正确的是
2SO3的说法中正确的是| A.只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
| C.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零 |
| D.在达到平衡的体系中,充入由18O原子组成的O2后,18O仅存在于SO2和SO3中 |
您最近一年使用:0次
2017-05-05更新
|
300次组卷
|
4卷引用:甘肃省兰州交大东方中学2019-2020学年高二上学期期中考试化学试题
甘肃省兰州交大东方中学2019-2020学年高二上学期期中考试化学试题江西省九江第一中学2016-2017学年高一下学期期中考试化学试题(已下线)2.4 化学反应的调控(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)天津市宝坻九中2020-2021学年高二上学期第一次月考化学试题
10 . 目前,我国采用“接触法”制硫酸,设备如图所示:
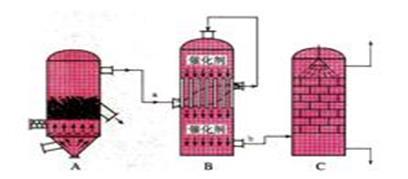
(1)图中设备A的名称是______________ ,该设备中主要反应的化学方程式为____________ 。
(2)有关接触法制硫酸的下列说法中,不正确的是______________________
(3)用18 mol/L 的浓硫酸配制100 mL 3.6 mol/L 稀硫酸,所需浓硫酸的体积是_______ 。

(1)图中设备A的名称是
(2)有关接触法制硫酸的下列说法中,不正确的是
| A.二氧化硫的接触氧化在接触室中发生 |
| B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫 |
| C.B装置中反应的条件之一为较高温度是为了提高SO2的转化率 |
| D.硫酸工业中在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
(3)用18 mol/L 的浓硫酸配制100 mL 3.6 mol/L 稀硫酸,所需浓硫酸的体积是
您最近一年使用:0次



