1 . 氮氧化物的转化和综合利用既有利于节约资源,又有利于保护环境。
(1)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g) 2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2)∶n(O2)=2∶1],测得容器内总压强与反应时间的关系如图所示。
2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2)∶n(O2)=2∶1],测得容器内总压强与反应时间的关系如图所示。

①图中A点时,SO2的转化率为___________ 。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率v(C)正与A点的逆反应速率v(A)逆的大小关系为v(C)正___________ v(A)逆(填“>”“<”或 “=”)。
③图中B点的压强平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90 s的情况下,测得不同条件下NO的脱氮率如图Ⅰ、Ⅱ所示。

①由图Ⅰ知,当废气中的NO含量增加时,宜选用___________ 法提高脱氮效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,其可能原因为___________ 。
(3)研究表明:NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。

①写出废气中的SO2与NaClO2反应的离子方程式:___________ 。
②温度高于60 ℃后,NO去除率随温度升高而下降的原因为___________
(1)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g)
 2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2)∶n(O2)=2∶1],测得容器内总压强与反应时间的关系如图所示。
2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2)∶n(O2)=2∶1],测得容器内总压强与反应时间的关系如图所示。
①图中A点时,SO2的转化率为
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率v(C)正与A点的逆反应速率v(A)逆的大小关系为v(C)正
③图中B点的压强平衡常数Kp=
(2)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90 s的情况下,测得不同条件下NO的脱氮率如图Ⅰ、Ⅱ所示。

①由图Ⅰ知,当废气中的NO含量增加时,宜选用
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,其可能原因为
(3)研究表明:NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。

①写出废气中的SO2与NaClO2反应的离子方程式:
②温度高于60 ℃后,NO去除率随温度升高而下降的原因为
您最近一年使用:0次
2 . 现代工业的发展导致CO2大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,现已开发出多项将CO2回收利用的技术。某科研小组提出CO2催化加氢合成乙烯。回答下列问题:
(1)已知:H2(g)、C2H4(g)的燃烧热(∆H)分别为-285.8 kJ·mol-1、-1411 kJ·mol-1,
H2O(g)=H2O(l) ∆H=-44 kJ·mol-1。
则2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ∆H=
C2H4(g)+4H2O(g) ∆H=__ kJ·mol-1。
(2)某科研小组利用含铁复合催化剂催化合成乙烯,其反应机理如图:
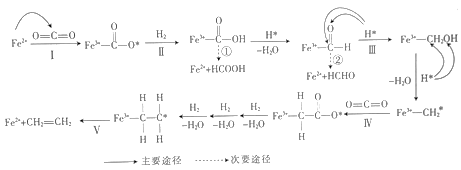
在上述反应途径中,生成的副产物主要有__ (填化学式),写出反应Ⅱ的化学方程式:__ 。
(3)在使用不同催化剂的作用下可发生CO2(g)+4H2(g) CH4(g)+2H2O(g)。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。在起始压强为2 MPa、气体流速为20 mL·min-1'时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如表:
CH4(g)+2H2O(g)。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。在起始压强为2 MPa、气体流速为20 mL·min-1'时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如表:
①分析表中数据可知:催化剂___ (填标号)的催化性能更好。
②调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如表:
分析表中数据可知:相同温度时,随着气体流速增大,CO2的转化率__ (填“增大”或“减小”),其可能的原因是__ 。
③在上述实验条件中,反应肯定达到化学平衡状态的温度是__ ℃。
(4)在温度为T ℃时,将2 mol CO2和6 mol H2通入压强为p的恒容密闭容器内,使用含铁复合催化剂发生反应2CO2(g)+6H2(g) C2H4(g)+4H2O(g)(副产物含量较少,可忽略)。实验测得反应达到平衡时,CO2的转化率为80%、则Kp=
C2H4(g)+4H2O(g)(副产物含量较少,可忽略)。实验测得反应达到平衡时,CO2的转化率为80%、则Kp=___ (列出计算式即可)。
(1)已知:H2(g)、C2H4(g)的燃烧热(∆H)分别为-285.8 kJ·mol-1、-1411 kJ·mol-1,
H2O(g)=H2O(l) ∆H=-44 kJ·mol-1。
则2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) ∆H=
C2H4(g)+4H2O(g) ∆H=(2)某科研小组利用含铁复合催化剂催化合成乙烯,其反应机理如图:

在上述反应途径中,生成的副产物主要有
(3)在使用不同催化剂的作用下可发生CO2(g)+4H2(g)
 CH4(g)+2H2O(g)。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。在起始压强为2 MPa、气体流速为20 mL·min-1'时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如表:
CH4(g)+2H2O(g)。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。在起始压强为2 MPa、气体流速为20 mL·min-1'时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如表: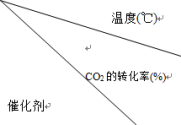 | 180 | 200 | 220 | 280 | 300 | 320 | 340 | 360 |
| a | 5.0 | 15.3 | 33.5 | 64.8 | 80.1 | 82.7 | 95.6 | 91.1 |
| b | 0.5 | 1.2 | 3.8 | 24.5 | 36.8 | 51.6 | 61.1 | 60.0 |
②调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如表:
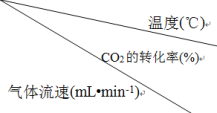 | 180 | 200 | 220 | 280 | 300 | 320 | 340 | 360 |
| 10 | 8.0 | 20.3 | 38.5 | 78.8 | 89.2 | 95.8 | 98.8 | 98.0 |
| 20 | 3.0 | 13.3 | 30.5 | 60.8 | 78.1 | 81.7 | 91.6 | 90.0 |
| 30 | 1.2 | 10.4 | 25.5 | 58.8 | 72.2 | 74.8 | 76.2 | 75.3 |
| 40 | 1.0 | 8.9 | 24.3 | 55.6 | 70.1 | 73.9 | 74.1 | 73.6 |
③在上述实验条件中,反应肯定达到化学平衡状态的温度是
(4)在温度为T ℃时,将2 mol CO2和6 mol H2通入压强为p的恒容密闭容器内,使用含铁复合催化剂发生反应2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)(副产物含量较少,可忽略)。实验测得反应达到平衡时,CO2的转化率为80%、则Kp=
C2H4(g)+4H2O(g)(副产物含量较少,可忽略)。实验测得反应达到平衡时,CO2的转化率为80%、则Kp=
您最近一年使用:0次
解题方法
3 . SO2 是危害最为严重的大气污染物之一,SO2 的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理 SO2。催化还原 SO2 不仅可以消除 SO2 污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4 可使 SO2 转化为 S,同时生成 CO2 和 H2O。已知 CH4 和 S的燃烧热分别为 890.3 kJ /mol 和 297.2 kJ /mol , CH4 和 SO2 反应的热化学方程式为__________ 。
(2)用 H2 还原 SO2 生成S 的反应分两步完成,如图 1 所示,该过程中相关物质的物质的量浓度随时间的 变化关系如图 2 所示:

①分析可知X 为______ 写化学式),0~t1 时间段的温度为_____ ,0~t1 时间段用SO2 表示的化学反应速率为_____ 。
②总反应的化学方程式为____________ 。
(1)在复合组分催化剂作用下,CH4 可使 SO2 转化为 S,同时生成 CO2 和 H2O。已知 CH4 和 S的燃烧热分别为 890.3 kJ /mol 和 297.2 kJ /mol , CH4 和 SO2 反应的热化学方程式为
(2)用 H2 还原 SO2 生成S 的反应分两步完成,如图 1 所示,该过程中相关物质的物质的量浓度随时间的 变化关系如图 2 所示:

①分析可知X 为
②总反应的化学方程式为
您最近一年使用:0次
解题方法
4 . 二氧化硫是危害最为严重的大气污染物之一,它主要来自化石燃料的燃烧,研究CO催化还原SO2的适宜条件,在燃煤电厂的烟气脱硫中具有重要价值。
Ⅰ.从热力学角度研究反应
(1)C(s)+O2(g)= CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+172.5kJ·mol-1
S(s) +O2(g)= SO2(g) ΔH3=-296.0kJ·mol-1
请写出CO 还原SO2的热化学方程式___________________________________ 。
(2)对于CO还原SO2的可逆反应,下列说法正确的是_____________ 。
A.在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态
B.平衡状态时,2v正(CO)=v逆(SO2)
C.其他条件不变,增加SO2的浓度,CO的平衡转化率增大
D.在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
Ⅱ.探究合适的反应条件
向反应器中通入含3%SO2、6%CO和91%N2的烟气,用碘量法测定反应前后烟气中SO2的含量,反应温度区间均为300℃~500℃。
(1)催化剂和温度对反应的影响
烟气流量为0.03 L/min,分别在3种不同催化剂条件下进行实验,实验结果如下图所示。
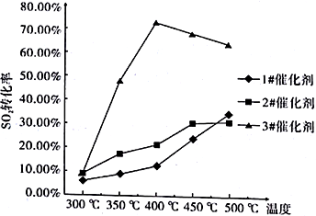
根据上图示结果,烟气除硫时选用最合适催化剂是_____________ ,反应温度是_______________ 。
(2)烟气流速对反应的影响
选用同样的催化剂,分别在三种烟气流量情况下进行实验,实验结果的数据见下表。
分析上表数据,①在300℃时,SO2的转化率随烟气流量变化的关系是______________ ,其原因可能是____________ ;②在400℃时,SO2的转化率随烟气流量增大而增大的原因是___________________ 。
Ⅲ.工业上还用Na2SO3溶液吸收SO2,将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6 时,吸收SO2的能力显著下降,此时溶液中c(HSO3-)∶c(SO32-)=____________ 。(已知H2SO3的K1=1.5×10-2、K2=1.0×10-7)
Ⅰ.从热力学角度研究反应
(1)C(s)+O2(g)= CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+172.5kJ·mol-1
S(s) +O2(g)= SO2(g) ΔH3=-296.0kJ·mol-1
请写出CO 还原SO2的热化学方程式
(2)对于CO还原SO2的可逆反应,下列说法正确的是
A.在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态
B.平衡状态时,2v正(CO)=v逆(SO2)
C.其他条件不变,增加SO2的浓度,CO的平衡转化率增大
D.在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
Ⅱ.探究合适的反应条件
向反应器中通入含3%SO2、6%CO和91%N2的烟气,用碘量法测定反应前后烟气中SO2的含量,反应温度区间均为300℃~500℃。
(1)催化剂和温度对反应的影响
烟气流量为0.03 L/min,分别在3种不同催化剂条件下进行实验,实验结果如下图所示。

根据上图示结果,烟气除硫时选用最合适催化剂是
(2)烟气流速对反应的影响
选用同样的催化剂,分别在三种烟气流量情况下进行实验,实验结果的数据见下表。
| 温度(℃) | 300 | 400 | 500 | |
| SO2转化率 | 流量0.03 L/min | 25.00% | 71.40% | 65.00% |
| 流量 0.06 L/min | 20% | 74.20% | 62.60% | |
| 流量0.09 L/min | 18% | 76.30% | 60% | |
分析上表数据,①在300℃时,SO2的转化率随烟气流量变化的关系是
Ⅲ.工业上还用Na2SO3溶液吸收SO2,将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6 时,吸收SO2的能力显著下降,此时溶液中c(HSO3-)∶c(SO32-)=
您最近一年使用:0次
2018-03-24更新
|
315次组卷
|
2卷引用:甘肃省白银市第十中学2019-2020学年高二上学期期中考试化学试题
名校
5 . 甲醇水蒸气重整制氢(SRM)系统简单,产物中H2 含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。反应如下:
反应Ⅰ(主) :CH3OH(g)+ H2O(g) CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
反应Ⅱ(副) :H2(g)+ CO2(g) CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol
温度高于300℃则会同时发生反应Ⅲ: CH3OH(g) CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)计算反应Ⅲ的ΔH3=_________ 。
(2)反应1能够自发进行的原因是_______________ ,升温有利于提高CH3OH转化率,但也存在一个明显的缺点是__________ 。
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是____________ (填标号)。
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是______ 。
③写出一条能提高CH3OH转化率而降低CO生成率的措施_________ 。
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率_________ ,反应Ⅱ的平衡常数_________ (结果保留两位有效数字)
反应Ⅰ(主) :CH3OH(g)+ H2O(g)
 CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol反应Ⅱ(副) :H2(g)+ CO2(g)
 CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol温度高于300℃则会同时发生反应Ⅲ: CH3OH(g)
 CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3(1)计算反应Ⅲ的ΔH3=
(2)反应1能够自发进行的原因是
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是
③写出一条能提高CH3OH转化率而降低CO生成率的措施
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率
您最近一年使用:0次
2018-01-19更新
|
2031次组卷
|
10卷引用:甘肃省兰州市第一中学2020-2021学年高二上学期期中考试化学(理)试题
甘肃省兰州市第一中学2020-2021学年高二上学期期中考试化学(理)试题广东省佛山市普通高中2018届高三教学质量检测(一)化学试题河北省衡水中学2018届高三第十五次模拟理科综合化学试题【全国百强校】河南省林州市第一中学2017-2018学年高二5月月考化学试题【全国百强校】河南省信阳高级中学2018届高三第四次模拟考试化学试题山西省大同市第二中学2020届高三3月月考理综化学试题(已下线)【浙江新东方】高中化学20210513-044【2021】【高二下】辽宁省沈阳市实验中学2021-2022学年高一上学期10月月考化学试题2021年天津高考化学试题变式题13-162020届高三化学二轮冲刺新题专练——化学反应原理综合题
10-11高三上·甘肃天水·阶段练习
6 . 为研究和开发天然食用色素。某研究小组取等量相同品种的红枣,采用溶剂提取红枣中部分红色素,用紫外光谱仪测定不同温度下提取液的吸光度,实验结果见右图。已知吸光度越大,红色素含量越高。下列分析较合理的是
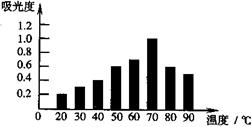

| A.20℃时,红枣中红色素含量最低 |
| B.吸光度越大,红枣中红色素含量越高 |
| C.红色素可能在较高温度下不稳定 |
| D.温度越高,提取液中红色素含量越高 |
您最近一年使用:0次



