1 . 纯碱是一种重要的化工原料,具有广泛的用途。实验室利用氯化钠和碳酸氢铵制备纯碱并测定产品中碳酸氢钠的含量,具体步骤如下:
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
步骤ⅱ.制备纯碱
在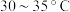 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸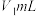 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。
已知:相关物质的溶解度如下
说明:“—”表示该物质在相应温度下已开始分解。
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为________________ ;
(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为________________ ;
(3)步骤ⅱ中,选择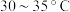 水浴的原因为
水浴的原因为________________ ;
(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为________________ ;
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的________ (填仪器名称);________ ;滴定过程中,盐酸需要逐滴加入并不断振荡的原因为________________ ;选择指示剂N时,滴定终点溶液颜色变化为________________ ;
(7)产品中碳酸氢钠的质量分数为________ (用含字母的代数式表示)。
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和
 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。步骤ⅱ.制备纯碱
在
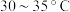 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用
 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸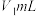 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。已知:相关物质的溶解度如下
温度 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| 15.8 | 21.0 | 27.0 | — | — | — | — |
| 8.15 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
| 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为
 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为
(3)步骤ⅱ中,选择
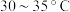 水浴的原因为
水浴的原因为(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的
(7)产品中碳酸氢钠的质量分数为
您最近一年使用:0次
2024-06-01更新
|
157次组卷
|
3卷引用:河北省石家庄市2024届普通高中学校高三毕业年级教学质量检测(三)化学试卷
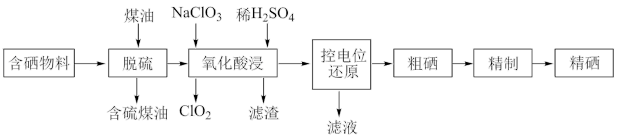
2 . 随着人们对硒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以硫铁矿生产硫酸过程中产生的含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)提取硒,设计流程如下:______ 。最佳温度是________ 。
(2)“氧化酸浸”中,Se转化成H2SeO3,该反应的离子方程式为_____________ 。
(3)采用硫脲[(NH2)2CS]联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。下表是“氧化酸浸”液中主要粒子的电位。
①控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2。该过程的还原反应(半反应)式为___________ 。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在_____ V。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(S2-)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为________ ,精硒中基本不含铜。[Ksp(CuS)=1.3×10-36]
②硒代硫酸钠酸化生成硒的化学方程式为____________ 。
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数为________ %,与粗硒中铁含量为0.89%相比,铁含量明显降低。

(2)“氧化酸浸”中,Se转化成H2SeO3,该反应的离子方程式为
(3)采用硫脲[(NH2)2CS]联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。下表是“氧化酸浸”液中主要粒子的电位。
| 名称 | Cu2+/Cu | Zn2+/Zn | Fe2+/Fe | Fe3+/Fe2+ | ClO2/Cl- | H2SeO3/Se |
| 电位/V | 0.345 | -0.760 | -0.440 | 0.770 | 1.511 | 0.740 |
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(S2-)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为
②硒代硫酸钠酸化生成硒的化学方程式为
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数为
您最近一年使用:0次
2020-02-11更新
|
835次组卷
|
6卷引用:河北省衡水中学2020届高三下学期一调理综化学试题
河北省衡水中学2020届高三下学期一调理综化学试题福建省宁德市2019-2020学年高三上学期期末质量检测理综化学试题(已下线)2020届高三《新题速递·化学》2月第01期(考点10-12)(已下线)考点17 化工生产诸要素及流程图分析-2020年高考化学命题预测与模拟试题分类精编湖北省武汉市华中师大一附中高三理科四调综合训化学试题(已下线)微专题35 非金属及其化合物制备流程与实验探究(S、Se、Te、Cl、Br、I)-备战2022年高考化学考点微专题
名校
3 . 工业合成氨是人类科学技术的一项重大突破。回答下列问题:
(1)合成氨工业中采用循环操作,主要是为了________ (填选项字母)。
(2)在密闭容器中通入amolN2和6molH2,若在一定条件下反应达到平衡状态,容器中剩余cmolN2。
①达到平衡时,H2转化率为________ 。
②若把容器的体积扩大一倍,则正反应速率_______ (填“增大”、“减小”或“不变”,下同),逆反应速率________ ,H2的转化率_______ 。
(3)研究发现铁催化剂表面上合成氨的反应历程如图所示,其中吸附在铁催化剂表面上的微粒用*标注。
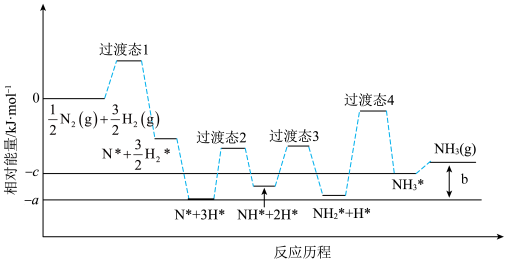
该反应历程中最大活化能对应步骤的化学方程式为_______ 。合成氨反应: N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g)的△H=
NH3(g)的△H=_______ kJ/mol(用图中字母表示)。
(1)合成氨工业中采用循环操作,主要是为了
| A.增大化学反应速率 | B.提高氮气和氢气的利用率 |
| C.降低氨的沸点 | D.提高平衡混合物中氨的含量 |
(2)在密闭容器中通入amolN2和6molH2,若在一定条件下反应达到平衡状态,容器中剩余cmolN2。
①达到平衡时,H2转化率为
②若把容器的体积扩大一倍,则正反应速率
(3)研究发现铁催化剂表面上合成氨的反应历程如图所示,其中吸附在铁催化剂表面上的微粒用*标注。

该反应历程中最大活化能对应步骤的化学方程式为
 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g)的△H=
NH3(g)的△H=
您最近一年使用:0次
4 . 合成氨工业采用循环操作的主要目的是

| A.增大氮气和氢气的浓度 | B.节省能量,有利于气态氨的冷却 |
| C.提高氮气和氢气的利用率 | D.提高平衡混合物中 的百分含量 的百分含量 |
您最近一年使用:0次
名校
5 . 以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废矾催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为
以下是一种废钒催化剂回收工艺路线:
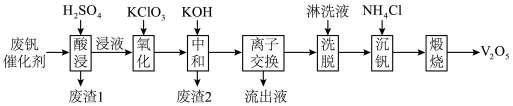
回答下列问题:
(1)已知“酸浸”时,V2O5转化为 ,V2O4转化成
,V2O4转化成 ,请写出废钒催化剂“酸浸”时发生反应的所有离子方程式
,请写出废钒催化剂“酸浸”时发生反应的所有离子方程式_____ 、____ 、_____ 、____ 。
(2)工艺中“氧化”步骤使 变为
变为 反应的离子方程式为
反应的离子方程式为________ 。
(3)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为: Mn2++ +H2O→H++
+H2O→H++ +
+
①请配平上述离子方程式_____ ;
(4)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
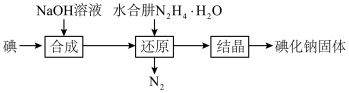
在“还原”过程中,主要消耗反应过程中生成的副产物 ,该过程的离子方程式为:
,该过程的离子方程式为:________ 。
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)已知“酸浸”时,V2O5转化为
 ,V2O4转化成
,V2O4转化成 ,请写出废钒催化剂“酸浸”时发生反应的所有离子方程式
,请写出废钒催化剂“酸浸”时发生反应的所有离子方程式(2)工艺中“氧化”步骤使
 变为
变为 反应的离子方程式为
反应的离子方程式为(3)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为: Mn2++
 +H2O→H++
+H2O→H++ +
+
①请配平上述离子方程式
(4)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:

在“还原”过程中,主要消耗反应过程中生成的副产物
 ,该过程的离子方程式为:
,该过程的离子方程式为:
您最近一年使用:0次
解题方法
6 . H2O2可降解废水中的有机物,活性炭(AC)能促进H2O2分解产生羟基自由基(·OH),提高对水中有机化合物的降解率。实验表明,AC表面的酸碱性会影响H2O2的分解反应。实验室中,将纯化的AC在氮气(60mL·min-1)和氨气(20mL·min-1)气氛中于650℃下热处理2h可制得氨气改性活性炭(ACN)。回答下列问题:
(1)纯化AC:将AC研磨后置于10%盐酸中浸泡6h除去灰分,用蒸馏水洗涤至中性。研磨的目的是_______ 。为了防止放置过程中再次吸水,烘干后的AC应置于干燥器中备用。
(2)制备ACN;
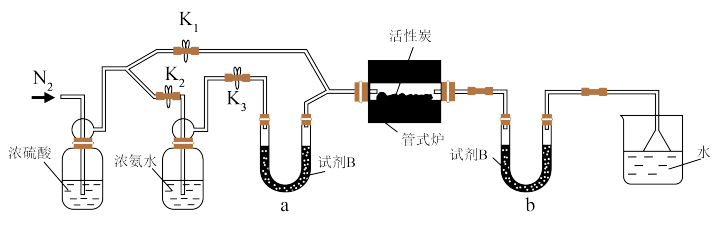
检查装置气密性并加入药品后,加热前应进行的操作是通入氮气,其目的是_______ ;一段时间后,打开电炉并加热反应管,此时活塞K1、K2、K3的状态为_______ 。U形管b内试剂B的作用是_______ 。
(3)通过氨气改性处理后,得到的ACN表面仍有少量羧基和酚羟基,其含量可采用滴定法测定。测定羧基含量的方法:在锥形瓶中加入0.5g ACN,加入a mL 0.05mol·L-1的X溶液。上恒温摇床,吸附平衡。以甲基橙作指示剂,用0.1 mol·L-1的标准盐酸反滴定剩余的X溶液,标准盐酸的平均用量为b mL。则X为_______ (填“NaOH”“Na2CO3”或“NaHCO3”),计算所得活性炭表面的羧基含量为_______ mol·kg-1(已知:ACN中,羧基的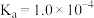 、酚羟基的
、酚羟基的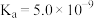 、碳酸的
、碳酸的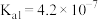 、
、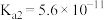 ;用含a、b的代数式表示)。
;用含a、b的代数式表示)。
(4)某课题组以2500 mg·L-1苯酚溶液为模型废水,研究AC与ACN表面的酸碱性对H2O2降解苯酚的影响,得到如下图象:
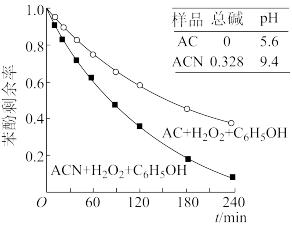
由图象可知,_______ (填“AC”或“ACN”)更有利于H2O2降解苯酚,原因是_______ 。
(1)纯化AC:将AC研磨后置于10%盐酸中浸泡6h除去灰分,用蒸馏水洗涤至中性。研磨的目的是
(2)制备ACN;

检查装置气密性并加入药品后,加热前应进行的操作是通入氮气,其目的是
(3)通过氨气改性处理后,得到的ACN表面仍有少量羧基和酚羟基,其含量可采用滴定法测定。测定羧基含量的方法:在锥形瓶中加入0.5g ACN,加入a mL 0.05mol·L-1的X溶液。上恒温摇床,吸附平衡。以甲基橙作指示剂,用0.1 mol·L-1的标准盐酸反滴定剩余的X溶液,标准盐酸的平均用量为b mL。则X为
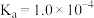 、酚羟基的
、酚羟基的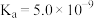 、碳酸的
、碳酸的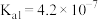 、
、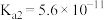 ;用含a、b的代数式表示)。
;用含a、b的代数式表示)。(4)某课题组以2500 mg·L-1苯酚溶液为模型废水,研究AC与ACN表面的酸碱性对H2O2降解苯酚的影响,得到如下图象:

由图象可知,
您最近一年使用:0次
20-21高三下·全国·阶段练习
7 . 近年来随着新能源汽车的推广使用,产生了大量的废旧三元锂电池,其正极材料主要含铝、锂、镍、钴、锰等元素,对正极材料进行回收处理的某种工艺流程如图所示:
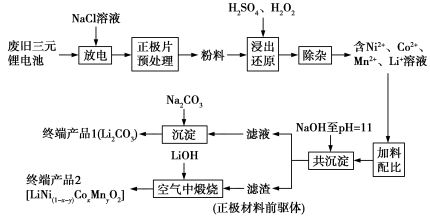
已知:
①共沉淀制备正极材料前驱体发生的反应:Li2SO4+(1−x−y)NiSO4+xCoSO4+yMnSO4+4NaOH=Ni(1−x−y)CoxMny(OH)2↓+2LiOH+2Na2SO4。
②金属离子浸出率(η)的计算公式为η= ×100%。其中c为金属离子的质量浓度,单位为g·mL−1;V为滤液的体积,单位为mL;m为粉料中该金属的理论质量,单位为g。
×100%。其中c为金属离子的质量浓度,单位为g·mL−1;V为滤液的体积,单位为mL;m为粉料中该金属的理论质量,单位为g。
回答下列问题:
(1)回收处理时首先对废旧锂电池进行放电,目的是防止在电池拆解过程中,发生短路引起火灾、爆炸等事故。用NaCl溶液浸泡后,放电过程中可能产生的气体有_______ ;将正极片预处理得到粉料的目的是_______ 。
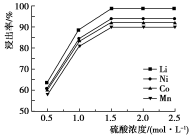
(2)硫酸浓度对金属浸出率的影响如图所示,则酸浸还原时,最佳的硫酸浓度为_______ 。
(3)在除杂阶段,加入NH4HCO3溶液除去溶液中的Al3+,其反应的离子方程式为_______ 。
(4)沉淀完成后得到终端产品1(Li2CO3)的操作有_______ ;写出正极材料前驱体在空气中煅烧得到终端产品2[LiNi(1−x−y)CoxMnyO2]的化学方程式:_______ 。
(5)浸出实验首先在三颈烧瓶中加入适量的H2SO4和H2O2,再将准确称量的5.00 g粉料(其中钴元素含量为18.00%)倒入,反应后将其过滤,定容得溶液的体积为50.00 mL,采用电感耦合等离子体光谱仪测定浸出滤液中Co2+的浓度为17.28 mg·mL−1,则Co2+的浸出率为_______ 。

已知:
①共沉淀制备正极材料前驱体发生的反应:Li2SO4+(1−x−y)NiSO4+xCoSO4+yMnSO4+4NaOH=Ni(1−x−y)CoxMny(OH)2↓+2LiOH+2Na2SO4。
②金属离子浸出率(η)的计算公式为η=
 ×100%。其中c为金属离子的质量浓度,单位为g·mL−1;V为滤液的体积,单位为mL;m为粉料中该金属的理论质量,单位为g。
×100%。其中c为金属离子的质量浓度,单位为g·mL−1;V为滤液的体积,单位为mL;m为粉料中该金属的理论质量,单位为g。回答下列问题:
(1)回收处理时首先对废旧锂电池进行放电,目的是防止在电池拆解过程中,发生短路引起火灾、爆炸等事故。用NaCl溶液浸泡后,放电过程中可能产生的气体有
(2)硫酸浓度对金属浸出率的影响如图所示,则酸浸还原时,最佳的硫酸浓度为

(3)在除杂阶段,加入NH4HCO3溶液除去溶液中的Al3+,其反应的离子方程式为
(4)沉淀完成后得到终端产品1(Li2CO3)的操作有
(5)浸出实验首先在三颈烧瓶中加入适量的H2SO4和H2O2,再将准确称量的5.00 g粉料(其中钴元素含量为18.00%)倒入,反应后将其过滤,定容得溶液的体积为50.00 mL,采用电感耦合等离子体光谱仪测定浸出滤液中Co2+的浓度为17.28 mg·mL−1,则Co2+的浸出率为
您最近一年使用:0次
2021-04-16更新
|
478次组卷
|
5卷引用:【石家庄新东方】石家庄二中高三四校联考模拟化学
(已下线)【石家庄新东方】石家庄二中高三四校联考模拟化学(已下线)学科网2021年高三3月大联考(新课标Ⅰ卷)学科网2021年高三3月大联考(新课标Ⅰ卷)(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)辽宁省部分中学2022届高三下学期开学检测化学试题
8 . 丙烯是重要的化工原料,利用丙烷制备丙烯通常有三种方法。
方法一:丙烷直接脱氢法
(1)丙烷直接脱氢的主要反应为
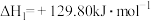 。600℃、0.4
。600℃、0.4 下,向装有催化剂的恒压密闭容器中以
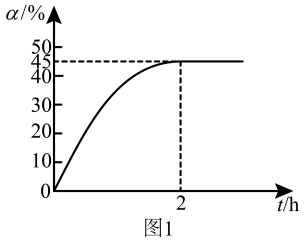
下,向装有催化剂的恒压密闭容器中以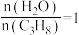 投料,发生反应。丙烷的转化率(
投料,发生反应。丙烷的转化率( )随时间(t)变化的曲线如图1所示。
)随时间(t)变化的曲线如图1所示。
①该体系达到平衡状态的标志为___________ (填选项字母)。
A.单位时间内,消耗 的物质的量等于生成
的物质的量等于生成 的物质的量
的物质的量
B.体系中气体的密度不再改变
C.单位体积内气体的分子数不再改变
D. 的分压不再改变
的分压不再改变
②用分压表示该反应的平衡常数
___________ ;增大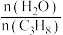 的值可提高丙烷的平衡转化率,解释其原因为
的值可提高丙烷的平衡转化率,解释其原因为___________ 。
方法二:丙烷氧化脱氢法
(2)丙烷氧化脱氢制丙烯时,主要发生反应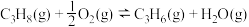
 。已知:氢气的燃烧热
。已知:氢气的燃烧热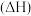 为
为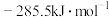 ;水的气化热
;水的气化热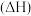 为
为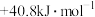 ;结合
;结合 ,可计算
,可计算
___________ ;与方法一相比,方法二的优点为___________ (写出一点即可)。
(3)我国科研机构利用计算机模拟得出:在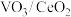 表面,丙烷催化氧化脱去第一个H的反应历程可能有两种(如图2所示),其中
表面,丙烷催化氧化脱去第一个H的反应历程可能有两种(如图2所示),其中 表示过渡态。
表示过渡态。
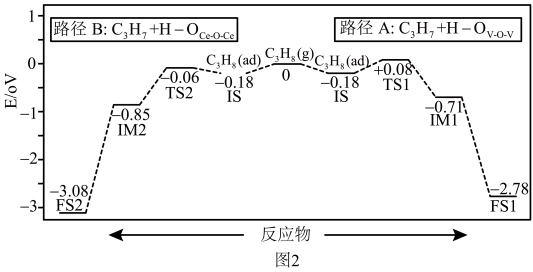
由上图分析可知,丙烷氧化脱去的第一个H是与___________ (填“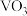 ”或“
”或“ ”)中的O结合,原因为
”)中的O结合,原因为___________ 。
方法三:丙烷与 耦合法
耦合法
(4)丙烷与 耦合法制丙烯时,主要发生如下反应:
耦合法制丙烯时,主要发生如下反应:
i. ii.
ii.
iii.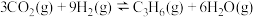 iv.
iv.
在580℃时,将 和
和 按体积比为
按体积比为 充入一恒压密闭容器中进行反应,实验测得体系中
充入一恒压密闭容器中进行反应,实验测得体系中 、
、 的转化率和
的转化率和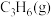 的选择性、
的选择性、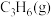 的产率随催化剂组成和压强的变化分别如图3(a)和(b)所示。
的产率随催化剂组成和压强的变化分别如图3(a)和(b)所示。
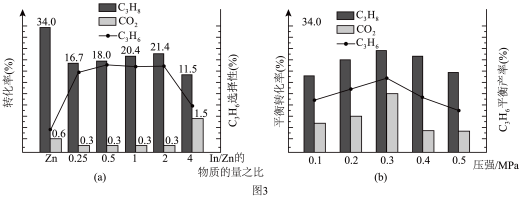
已知: 的选择性越高,副产物的含量越低。
的选择性越高,副产物的含量越低。
耦合法制丙烯适宜选择的生产条件为___________ ;随压强增大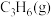 的平衡产率先增大后减小的原因为
的平衡产率先增大后减小的原因为___________ 。
方法一:丙烷直接脱氢法
(1)丙烷直接脱氢的主要反应为

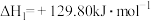 。600℃、0.4
。600℃、0.4 下,向装有催化剂的恒压密闭容器中以
下,向装有催化剂的恒压密闭容器中以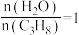 投料,发生反应。丙烷的转化率(
投料,发生反应。丙烷的转化率( )随时间(t)变化的曲线如图1所示。
)随时间(t)变化的曲线如图1所示。
①该体系达到平衡状态的标志为
A.单位时间内,消耗
 的物质的量等于生成
的物质的量等于生成 的物质的量
的物质的量B.体系中气体的密度不再改变
C.单位体积内气体的分子数不再改变
D.
 的分压不再改变
的分压不再改变②用分压表示该反应的平衡常数

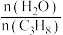 的值可提高丙烷的平衡转化率,解释其原因为
的值可提高丙烷的平衡转化率,解释其原因为方法二:丙烷氧化脱氢法
(2)丙烷氧化脱氢制丙烯时,主要发生反应
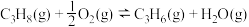
 。已知:氢气的燃烧热
。已知:氢气的燃烧热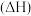 为
为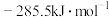 ;水的气化热
;水的气化热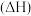 为
为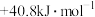 ;结合
;结合 ,可计算
,可计算
(3)我国科研机构利用计算机模拟得出:在
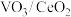 表面,丙烷催化氧化脱去第一个H的反应历程可能有两种(如图2所示),其中
表面,丙烷催化氧化脱去第一个H的反应历程可能有两种(如图2所示),其中 表示过渡态。
表示过渡态。
由上图分析可知,丙烷氧化脱去的第一个H是与
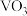 ”或“
”或“ ”)中的O结合,原因为
”)中的O结合,原因为方法三:丙烷与
 耦合法
耦合法(4)丙烷与
 耦合法制丙烯时,主要发生如下反应:
耦合法制丙烯时,主要发生如下反应:i.
 ii.
ii.
iii.
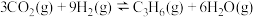 iv.
iv.
在580℃时,将
 和
和 按体积比为
按体积比为 充入一恒压密闭容器中进行反应,实验测得体系中
充入一恒压密闭容器中进行反应,实验测得体系中 、
、 的转化率和
的转化率和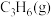 的选择性、
的选择性、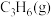 的产率随催化剂组成和压强的变化分别如图3(a)和(b)所示。
的产率随催化剂组成和压强的变化分别如图3(a)和(b)所示。
已知:
 的选择性越高,副产物的含量越低。
的选择性越高,副产物的含量越低。耦合法制丙烯适宜选择的生产条件为
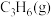 的平衡产率先增大后减小的原因为
的平衡产率先增大后减小的原因为
您最近一年使用:0次
9 . Ⅰ.CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为_________ L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______ 。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2 4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的量应该是______________ 。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O CO+3H2
CO+3H2
已知:CO+2H2 CH3OH CO2+3H2
CH3OH CO2+3H2 CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率_______
Ⅱ.氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。完成下列计算:
(5)CaCO3质量分数为0.90的石灰石100 kg完成分解产生CO2_______ L(标准状况)。石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生CO2 29120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为_______ mol。
(6)已知粗盐水含MgCl2 6.80 mol/m3,含CaCl2 3.00mol/m3。向粗盐水中加入Ca(OH)2除镁离子:MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2然后加入Na2CO3除钙离子。处理上述粗盐水10 m3,至少需要加Na2CO3______ g。如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应:Ca2+ + 2NH3 + CO2 + H2O → CaCO3↓ + 2NH4+处理上述10 m3粗盐水至少需要通入_____________ L(标准状况)碳酸化尾气。
(7)某氨盐水含氯化钠1521 kg,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070 kg。
①过滤后溶液中氯化钠的质量______________ 。
②析出的碳酸氢钠晶体的质量__________________ 。
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2 4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的量应该是
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O
 CO+3H2
CO+3H2已知:CO+2H2
 CH3OH CO2+3H2
CH3OH CO2+3H2 CH3OH+H2O
CH3OH+H2O300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率
Ⅱ.氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。完成下列计算:
(5)CaCO3质量分数为0.90的石灰石100 kg完成分解产生CO2
(6)已知粗盐水含MgCl2 6.80 mol/m3,含CaCl2 3.00mol/m3。向粗盐水中加入Ca(OH)2除镁离子:MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2然后加入Na2CO3除钙离子。处理上述粗盐水10 m3,至少需要加Na2CO3
(7)某氨盐水含氯化钠1521 kg,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070 kg。
①过滤后溶液中氯化钠的质量
②析出的碳酸氢钠晶体的质量
您最近一年使用:0次
名校
10 . 以 、软锰矿(主要成分为
、软锰矿(主要成分为 ,少量
,少量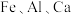 及
及 的化合物等)、氨水及净化剂等为原料可制备
的化合物等)、氨水及净化剂等为原料可制备 液和
液和 ,主要实验步骤如下
,主要实验步骤如下
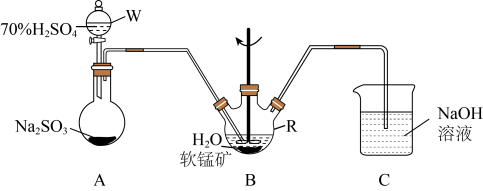
步骤I、如图所示装置,将 通入
通入 中的软锰矿浆液中
中的软锰矿浆液中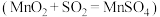 。
。
步骤II、充分反应后,在不断搅拌下依次向仪器 中加入适量纯净的
中加入适量纯净的 ,最后加入适量
,最后加入适量 沉铅,
沉铅,
步骤III、过滤得 溶液
溶液
(1)仪器R的名称是_______ 。
(2)装置 用于制取
用于制取 ,反应的化学方程式为
,反应的化学方程式为_________ 。
(3)装置 中的反应应控制在90~100℃,适宜的加热方式是
中的反应应控制在90~100℃,适宜的加热方式是______________ 。
(4)装置 的作用是
的作用是______________________ 。
(5)“步骤Ⅱ”中加入纯净 的目的是
的目的是_______________ ,用 调节溶液
调节溶液 时,需调节溶液
时,需调节溶液 的范围为
的范围为________ (该实验条件下,部分金属离子开始沉淀和沉淀完全的 如下表)
如下表)
(6)已知①用空气氧化 浊液可制备
浊液可制备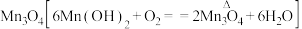 ,主要副产物为
,主要副产物为 ;反应温度和溶液
;反应温度和溶液 对产品中
对产品中 的质量分数的影响分别如图所示
的质量分数的影响分别如图所示

②反应温度超过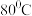 时,
时, 的产率开始降低,
的产率开始降低, 是白色沉淀,
是白色沉淀, 呈黑色;
呈黑色; 、
、 中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到
中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到 溶液,并用氨水等制备较纯净的
溶液,并用氨水等制备较纯净的 的实验方案:
的实验方案:______________________ ,真空干燥6小时得产品 。
。
 、软锰矿(主要成分为
、软锰矿(主要成分为 ,少量
,少量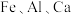 及
及 的化合物等)、氨水及净化剂等为原料可制备
的化合物等)、氨水及净化剂等为原料可制备 液和
液和 ,主要实验步骤如下
,主要实验步骤如下
步骤I、如图所示装置,将
 通入
通入 中的软锰矿浆液中
中的软锰矿浆液中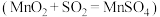 。
。步骤II、充分反应后,在不断搅拌下依次向仪器
 中加入适量纯净的
中加入适量纯净的 ,最后加入适量
,最后加入适量 沉铅,
沉铅,步骤III、过滤得
 溶液
溶液(1)仪器R的名称是
(2)装置
 用于制取
用于制取 ,反应的化学方程式为
,反应的化学方程式为(3)装置
 中的反应应控制在90~100℃,适宜的加热方式是
中的反应应控制在90~100℃,适宜的加热方式是(4)装置
 的作用是
的作用是(5)“步骤Ⅱ”中加入纯净
 的目的是
的目的是 调节溶液
调节溶液 时,需调节溶液
时,需调节溶液 的范围为
的范围为 如下表)
如下表)| 金属离子 |  |  |  |  |
开始沉淀的 | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全的 | 9.18 | 3.27 | 4.9 | 10.2 |
(6)已知①用空气氧化
 浊液可制备
浊液可制备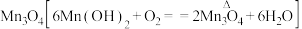 ,主要副产物为
,主要副产物为 ;反应温度和溶液
;反应温度和溶液 对产品中
对产品中 的质量分数的影响分别如图所示
的质量分数的影响分别如图所示
②反应温度超过
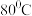 时,
时, 的产率开始降低,
的产率开始降低, 是白色沉淀,
是白色沉淀, 呈黑色;
呈黑色; 、
、 中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到
中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到 溶液,并用氨水等制备较纯净的
溶液,并用氨水等制备较纯净的 的实验方案:
的实验方案: 。
。
您最近一年使用:0次
2019-05-09更新
|
597次组卷
|
2卷引用:河北省示范性高中2019届高三下学期4月联考理科综合化学试题








