1 . 下图为工业合成氨的流程图。图中为提高原料转化率而采取的措施是
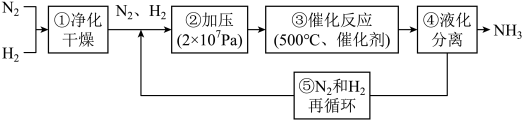
| A.①②③ | B.①③⑤ | C.②④⑤ | D.②③④ |
您最近一年使用:0次
2024-03-23更新
|
62次组卷
|
2卷引用:宁夏石嘴山市第三中学2023-2024学年高一下学期4月期中考试化学试题
名校
2 . 氨是一种重要的基础化工产品。
(1)合成氨的原料气( 及少量
及少量 的混合气)在进入合成塔前需除去
的混合气)在进入合成塔前需除去 ,原因是
,原因是___________ 。
原料气中的 常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
反应Ⅰ:
反应Ⅱ: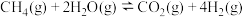
反应Ⅲ:
一定条件下,向体积为V的恒容容器中充入 甲烷和
甲烷和 水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则
水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则 的物质的量为
的物质的量为________  ,写出反应Ⅲ的平衡常数
,写出反应Ⅲ的平衡常数
___________ 。
(2) 与
与 作用分别生成
作用分别生成 的反应均为放热反应。工业尾气中的
的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的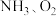 和
和 的混合气体以一定流速经过装有催化剂的反应管,
的混合气体以一定流速经过装有催化剂的反应管, 的转化率、
的转化率、 的选择性[
的选择性[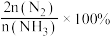 ]与温度的关系如图。
]与温度的关系如图。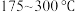 范围内升高温度,出口处氮氧化物的量
范围内升高温度,出口处氮氧化物的量________ (填“增大”或“减小), 的平衡转化率
的平衡转化率________ (填“增大”或“减小”)。
②为能更有效除去尾气中的 ,保护环境,应选择的最佳温度为
,保护环境,应选择的最佳温度为________ (填序号)。
A. B.
B. C.
C.
(3)氨气也可与氨的氧化物反应生成氮气,该反应可用于处理氮的氧化物。例如: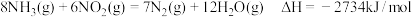 ,将
,将 和
和 以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中
以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中 含量,从而确定
含量,从而确定 的转化率,结果如图所示:
的转化率,结果如图所示:___________ (填“是”或“不是”)平衡状态,原因是___________ 。
(1)合成氨的原料气(
 及少量
及少量 的混合气)在进入合成塔前需除去
的混合气)在进入合成塔前需除去 ,原因是
,原因是原料气中的
 常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
常用甲烷水蒸气重整反应制备,涉及的主要反应如下:反应Ⅰ:

反应Ⅱ:
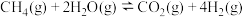
反应Ⅲ:

一定条件下,向体积为V的恒容容器中充入
 甲烷和
甲烷和 水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则
水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则 的物质的量为
的物质的量为 ,写出反应Ⅲ的平衡常数
,写出反应Ⅲ的平衡常数
(2)
 与
与 作用分别生成
作用分别生成 的反应均为放热反应。工业尾气中的
的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的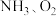 和
和 的混合气体以一定流速经过装有催化剂的反应管,
的混合气体以一定流速经过装有催化剂的反应管, 的转化率、
的转化率、 的选择性[
的选择性[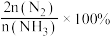 ]与温度的关系如图。
]与温度的关系如图。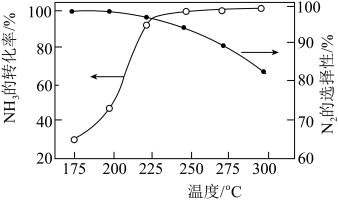
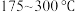 范围内升高温度,出口处氮氧化物的量
范围内升高温度,出口处氮氧化物的量 的平衡转化率
的平衡转化率②为能更有效除去尾气中的
 ,保护环境,应选择的最佳温度为
,保护环境,应选择的最佳温度为A.
 B.
B. C.
C.
(3)氨气也可与氨的氧化物反应生成氮气,该反应可用于处理氮的氧化物。例如:
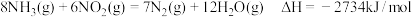 ,将
,将 和
和 以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中
以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中 含量,从而确定
含量,从而确定 的转化率,结果如图所示:
的转化率,结果如图所示: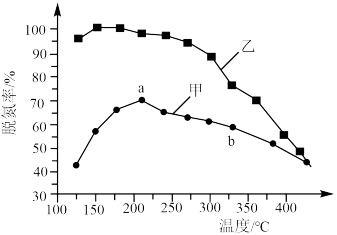
您最近一年使用:0次
2023-10-06更新
|
152次组卷
|
2卷引用:2024届宁夏石嘴山市大武口区石嘴山市第三中学高三下学期三模考试理综试题-高中化学
名校
解题方法
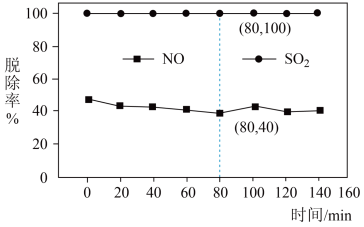
3 . 煤燃烧排放的烟气含有SO2和NOx,是大气的重要污染源之一、用Ca(ClO)2溶液对模拟烟气[n(NO)∶n(SO2) = 2∶3]同时进行脱硝脱硫,分别生成NO 、SO
、SO 。NO、SO2脱除率与时间关系如图所示,下列说法不正确的是
。NO、SO2脱除率与时间关系如图所示,下列说法不正确的是
 、SO
、SO 。NO、SO2脱除率与时间关系如图所示,下列说法不正确的是
。NO、SO2脱除率与时间关系如图所示,下列说法不正确的是
| A.SO2脱除率高于NO的原因可能是SO2在水中的溶解度大于NO |
B.碱性环境下脱除NO的反应:2NO + 3ClO- + 2OH- = 2NO + 3Cl- + H2O + 3Cl- + H2O |
| C.随着脱除反应的进行,吸收剂溶液的H+浓度增大 |
D.依据图中信息,在80 min时,吸收液中n(SO )∶n(Cl-)=1∶1 )∶n(Cl-)=1∶1 |
您最近一年使用:0次
2021-01-27更新
|
373次组卷
|
3卷引用:宁夏石嘴山市第三中学2022-2023学年高二下学期期末理科化学试题
名校
解题方法
4 . 黄铁矿(主要成分为FeS2)的有效利用对环境具有重要意义。
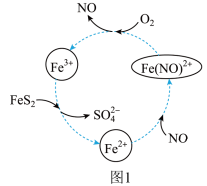
(1)在酸性条件下催化氧化黄铁矿的物质转化关系如图1所示。
①图1转化过程的总反应中,FeS2做__ (填“催化剂”“氧化剂”或“还原剂”,下同)。该转化过程中NO的作用是__ 。
②写出图1中Fe3+与FeS2反应的离子方程式:__ 。
(2)Fe2+被氧化为Fe3+的过程中,控制起始时Fe2+的浓度、溶液体积和通入O2的速率不变,改变其他条件时,Fe2+被氧化的转化率随时间的变化如图2所示。
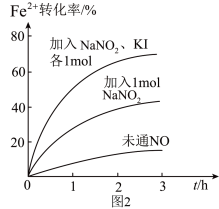
①加入NaNO2发生反应:2H++3NO =NO
=NO +2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为
+2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为__ mol。
②加入NaNO2、KI发生反应:4H++2NO +2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:
+2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:__ 。

(1)在酸性条件下催化氧化黄铁矿的物质转化关系如图1所示。
①图1转化过程的总反应中,FeS2做
②写出图1中Fe3+与FeS2反应的离子方程式:
(2)Fe2+被氧化为Fe3+的过程中,控制起始时Fe2+的浓度、溶液体积和通入O2的速率不变,改变其他条件时,Fe2+被氧化的转化率随时间的变化如图2所示。

①加入NaNO2发生反应:2H++3NO
 =NO
=NO +2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为
+2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为②加入NaNO2、KI发生反应:4H++2NO
 +2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:
+2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:
您最近一年使用:0次
2020-08-16更新
|
308次组卷
|
6卷引用:宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题
宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题河北省承德市各县第一中学2018届高三上学期期末考试化学试题(已下线)第08讲 氧化还原反应的基本概念和规律(精练)——2021年高考化学一轮复习讲练测(已下线)第03讲 氧化还原反应(练)-2023年高考化学一轮复习讲练测(新教材新高考)辽宁省沈阳市辽中区第二高级中学2021-2022学年高二下学期摸底考试化学试题(已下线)第4讲 氧化还原反应的基本概念与规律
名校
解题方法
5 . 二氧化锰是化学工业中常用的氧化剂和催化剂。我国主要以贫菱锰矿(有效成分为MnCO3)为原料,通过热解法进行生产。
(1)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s)⇌MnO(s)+CO2(g) △H1=+a kJ∙mol−1
ii.2MnO(s)+O2(g)⇌2MnO2(s) △H2=+b kJ∙mol−1
①反应i的化学平衡常数表达式K=_______ ;
②焙烧MnCO3制取MnO2的热化学方程式是_________ ;
(2)焙烧(装置如图1)时持续通入空气,并不断抽气的目的是_______ ;
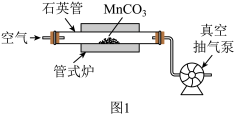
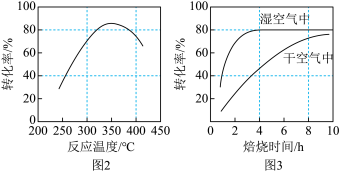
(3)在其他条件不变时,某科研团队对影响转化率的生产条件进行了研究,结果如图2、图3所示。
①常压下,要提高MnCO3的转化率,应选择的生产条件是____________ 焙烧6 8h。
8h。
②图3中,焙烧8h时,MnCO3的转化率:干空气<湿空气,原因是______________ 。
(1)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s)⇌MnO(s)+CO2(g) △H1=+a kJ∙mol−1
ii.2MnO(s)+O2(g)⇌2MnO2(s) △H2=+b kJ∙mol−1
①反应i的化学平衡常数表达式K=
②焙烧MnCO3制取MnO2的热化学方程式是
(2)焙烧(装置如图1)时持续通入空气,并不断抽气的目的是


(3)在其他条件不变时,某科研团队对影响转化率的生产条件进行了研究,结果如图2、图3所示。
①常压下,要提高MnCO3的转化率,应选择的生产条件是
 8h。
8h。②图3中,焙烧8h时,MnCO3的转化率:干空气<湿空气,原因是
您最近一年使用:0次
6 . 合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)化学家Gethard Ertl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意如下图:
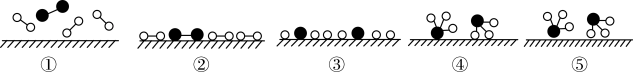
下列说法正确的是____ (选填字母)。
A.①表示N2、H2分子中均是单键
B.②→③需要吸收能量
C.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(2)氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g) △H,若N三N键、H一H键和N一H键的键能分别记作a、b和c(单位:kJ·mol-l),则上述反应的△H=
N2(g)+3H2(g) △H,若N三N键、H一H键和N一H键的键能分别记作a、b和c(单位:kJ·mol-l),则上述反应的△H=___ kJ·mol一1。
(3)研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(m mol.min一1)。
①不同催化剂存在下,氨气分解反应活化能最大的是___ (填写催化剂的化学式)。
②温度为T,在一体积固定的密闭容器中加入2 molNH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g) N2(g)十3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=
N2(g)十3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=___ 。[已知:气体分压(p分)=气体总压(p总)x体积分数]
(4)关于合成氨工艺的理解,下列正确的是___ 。
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量
C.合成氨工业采用10 MPa一30 MPa,是因常压下N2和H2的转化率不高
D.采用冷水降温的方法可将合成后混合气体中的氨液化
(5)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数[ (NH3)]。
(NH3)]。
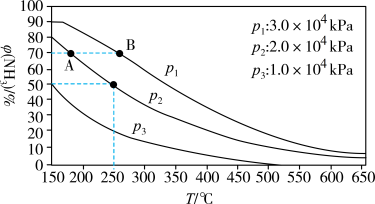
①若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(NH3)____ vB(NH3)(填“>”、“<”或“=”)。
②在250℃、1.0×104kPa下,H2的转化率为______ %(计算结果保留小数点后1位)。
(6)N2和H2在铁作催化剂作用下从145℃就开始反应,随着温度上升,单位时间内NH3产率增大,但温度高于900℃后,单位时间内NH3产率逐渐下降的原因________ 。
(1)化学家Gethard Ertl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意如下图:

下列说法正确的是
A.①表示N2、H2分子中均是单键
B.②→③需要吸收能量
C.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(2)氨气分解反应的热化学方程式如下:2NH3(g)
 N2(g)+3H2(g) △H,若N三N键、H一H键和N一H键的键能分别记作a、b和c(单位:kJ·mol-l),则上述反应的△H=
N2(g)+3H2(g) △H,若N三N键、H一H键和N一H键的键能分别记作a、b和c(单位:kJ·mol-l),则上述反应的△H=(3)研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(m mol.min一1)。
| 催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
| 初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
②温度为T,在一体积固定的密闭容器中加入2 molNH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g)
 N2(g)十3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=
N2(g)十3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=(4)关于合成氨工艺的理解,下列正确的是
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量
C.合成氨工业采用10 MPa一30 MPa,是因常压下N2和H2的转化率不高
D.采用冷水降温的方法可将合成后混合气体中的氨液化
(5)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数[
 (NH3)]。
(NH3)]。
①若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(NH3)
②在250℃、1.0×104kPa下,H2的转化率为
(6)N2和H2在铁作催化剂作用下从145℃就开始反应,随着温度上升,单位时间内NH3产率增大,但温度高于900℃后,单位时间内NH3产率逐渐下降的原因
您最近一年使用:0次
2019-12-26更新
|
502次组卷
|
3卷引用:宁夏石嘴山市2020届高三4月适应性(二模)考试理综化学试题
名校
解题方法
7 . 二氧化硫是危害最为严重的大气污染物之一,它主要来自化石燃料的燃烧,研究CO催化还原SO2的适宜条件,在燃煤电厂的烟气脱硫中具有重要价值。
Ⅰ.从热力学角度研究反应
(1) C(s)+O2(g) CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s) 2CO(g) ΔH2=+172.5 kJ·mol-1
2CO(g) ΔH2=+172.5 kJ·mol-1
S(s)+O2(g) SO2(g) ΔH3=-296.0 kJ·mol-1
SO2(g) ΔH3=-296.0 kJ·mol-1
写出CO 还原SO2的热化学方程式:_________________ 。
(2)关于CO还原SO2的反应,下列说法正确的是______ 。
A.在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态
B.平衡状态时,2v正(CO)=v逆(SO2)
C.其他条件不变,增大SO2的浓度,CO的平衡转化率增大
D.在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g) N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol
反应b:2C(s)+2NO2(g) N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol
(3)对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
①0~10min内,NO的平均反应速率v(NO)=___________ ,当升高反应温度,该反应的平衡常数K___________ (选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________ (填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)①某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因_____________ ;在1100kPa时,NO2的体积分数为___________ 。
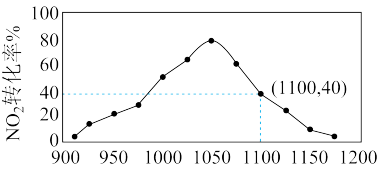
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=___________ (计算表达式表示);已知:气体分压(P分)=气体总压(P总)×体积分数。
Ⅰ.从热力学角度研究反应
(1) C(s)+O2(g)
 CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1CO2(g)+C(s)
 2CO(g) ΔH2=+172.5 kJ·mol-1
2CO(g) ΔH2=+172.5 kJ·mol-1S(s)+O2(g)
 SO2(g) ΔH3=-296.0 kJ·mol-1
SO2(g) ΔH3=-296.0 kJ·mol-1写出CO 还原SO2的热化学方程式:
(2)关于CO还原SO2的反应,下列说法正确的是
A.在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态
B.平衡状态时,2v正(CO)=v逆(SO2)
C.其他条件不变,增大SO2的浓度,CO的平衡转化率增大
D.在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)
 N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol反应b:2C(s)+2NO2(g)
 N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol(3)对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min内,NO的平均反应速率v(NO)=
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)①某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因

②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=
您最近一年使用:0次
2019-06-01更新
|
1244次组卷
|
5卷引用:宁夏石嘴山市第三中学2020届高三上学期期末考试理综化学试题
名校
解题方法
8 . 氮的氧化物(NOx)是大气主要污染物,有效去除大气中的NOx是环境保护的重要课题。
(1)N2O又称笑气,有轻微的麻醉作用,N2O在一定条件下可分解为N2、O2。回答下列问题:
已知:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ・mol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-114.14kJ・mol-1
③3NO(g)=N2O(g)+NO2(g) △H3=-115.52kJ・mol-1
则反应2N2O(g)=2N2(g)+O2(g) △H=_______ kJ・mol-1
(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入10molCO和8molNO发生反应,测得平衡时NO的体积分数与温度、压强的关系如下图
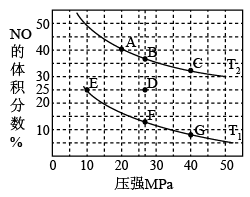
①已知T2>T1,则反应2NO(g)+2CO(g) N2(g)+2CO2(g),△H
N2(g)+2CO2(g),△H___ 0(填“>”“=”或“<”)
②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有____ (填字母序号)
a.改用高效催化剂 b.缩小容器的体积 c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,此时容器的体积为4L,则用N2的浓度变化表示的平均反应速率v(N2)=____ ,该温度下用分压表示的平衡常数Kp= ___ MPa-1(分压=总压×物质的量分数)。
④在D点,对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中____ 点。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。
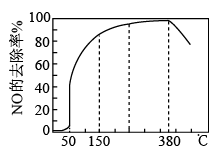
①在50℃~150℃范围内随温度升高,NOx的去除率迅速上升的原因是____ 。
②当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___ 。
(1)N2O又称笑气,有轻微的麻醉作用,N2O在一定条件下可分解为N2、O2。回答下列问题:
已知:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ・mol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-114.14kJ・mol-1
③3NO(g)=N2O(g)+NO2(g) △H3=-115.52kJ・mol-1
则反应2N2O(g)=2N2(g)+O2(g) △H=
(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入10molCO和8molNO发生反应,测得平衡时NO的体积分数与温度、压强的关系如下图

①已知T2>T1,则反应2NO(g)+2CO(g)
 N2(g)+2CO2(g),△H
N2(g)+2CO2(g),△H②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有
a.改用高效催化剂 b.缩小容器的体积 c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,此时容器的体积为4L,则用N2的浓度变化表示的平均反应速率v(N2)=
④在D点,对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。

①在50℃~150℃范围内随温度升高,NOx的去除率迅速上升的原因是
②当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是
您最近一年使用:0次
2019-04-09更新
|
1615次组卷
|
6卷引用:宁夏石嘴山市第三中学2020届高三12月月考化学试题
宁夏石嘴山市第三中学2020届高三12月月考化学试题【市级联考】河南省郑州市2019届高三下学期第二次质量预测理科综合化学试题2020高考化学二轮总复习高分必备 题型专题2 非选择题专练(已下线)专题6.3 化学原理题(必考)(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升山东省济宁市第一中学2020届高三一轮质量检测化学试题西藏日喀则市上海实验学校2020-2021学年高三下学期第二次模拟考试理综化学试题
真题
名校
9 . 1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是( )。

| A.①②③ | B.②④⑤ | C.①③⑤ | D.②③④ |
您最近一年使用:0次
2019-01-30更新
|
2212次组卷
|
28卷引用:宁夏石嘴山市第三中学2019-2020学年高二6月月考化学试题
宁夏石嘴山市第三中学2019-2020学年高二6月月考化学试题2010年普通高等学校招生全国统一考试(上海卷)理综化学部分(已下线)2011-2012学年福建泉州晋江市季延中学高二下学期期中化学试卷2016-2017学年四川省彭州中学高二上10月月考化学试卷山西省大同市第一中学2017-2018学年高二上学期期中考试化学试题【全国百强校】山东省泰安市第一中学2018-2019学年高二上学期期中考试化学试题江西省南昌市第二中学2019-2020学年高二上学期期中考试化学试题江西省南昌市顶级名校2019-2020学年高二上学期12月月考化学考试题山东省德州市陵城区第一中学2019-2020学年高二上学期期中考试化学试题山西省太原市第五中学2020-2021学年高二上学期10月月考试题山东师范大学附属中学2020-2021学年高二上学期期中考试化学试题、辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期第三次月考化学试题江西省宜春市第九中学2020-2021学年高二上学期期中考试化学试题广东省汕头市达濠华侨中学2020至2021学年高二上学期期末联考化学试题江西省兴国县第三中学2020-2021学年高二下学期第三次月考化学试题河北省石家庄市第一中学2021-2022学年高二上学期开学考试化学试题海南省华中师范大学海南附属中学2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二上学期期中考试化学试题河北省张家口市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)2.4.1 合成氨生产适宜条件的选择-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)山东省新泰市第一中学2022-2023学年高二上学期期中考试化学试题北京市清华大学附属中学2022-2023学年高二上学期12月月考化学试题湖南省衡阳市衡阳县第五中学2022-2023学年高二上学期期末考试化学试题上海市华东政法大学附属中学2022-2023学年高二下学期期中考试(等级考)化学试题第四节 化学反应的调控陕西省渭南市白水县2020~2021学年高二上学期期末考试化学试题福建省厦门市湖滨中学2023-2024学年高二上学期期中考试化学试题江西省南昌市第十九中学2023-2024学年高二上学期第一次月考化学试卷
10 . 【化学——选修2化学与技术】
合成氨的流程示意图如下:
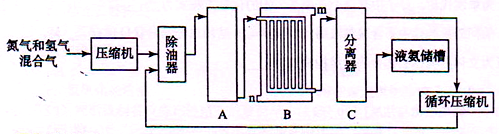
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是__________ ,____________ ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式______________ ,__________________ 。
(2)设备A中含有加热器,触媒和热交换器,设备A的名称是_____ ,其中发生的化学反应方程式为_____________________ 。
(3)设备B的名称是_________ ,其中m和n是两个通水口,入水口是______ (填“m”或“n”),不宜从相反方向通水的原因是________________ 。
(4)设备C的作用是_________________________ 。
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2(g)+H2(g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中
CO2(g)+H2(g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中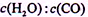 不低于
不低于_____________ 。
合成氨的流程示意图如下:

回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是
(2)设备A中含有加热器,触媒和热交换器,设备A的名称是
(3)设备B的名称是
(4)设备C的作用是
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)
 CO2(g)+H2(g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中
CO2(g)+H2(g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中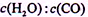 不低于
不低于
您最近一年使用:0次



