解题方法
1 . 苯甲酸乙酯可用于配制香水、香精和人造精油,也大量用于食品中,实验室制备苯甲酸乙酯的原理为: .分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。
.分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。
 .“环己烷—乙醇—水”会形成共沸物(沸点
.“环己烷—乙醇—水”会形成共沸物(沸点 ),一些有机物的物理性质如表所示:
),一些有机物的物理性质如表所示:
实验装置如图所示(加热及夹持装置已省略),实验步骤如下:
②控制温度在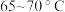 加热回流2h,期间不时打开旋塞放出分水器中液体;
加热回流2h,期间不时打开旋塞放出分水器中液体;
③反应结束后,将X内反应液依次用水、饱和 溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;
溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;
④向③中所得有机层中加入氯化钙,蒸馏,接收 的馏分,得到产品12.00mL。
的馏分,得到产品12.00mL。
请回答下列问题:
(1)仪器X的名称为___________ 。
(2)冷凝管的进水口为___________ (填“a”或“b”)。
(3)“加热回流”时,装置宜采用的加热方法是___________ ,判断反应完成的实验现象为___________ 。
(4)使用分水器能提高酯的产率,原因是___________ (用平衡移动的原理解释)。
(5)若步骤③加入的饱和 溶液不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是
溶液不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是___________ 。
(6)本实验得到的苯甲酸乙酯的产率为___________ (结果保留3位有效数字)。
 +C2H5OH
+C2H5OH
 +H2O
+H2O
 .分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。
.分水器可以储存冷凝管冷凝的液体,当液面达到支管口时上层液体可回流到反应器中,通过下端活塞可以将密度较大的下层液体排放出去。 .“环己烷—乙醇—水”会形成共沸物(沸点
.“环己烷—乙醇—水”会形成共沸物(沸点 ),一些有机物的物理性质如表所示:
),一些有机物的物理性质如表所示:| 物质 | 颜色、状态 | 沸点( ) ) | 密度( ) ) | 溶解性 |
| 苯甲酸 | 无色晶体 | 249( 升华) 升华) | 1.27 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯甲酸乙酯 | 无色液体 | 212.6 | 1.05 | 微溶于热水,与乙醇、乙醚混溶 |
| 乙醇 | 无色液体 | 78.3 | 0.79 | 与水互溶 |
| 环己烷 | 无色液体 | 80.8 | 0.73 | 不溶于水 |

②控制温度在
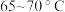 加热回流2h,期间不时打开旋塞放出分水器中液体;
加热回流2h,期间不时打开旋塞放出分水器中液体;③反应结束后,将X内反应液依次用水、饱和
 溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;
溶液、水洗涤。用分液漏斗分离出有机层,水层经碳酸氢钠处理后用适量乙醚萃取分液,然后合并至有机层;④向③中所得有机层中加入氯化钙,蒸馏,接收
 的馏分,得到产品12.00mL。
的馏分,得到产品12.00mL。请回答下列问题:
(1)仪器X的名称为
(2)冷凝管的进水口为
(3)“加热回流”时,装置宜采用的加热方法是
(4)使用分水器能提高酯的产率,原因是
(5)若步骤③加入的饱和
 溶液不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是
溶液不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是(6)本实验得到的苯甲酸乙酯的产率为
您最近一年使用:0次
解题方法
2 . 下列实验目的、实验操作及现象、结论均正确的是
| 选项 | 实验目的 | 实验操作及现象 | 结论 |
| A | 判断强酸和弱酸 |  溶液显碱性, 溶液显碱性, 溶液显酸性 溶液显酸性 | 可以确定 是弱酸,无法判断 是弱酸,无法判断 是否为弱酸 是否为弱酸 |
| B | 判断反应物的浓度对平衡的影响 | 向 溶液中加入 溶液中加入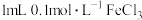 溶液,达到平衡,再加入 溶液,达到平衡,再加入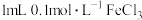 溶液,溶液红色加深 溶液,溶液红色加深 | 说明增大反应物浓度,化学平衡正向移动 |
| C | 验证 的氧化性 的氧化性 | 向黄绿色的氯水中加入 溶液,溶液黄绿色褪去 溶液,溶液黄绿色褪去 |  有强氧化性 有强氧化性 |
| D | 验证菠菜中含有铁元素 | 将新鲜菠菜剪碎、研磨、溶解、过滤,向滤液中加入几滴KSCN溶液,溶液不变红 | 说明菠菜中不含铁元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 1.氮的氧化物 如
如 、
、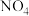 、
、 等
等 应用很广,在一定条件下可以相互转化.
应用很广,在一定条件下可以相互转化.
(1)从 可通过电解或臭氧氧化
可通过电解或臭氧氧化 的方法制备.电解装置如图1所示
的方法制备.电解装置如图1所示 隔膜用于阻止水分子通过
隔膜用于阻止水分子通过 ,其阳极反应式为
,其阳极反应式为______ .

已知:
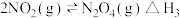
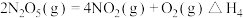
则反应 的
的
______ .
(2)从 在一定条件下发生分解:
在一定条件下发生分解: 某温度下测得恒容密闭容器中
某温度下测得恒容密闭容器中 浓度随时间的变化如下表:
浓度随时间的变化如下表:
设反应开始时体系压强为 ,第
,第 时体系压强为p,则p:
时体系压强为p,则p: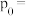
______ ; 内,
内, 的平均反应速率为
的平均反应速率为______ .
(3)从 与
与 之间存在反应
之间存在反应 将一定量的
将一定量的 放入恒容密闭容器中,测得其平衡转化率
放入恒容密闭容器中,测得其平衡转化率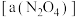 随温度变化如图2所示.
随温度变化如图2所示.

 图中a点对应温度下,已知
图中a点对应温度下,已知 的起始压强
的起始压强 为108kPa,列式计算该温度下反应的平衡常数
为108kPa,列式计算该温度下反应的平衡常数
______  用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数
物质的量分数 .
.
 由图推测
由图推测 是吸热反应还是放热反应,说明理由
是吸热反应还是放热反应,说明理由______ ,若要提高 转化率,除改变反应温度外,其他措施有
转化率,除改变反应温度外,其他措施有______  要求写出两条
要求写出两条 .
.
 对于反应
对于反应 ,在一定条件下
,在一定条件下 与
与 的消耗速率与自身压强间存在关系:
的消耗速率与自身压强间存在关系: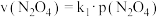 ,
, 其中,
其中, 、
、 是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,
是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是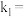
______ ,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由______ .

 如
如 、
、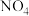 、
、 等
等 应用很广,在一定条件下可以相互转化.
应用很广,在一定条件下可以相互转化.(1)从
 可通过电解或臭氧氧化
可通过电解或臭氧氧化 的方法制备.电解装置如图1所示
的方法制备.电解装置如图1所示 隔膜用于阻止水分子通过
隔膜用于阻止水分子通过 ,其阳极反应式为
,其阳极反应式为
已知:

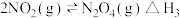
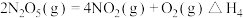
则反应
 的
的
(2)从
 在一定条件下发生分解:
在一定条件下发生分解: 某温度下测得恒容密闭容器中
某温度下测得恒容密闭容器中 浓度随时间的变化如下表:
浓度随时间的变化如下表: |  |  |  |  |  |  |
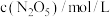 |  |  | 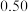 | 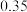 |  | 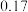 |
 ,第
,第 时体系压强为p,则p:
时体系压强为p,则p: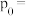
 内,
内, 的平均反应速率为
的平均反应速率为(3)从
 与
与 之间存在反应
之间存在反应 将一定量的
将一定量的 放入恒容密闭容器中,测得其平衡转化率
放入恒容密闭容器中,测得其平衡转化率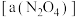 随温度变化如图2所示.
随温度变化如图2所示.
 图中a点对应温度下,已知
图中a点对应温度下,已知 的起始压强
的起始压强 为108kPa,列式计算该温度下反应的平衡常数
为108kPa,列式计算该温度下反应的平衡常数
 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数
物质的量分数 .
. 由图推测
由图推测 是吸热反应还是放热反应,说明理由
是吸热反应还是放热反应,说明理由 转化率,除改变反应温度外,其他措施有
转化率,除改变反应温度外,其他措施有 要求写出两条
要求写出两条 .
. 对于反应
对于反应 ,在一定条件下
,在一定条件下 与
与 的消耗速率与自身压强间存在关系:
的消耗速率与自身压强间存在关系: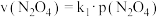 ,
, 其中,
其中, 、
、 是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,
是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是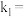

您最近一年使用:0次
2020-01-27更新
|
177次组卷
|
4卷引用:安徽省定远重点中学2019届高三上学期第三次月考化学试题
4 . NOx、SO2、CO等大气污染物的处理及利用在工业上具有重要意义。
(l)一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为l: 1 的NO2和SO2气体置于恒容密闭容器中发生上述反应,下列能说明该反应达到化学平衡状态的是____ (填字母)。
a.混合气体平均摩尔质量不变 b.混合气体颜色保持不变
c.每消耗1 molSO2的同时生成1 mol NO d.容器内的气体密度不变
(2)燃煤锅炉将排放大量SO2,污染大气造成公害,常采用下列两种方法消除燃煤SO2的污染。使排放的烟气通过足量的浓氨水洗涤,化学方程式是_________ 。在煤中加适量生石灰,使SO2与生石灰反应,化学方程式为_______ 。
(3)工业处理CO的其中一种方法是利用H2O(g)+ CO(g) H2(g)+CO2(g)△H<0来制备氢气。已知在恒容体系内发生此反应,某温度下该反应的平衡常数K=1。若起始时c(CO)= l mol/L,c(H2O)= 2 mol/L。
H2(g)+CO2(g)△H<0来制备氢气。已知在恒容体系内发生此反应,某温度下该反应的平衡常数K=1。若起始时c(CO)= l mol/L,c(H2O)= 2 mol/L。
试回答下列问题:
① 该温度下,反应进行一段时间后,测得H2O的浓度为1.6 mol/L ,则此时该反应v(正)___ v(逆)(填“>”“<”或“=”);若在平衡建立之后,向体系内通入一定量的Ar, H2的平衡产率将____ (填“增大”“减小”或“不变”)。
② 上述反应生成的H2与CO2可以设计成原电池来合成CH3OH,装置如图所示:
若A为CO2, B为H2, C 为CH3OH,则通入CO2的一极为_____ 极;
若A改为SO2, B为O2, C 为H2SO4,则正极的电极反应式为____________ 。
(4)已知在催化转化装置内,汽车尾气中的NO、CO能发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-746.8KJ/mol, 利用传感器记录某温度下上述反应的进程,测量所得数据如图。已知达到平衡时NO的转化率为80%,则该反应的平衡常数为
N2(g)+2CO2(g) △H=-746.8KJ/mol, 利用传感器记录某温度下上述反应的进程,测量所得数据如图。已知达到平衡时NO的转化率为80%,则该反应的平衡常数为____ (保留小数点后一位小数)
(l)一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为l: 1 的NO2和SO2气体置于恒容密闭容器中发生上述反应,下列能说明该反应达到化学平衡状态的是
a.混合气体平均摩尔质量不变 b.混合气体颜色保持不变
c.每消耗1 molSO2的同时生成1 mol NO d.容器内的气体密度不变
(2)燃煤锅炉将排放大量SO2,污染大气造成公害,常采用下列两种方法消除燃煤SO2的污染。使排放的烟气通过足量的浓氨水洗涤,化学方程式是
(3)工业处理CO的其中一种方法是利用H2O(g)+ CO(g)
 H2(g)+CO2(g)△H<0来制备氢气。已知在恒容体系内发生此反应,某温度下该反应的平衡常数K=1。若起始时c(CO)= l mol/L,c(H2O)= 2 mol/L。
H2(g)+CO2(g)△H<0来制备氢气。已知在恒容体系内发生此反应,某温度下该反应的平衡常数K=1。若起始时c(CO)= l mol/L,c(H2O)= 2 mol/L。试回答下列问题:
① 该温度下,反应进行一段时间后,测得H2O的浓度为1.6 mol/L ,则此时该反应v(正)
② 上述反应生成的H2与CO2可以设计成原电池来合成CH3OH,装置如图所示:
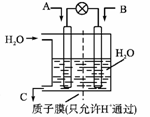
若A为CO2, B为H2, C 为CH3OH,则通入CO2的一极为
若A改为SO2, B为O2, C 为H2SO4,则正极的电极反应式为
(4)已知在催化转化装置内,汽车尾气中的NO、CO能发生如下反应:
2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H=-746.8KJ/mol, 利用传感器记录某温度下上述反应的进程,测量所得数据如图。已知达到平衡时NO的转化率为80%,则该反应的平衡常数为
N2(g)+2CO2(g) △H=-746.8KJ/mol, 利用传感器记录某温度下上述反应的进程,测量所得数据如图。已知达到平衡时NO的转化率为80%,则该反应的平衡常数为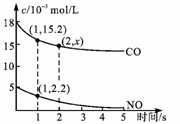
您最近一年使用:0次



