1 . 过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
(1)浓缩
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
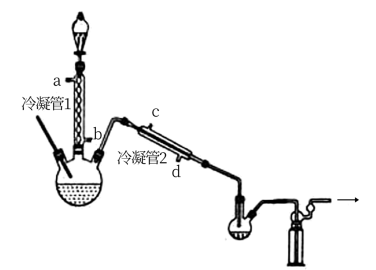
冷凝管1、冷凝管2中进水接口依次为___________ 、___________ (填字母)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68% 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2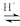
 +H2O)
+H2O)
①用浓缩的68% 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI( ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要___________
②设计步骤b的目的是___________
③过氧乙酸的质量分数为___________ %。
(1)浓缩

在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%
 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%
 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知:CH3COOH+H2O2
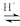
 +H2O)
+H2O)①用浓缩的68%
 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL
 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI(
 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近一年使用:0次
2 . 盐酸羟胺(化学式为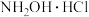 )是一种重要的化工产品,可作还原剂、显像剂等,其熔点为152℃,易溶于水。
)是一种重要的化工产品,可作还原剂、显像剂等,其熔点为152℃,易溶于水。
实验室以环己酮肟、盐酸为原料制备盐酸羟胺的反应原理如下:
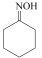 (环己酮肟)
(环己酮肟)
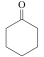 (环己酮)
(环己酮)
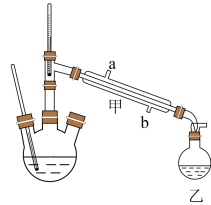
制备盐酸羟胺的实验装置如图所示(加热、搅拌和夹持装置已省略)。
盐酸羟胺在不同温度下的溶解度如下表:
(1)仪器甲中进水口应为___________ 。
A.a处 B.b处 C.a处或b处均可
(2)反应过程中,将环已酮不断蒸出的主要原因是___________ 。
(3)容器乙中收集到环己酮的水溶液,环已酮和水之间存在的相互作用有___________。
(4)反应后,从三口烧瓶的溶液中获取盐酸羟胺的实验方法为___________。
称取0.500g由上述方法制得的盐酸羟胺产品,加水配制成100mL溶液。量取20.00mL于锥形瓶中,加入适量稀硫酸酸化,再加入过量硫酸铁铵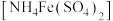 溶液充分反应,接着加入足量磷酸溶液(与
溶液充分反应,接着加入足量磷酸溶液(与 形成无色配合物),最后用
形成无色配合物),最后用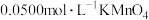 的酸性溶液滴定,达到滴定终点时消耗
的酸性溶液滴定,达到滴定终点时消耗 的酸性溶液的体积为11.35mL。
的酸性溶液的体积为11.35mL。
反应原理为:①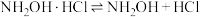
②
③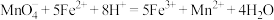
(5)将反应②补充完整,并标出电子转移的方向和数目___________ 。
(6)配制上述盐酸羟胺溶液所需要的定量仪器有___________ 。
A.电子天平 B.100mL容量瓶 C.滴定管 D.量筒
判断滴定终点的现象为___________ 。
(7)通过计算判断该产品的纯度级别___________ 。(写出计算过程)
已知:
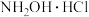 )是一种重要的化工产品,可作还原剂、显像剂等,其熔点为152℃,易溶于水。
)是一种重要的化工产品,可作还原剂、显像剂等,其熔点为152℃,易溶于水。实验室以环己酮肟、盐酸为原料制备盐酸羟胺的反应原理如下:
 (环己酮肟)
(环己酮肟)
 (环己酮)
(环己酮)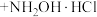
制备盐酸羟胺的实验装置如图所示(加热、搅拌和夹持装置已省略)。

盐酸羟胺在不同温度下的溶解度如下表:
| 温度(℃) | 溶解度(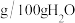 ) ) |
| 20 | 46.7 |
| 40 | 54.9 |
| 60 | 63.2 |
| 80 | 71.1 |
A.a处 B.b处 C.a处或b处均可
(2)反应过程中,将环已酮不断蒸出的主要原因是
(3)容器乙中收集到环己酮的水溶液,环已酮和水之间存在的相互作用有___________。
| A.共价键 | B.离子键 | C.氢键 | D.范德华力 |
| A.冷却结晶 | B.渗析 | C.蒸馏 | D.萃取、分液 |
称取0.500g由上述方法制得的盐酸羟胺产品,加水配制成100mL溶液。量取20.00mL于锥形瓶中,加入适量稀硫酸酸化,再加入过量硫酸铁铵
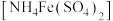 溶液充分反应,接着加入足量磷酸溶液(与
溶液充分反应,接着加入足量磷酸溶液(与 形成无色配合物),最后用
形成无色配合物),最后用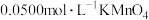 的酸性溶液滴定,达到滴定终点时消耗
的酸性溶液滴定,达到滴定终点时消耗 的酸性溶液的体积为11.35mL。
的酸性溶液的体积为11.35mL。反应原理为:①
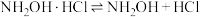
②

③
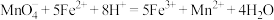
(5)将反应②补充完整,并标出电子转移的方向和数目
(6)配制上述盐酸羟胺溶液所需要的定量仪器有
A.电子天平 B.100mL容量瓶 C.滴定管 D.量筒
判断滴定终点的现象为
(7)通过计算判断该产品的纯度级别
| 纯度级别 | 优级纯 | 分析纯 | 化学纯 |
质量分数 | 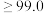 |  |  |

您最近一年使用:0次
2024-01-13更新
|
364次组卷
|
3卷引用:上海市四区联考2023-2024学年高三上学期化学一模试卷
上海市四区联考2023-2024学年高三上学期化学一模试卷(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)上海市嘉定区第二中学2023-2024学年高三上学期第一次质量调研 化学试卷
解题方法
3 . 一定条件下,利用R(g)制备M(g),反应为① ,过程中发生②
,过程中发生② 和③
和③ 两个副反应,反应历程如图所示。下列说法正确的是
两个副反应,反应历程如图所示。下列说法正确的是
 ,过程中发生②
,过程中发生② 和③
和③ 两个副反应,反应历程如图所示。下列说法正确的是
两个副反应,反应历程如图所示。下列说法正确的是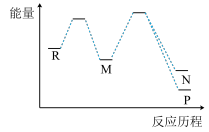
| A.反应③比反应①更快达到平衡 |
| B.温度越高,产物中M的纯度越高 |
| C.一定时间内,使用合适的催化剂可减少体系中P的含量 |
D.增大R的浓度,反应①②③的 增大, 增大, 减小 减小 |
您最近一年使用:0次
2023-12-02更新
|
433次组卷
|
4卷引用:寒假作业03 化学平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
(已下线)寒假作业03 化学平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)广东省2024届普通高中毕业班高三上学期第二次调研考试化学试题2024届广东省茂名市化州市高三上学期第二次调研考试化学试题(已下线)化学(广东卷01)-2024年高考押题预测卷
解题方法
4 . 人体内血红蛋白分子(Hb)与O2形成氧合血红蛋白,人体生命维持取决于血红蛋白与氧的结合及其对氧的释放。反应方程式如下所示,下列叙述不正确 的是
Hb(aq)(血红蛋白)+O2(aq) PbO2(aq)(氧合血红蛋白)
PbO2(aq)(氧合血红蛋白)
Hb(aq)(血红蛋白)+O2(aq)
 PbO2(aq)(氧合血红蛋白)
PbO2(aq)(氧合血红蛋白)| A.人体大量运动时肌肉需氧量上升平衡逆向移动 |
| B.人体吸氧越多有利于氧合血红蛋白形成,对人体健康越有利 |
| C.突然进入高海拔的高山上出现高山病时是由于上述平衡逆移导致 |
| D.长时间在高山区生活人群血液中血红蛋白含量比生活在平原地区人多 |
您最近一年使用:0次
解题方法
5 . 镁条投入盐酸时,快速溶解并产生大量气泡;投入热水时,其表面会附着微量气泡。受此启发,某兴趣小组对Mg与NaHCO3溶液的反应进行了如下探究:
I.探究反应产生的气体成分。
(1)经检验反应产生的气体有H2,实验室检验H2的方法为_______ 。
(2)小组成员认为反应产生的气体中可能有CO2,并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
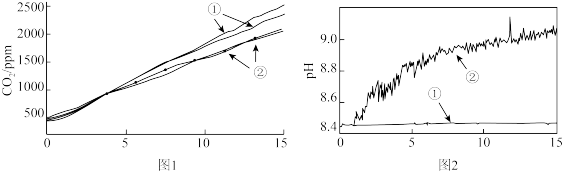
图1中曲线②对应的CO2含量逐渐增大的原因为_______ (用化学方程式表示);结合实验3解释,随着时间推移,图1中曲线②的数值低于曲线①的原因为_______ 。
II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO 加快了该反应的发生,对比实验1设计实验如下:
加快了该反应的发生,对比实验1设计实验如下:
(3)结合实验1和4,可知溶液中的HCO 加快了反应的发生。
加快了反应的发生。
①实验4中横线处内容为_______ 。
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO 能加快该反应的原因为
能加快该反应的原因为_______ 。
III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
(4)甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为_______ (填字母编号)。

(5)乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=_______ 。
| 实验序号 | 实验操作 | 实验现象 |
| 1 | 向7.5 mL1mol·L-1NaHCO3溶液中加入长3cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
(1)经检验反应产生的气体有H2,实验室检验H2的方法为
(2)小组成员认为反应产生的气体中可能有CO2,并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
| 实验序号 | 实验操作 |
| 2 | 分别称取两份6.0 mL 1 mol·L-1NaHCO3溶液于两个相同塑料瓶中(其中一个加入0.1g镁条),塞紧CO2气体传感器,采集数据,各重复实验1次,得到图1所示曲线 |
| 3 | 分别称取两份30.0 mL 1 mol·L-1NaHCO3溶液于两个相同烧杯中(其中一个加入1.1g镁条),插入pH传感器,搅拌并采集数据,得到图2所示曲线 |

图1中曲线②对应的CO2含量逐渐增大的原因为
II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO
 加快了该反应的发生,对比实验1设计实验如下:
加快了该反应的发生,对比实验1设计实验如下:| 实验序号 | 实验操作 | 实验现象 |
| 4 | 向_______溶液中加入长3 cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
 加快了反应的发生。
加快了反应的发生。①实验4中横线处内容为
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO
 能加快该反应的原因为
能加快该反应的原因为III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
(4)甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为

(5)乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=
您最近一年使用:0次
2022-04-09更新
|
1140次组卷
|
7卷引用:河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题
河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)秘籍21 性质探究实验-备战2022年高考化学抢分秘籍(全国通用)(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(实验探究题)(已下线)化学-2022年高考押题预测卷01(福建卷)(已下线)化学-2022年高考押题预测卷03(山东卷)(已下线)押江苏卷第17题 化学实验综合题 -备战2022年高考化学临考题号押题(江苏卷)



