名校
解题方法
1 . 某研究小组学生探究硫酸铁溶液与铜粉的反应,回答下列问题:
(1)由 固体配制
固体配制 溶液,下列图示仪器中不需要用到的有
溶液,下列图示仪器中不需要用到的有_______ (写名称)。

(2)研究小组设计如表实验,并记录实验现象:
【资料】ⅰ. 与
与 可发生氧化还原反应,也可发生配位反应生成
可发生氧化还原反应,也可发生配位反应生成 。
。
ⅱ.淡黄色、可溶的 ,与
,与 共存时溶液显绿色。
共存时溶液显绿色。
ⅲ.硫氰 的性质与卤素单质相似。
的性质与卤素单质相似。
①步骤1溶液呈浅蓝绿色时,发生反应的离子方程式是_______ 。
②经x射线衍射实验检测,步骤3中白色不溶物为CuSCN,同时有液态硫氰 生成,该反应的离子方程式是
生成,该反应的离子方程式是_______ 。
(3)某同学针对步骤4中溶液颜色变红且白色浑浊物增多的现象,提出大胆假设:当反应体系中同时存在 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。并做实验验证该假设:
。并做实验验证该假设:
③操作1中现象产生的可能原因是_______ 。
④操作2主要目的是_______ 。
⑤由操作3可知该同学的假设正确。操作3中 被氧化为
被氧化为 反应的离子方程式是
反应的离子方程式是_______ ,已知该反应的平衡常数 ,请用平衡移动原理解释实验1中步骤4出现相关现象的原因
,请用平衡移动原理解释实验1中步骤4出现相关现象的原因_______ 。
⑥由实验可知,影响氧化还原反应发生的因素有_______ 。
(1)由
 固体配制
固体配制 溶液,下列图示仪器中不需要用到的有
溶液,下列图示仪器中不需要用到的有
(2)研究小组设计如表实验,并记录实验现象:
| 实验1 | 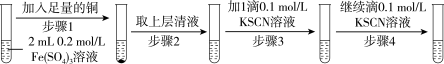 |
| 现象 | 步骤1:振荡试管后,溶液颜色呈浅蓝绿色 步骤3:溶液颜色变红,振荡试管,红色消失,并有白色沉淀产生 步骤4:溶液颜色变红,振荡试管,红色消失,白色沉淀增多 |
 与
与 可发生氧化还原反应,也可发生配位反应生成
可发生氧化还原反应,也可发生配位反应生成 。
。ⅱ.淡黄色、可溶的
 ,与
,与 共存时溶液显绿色。
共存时溶液显绿色。ⅲ.硫氰
 的性质与卤素单质相似。
的性质与卤素单质相似。①步骤1溶液呈浅蓝绿色时,发生反应的离子方程式是
②经x射线衍射实验检测,步骤3中白色不溶物为CuSCN,同时有液态硫氰
 生成,该反应的离子方程式是
生成,该反应的离子方程式是(3)某同学针对步骤4中溶液颜色变红且白色浑浊物增多的现象,提出大胆假设:当反应体系中同时存在
 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。并做实验验证该假设:
。并做实验验证该假设:| 实验2 | 操作1 | 操作2 | 操作3 |
 | 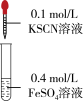 |  | |
| 现象 | 几分钟后,溶液颜色完全呈绿色。久置,溶液绿色变浅,试管底部有白色不溶物。 | 始终未见溶液颜色变红。 | 溶液颜色立刻变红,产生白色浑浊,振荡后红色消失。 |
④操作2主要目的是
⑤由操作3可知该同学的假设正确。操作3中
 被氧化为
被氧化为 反应的离子方程式是
反应的离子方程式是 ,请用平衡移动原理解释实验1中步骤4出现相关现象的原因
,请用平衡移动原理解释实验1中步骤4出现相关现象的原因⑥由实验可知,影响氧化还原反应发生的因素有
您最近一年使用:0次
2022-05-19更新
|
456次组卷
|
4卷引用:江西省赣州市2021-2022学年高三下学期3月摸底考试理综化学试题
江西省赣州市2021-2022学年高三下学期3月摸底考试理综化学试题 (已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)福建省泉州第五中学2021-2022学年学高三下学期化学期中考试化学试题(已下线)专题28 性质探究类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
解题方法
2 . 由实验操作和现象,可得出相应正确结论的是
| 实验操作 | 现象 | 结论 | |
| A | 向NaBr溶液中滴加过量氯水,再加入淀粉KI溶液 | 先变橙色,后变蓝色 | 氧化性: Cl2>Br2>I2 |
| B | 将铁锈溶于浓盐酸,再滴加酸性高锰酸钾溶液 | 高锰酸钾溶液的紫色褪去 | 铁锈中含有二价铁 |
| C | 向铬酸钾溶液中缓慢滴加硫酸 | 黄色变为橙红色 | 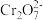 +H2O +H2O 2 2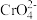 +2H+,增大氢离子浓度,平衡向生成 +2H+,增大氢离子浓度,平衡向生成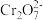 和的方向移动 和的方向移动 |
| D | 向蔗糖溶液中滴加稀硫酸,水浴加热,再加入新制Cu(OH)2悬浊液 | 无砖红色沉淀 | 蔗糖未发生水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 关于反应Cl2(g)+H2O(l) HClO(aq)+H+(aq)+Cl—(aq),达到平衡后,下列说法正确的是
HClO(aq)+H+(aq)+Cl—(aq),达到平衡后,下列说法正确的是
 HClO(aq)+H+(aq)+Cl—(aq),达到平衡后,下列说法正确的是
HClO(aq)+H+(aq)+Cl—(aq),达到平衡后,下列说法正确的是| A.向氯水中加入少量石灰石,平衡正向移动,溶液漂白性增强 |
B.加水稀释,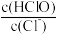 增大 增大 |
| C.加水稀释,溶液中所有离子浓度均减小 |
| D.向氯水中滴加淀粉KI溶液,溶液变蓝色,可以证明次氯酸具有强氧化性 |
您最近一年使用:0次
2023-11-11更新
|
110次组卷
|
2卷引用:江西省上饶市广丰中学2023-2024学年高二上学期12月考试化学试卷
4 . 已知:重铬酸钾( )具有强氧化性,其还原产物
)具有强氧化性,其还原产物 在水溶液中呈绿色。在
在水溶液中呈绿色。在 溶液中存在下列平衡:
溶液中存在下列平衡: (橙色)
(橙色)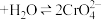 (黄色)
(黄色)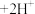 。用
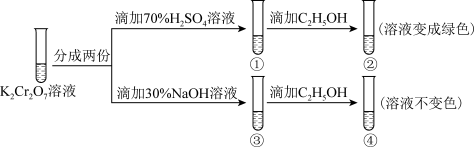
。用 溶液进行如图所示实验,下列说法不正确的是
溶液进行如图所示实验,下列说法不正确的是
 )具有强氧化性,其还原产物
)具有强氧化性,其还原产物 在水溶液中呈绿色。在
在水溶液中呈绿色。在 溶液中存在下列平衡:
溶液中存在下列平衡: (橙色)
(橙色)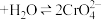 (黄色)
(黄色)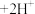 。用
。用 溶液进行如图所示实验,下列说法不正确的是
溶液进行如图所示实验,下列说法不正确的是
| A.①中溶液橙色加深,③中溶液变为黄色 |
B.②中 被 被 还原 还原 |
C.对比②和④可知, 酸性溶液氧化性强 酸性溶液氧化性强 |
D.若向④中加入70% 溶液至过量,溶液变为橙色 溶液至过量,溶液变为橙色 |
您最近一年使用:0次
2022-09-04更新
|
850次组卷
|
91卷引用:2017届江西省鹰潭市第一中学高三上学期第四次月考化学试卷
2017届江西省鹰潭市第一中学高三上学期第四次月考化学试卷江西省抚州市临川区第一中学2017-2018学年高二12月月考化学试题2016年全国普通高等学校招生统一考试化学(北京卷精编版)2017届河北省沧州市第一中学高三上周测化学试卷2017届河南省开封市高三上学期10月定位考试化学试卷2016-2017学年辽宁东北育才学校高二上阶段考二化学卷2017届宁夏固原一中高三上适应性训练四化学卷2017届河北省冀州中学高三(高复班)上学期一轮检测(二)化学试卷安徽省淮北市第一中学2016-2017学年高二下学期期中考试化学试题福建省福州市第八中学2016-2017学年高二下学期期中考试化学试题辽宁省葫芦岛市2017届高三第二次模拟考试(5月)化学试题山东省泰安市第一中学2016-2017学年高一下学期学情检测化学试题黑龙江省哈尔滨市第六中学2016-2017学年高二6月月考化学试题辽宁省辽源市金鼎高级中学2016-2017学年高二上学期期末考试化学试卷2018版化学(苏教版)高考总复习对接高考精练--氧化还原反应基础黑龙江省哈尔滨市第六中学2018届高三9月阶段检测化学试题辽宁省大连育明高级中学2018届高三人教版选修四同步测试化学试题河南省鹤壁市淇滨高级中学2017-2018学年高二上学期第一次月考化学试题吉林省实验中学2018届高三上学期第二次月考化学试题吉林省长春市2018届高三上学期第二次月考化学试题北京市八一中学2016-2017学年高二上学期期中考试化学试题湖南省浏阳一中、醴陵一中、南方中学2017-2018学年高二12月联考化学试题湖南省浏阳一中、醴陵一中、南方中学2017-2018学年高二12月联考化学试题(实验班)内蒙古巴彦淖尔市第一中学2018届高三12月月考理科综合化学试题(已下线)学科网2019年高考化学一轮复习讲练测2.3 氧化还原反应的基本概念 练福建省厦门市湖滨中学2019届高三上学期第一次阶段检测化学试题陕西省渭南市尚德中学2019届高三上学期第一次教学质量检测化学试题山西省运城市河津二中2018-2019学年高二上学期9月月考化学试题【全国百强校】四川省彭州中学2018-2019学年高二上学期10月月考化学试题浙江省诸暨中学2018-2019学年高二上学期10月(期中)阶段性考试实验班化学试题【全国百强校】湖南省衡阳市第一中学2018-2019学年高二上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)2016年全国普通高等学校招生统一考试化学(北京卷参考版)云南省腾冲市第八中学2018-2019学年高二下学期期中考试化学试题河北省迁西县第一中学2019-2020学年高二10月月考化学试题河北省鹿泉第一中学2019-2020学年高二9月月考化学试题浙江省宁波市北仑中学2019-2020学年高二上学期期中考试化学(2-10班)试题湖北省沙市中学2019-2020学年高二上学期期中考试化学(选考)试题河北省张家口市第一中学2019-2020学年高二12月月考化学试题夯基提能2020届高三化学选择题对题专练——氧化还原反应的综合分析夯基提能2020届高三化学选择题对题专练——氧化还原反应的实际应用夯基提能2020届高三化学选择题对题专练——氧化还原反应(强化练习)夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 化学平衡移动及其影响因素(强化练习)专题1.3 氧化还原反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升福建省莆田市仙游县枫亭中学2019-2020学年高二上学期期末考试化学试题山西省临汾市2020届高三上学期第二次月考化学试题河北省保定市2019-2020学年高二上学期期末调研考试化学试题(已下线)专题四 氧化还原反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训河北省衡水中学2020届高三四月份质量监测理综化学试题湖南长沙长郡中学2020届高三2月份网络教学质量监测卷理综化学试题湖北省武汉市华中师范大学第一附属中学2020届高三2月份网络教学质量监测理综化学试题吉林省长春市东北师大附中2020届高中毕业班二月份网络教学质量监测卷理科综合化学部分山西省运城市新绛中学2021届高三上学期8月月考化学试题河北省衡水市桃城区第十四中学2021届高三上学期一调考试化学试题四川省宜宾翠屏棠湖学校2020-2021学年高二上学期10月月考化学试题山西省太原市第五中学2020-2021学年高二上学期10月月考试题湖南省常德外国语学校2020-2021学年高二上学期期中考试化学试题重庆市第一中学校2020-2021高三上学期第一次月考化学试题北京首都师范大学第二附属中学2021届高三9月月考化学试题山西省太原市2020-2021学年高二上学期期中质量监测化学(理)试题广东实验中学附属天河学校2020--2021学年高二上学期期中考试化学试题四川省成都市金堂县竹篙中学2020-2021学年高二10月月考化学试题河南省鹤壁市高级中学2020-2021学年高二上学期尖子生联赛调研化学试题上海市嘉定区2021届高三一模化学试题安徽省六安市城南中学2020-2021学年高二上学期期中考试化学试题广东省汕尾市2020-2021学年高二上学期期末学业质量监测化学试题河北省衡水市第十四中学2020-2021学年高二上学期期末考试化学试题广东省韶关市2021届高三综合测试化学试题(已下线)考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)广东省深圳市西乡中学2021-2022学年高二上学期期中考试化学试题上海市徐汇中学2021-2022学年高三上学期期中考试化学试题(已下线)专题05 氧化还原反应-2022年高考化学二轮复习重点专题常考点突破练湖南省株洲市九方中学2022届高三下学期4月月考化学试题第二节 化学平衡 第3课时 影响化学平衡的因素内蒙古包头市第四中学2020-2021学年高二上学期期中考试化学试题黑龙江省哈尔滨市第二十四中学2022-2023学年高二10月月考化学试题新疆维吾尔自治区喀什市喀什第二中学2022-2023学年高三上学期网上11月月考化学试题广东省中山市小榄中学2022-2023学年高三上学期第三次月考化学试题(已下线)专题四 氧化还原反应-实战高考·二轮复习核心突破(已下线)化学预测卷(六)-预测卷(浙江专版)(已下线)化学反应速率与化学平衡——课时5影响化学平衡的因素四川省资阳中学2022-2023学年高二上学期期末考试化学试题(已下线)T13-实验方案的设计与评价(已下线)考点04 氧化还原反应的基本概念和规律(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)四川省绵阳市南山中学实验学校2022-2023学年高二下学期3月月考化学试题广东省肇庆市封开县广信中学、四会中学2023-2024学年高二上学期第一次联考化学试题北京市第一○一中学2023-2024学年高二上学期统练一化学试题北京市首都师范大学附属中学2022-2023学年高三上学期开学测试化学试题北京市日坛中学2023-2024学年高三上学期10月检测化学试题云南省大理市下关第一中学2023-2024学年高二上学期11月期中考试化学试题
5 . 粉煤灰是燃煤产生的重要污染物,主要成分有A12O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。

已知:i伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
ii Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-⇌[FeCl6]3-
(1)写出过程I中Fe2O3发生反应的离子方程式:____ 。
(2)过程II加入过量H2O2的作用是___ 。
(3)过程II加入伯胺一煤油对浸取液进行分离,该操作的名称是_____ 。
(4)从化学平衡角度解释过程III利用NaCI溶液进行反萃取的原理:_____ 。
(5) N2H4具有碱性,可与H+结合生成N2H5+。过程IV中先用过量的N2H4将水层2中Fe3+转化为Fe2+并生成N2,反应的离子方程式为____ ,得到的Fe2+再被O2氧化为FeOOH。
(6)纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。
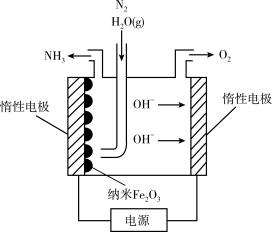
已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生电极反应生成中间体Fe。用化学用语表示Fe2O3在阴极催化生成NH3的反应过程。
第一步:____ ,
第二步:____ 。

已知:i伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O
 Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。ii Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-⇌[FeCl6]3-
(1)写出过程I中Fe2O3发生反应的离子方程式:
(2)过程II加入过量H2O2的作用是
(3)过程II加入伯胺一煤油对浸取液进行分离,该操作的名称是
(4)从化学平衡角度解释过程III利用NaCI溶液进行反萃取的原理:
(5) N2H4具有碱性,可与H+结合生成N2H5+。过程IV中先用过量的N2H4将水层2中Fe3+转化为Fe2+并生成N2,反应的离子方程式为
(6)纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。

已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生电极反应生成中间体Fe。用化学用语表示Fe2O3在阴极催化生成NH3的反应过程。
第一步:
第二步:
您最近一年使用:0次
2019-06-23更新
|
703次组卷
|
4卷引用:江西省丰城中学、高安二中等六校2021届高三1月联考理综化学试题
江西省丰城中学、高安二中等六校2021届高三1月联考理综化学试题【区级联考】北京市海淀区2019届高三5月期末练习(二模)理综化学试题福建省“百校联考”2020届高三7月教学摸底质量检查理科综合化学试题(已下线)大题02 化学工艺流程题(二)-【考前抓大题】备战2021年高考化学(全国通用)
6 . K2Cr2O7溶液中存在平衡Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+。已知Cr2O72-有强氧化性,而CrO42-几乎没有氧化性,Cr3+呈绿色。向K2Cr2O7溶液中加入下列物质,下列有关说法不正确的是
2CrO42-(黄色)+2H+。已知Cr2O72-有强氧化性,而CrO42-几乎没有氧化性,Cr3+呈绿色。向K2Cr2O7溶液中加入下列物质,下列有关说法不正确的是
 2CrO42-(黄色)+2H+。已知Cr2O72-有强氧化性,而CrO42-几乎没有氧化性,Cr3+呈绿色。向K2Cr2O7溶液中加入下列物质,下列有关说法不正确的是
2CrO42-(黄色)+2H+。已知Cr2O72-有强氧化性,而CrO42-几乎没有氧化性,Cr3+呈绿色。向K2Cr2O7溶液中加入下列物质,下列有关说法不正确的是| A.K2Cr2O7溶液中存在CrO42- |
| B.加入足量浓盐酸溶液,溶液可变为橙色 |
| C.加入70%的硫酸溶液后再加入C2H5OH,溶液可变为绿色 |
| D.加入30%的NaOH溶液后,溶液可变为黄色 |
您最近一年使用:0次
解题方法
7 . 兴趣小组同学为探究影响化学反应速率及化学平衡的因素,设计以下实验:

(1)利用实验I探究锌与稀硫酸反应的速率,需要记录的实验数据有:___________ 。
(2)利用实验II探究浓度对化学平衡的影响。已知: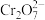 (橙色)
(橙色)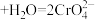 (黄色)
(黄色)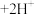 ,推测B试管中的实验现象为:
,推测B试管中的实验现象为:___________ ,用平衡移动原理解释其原因:___________ 。
(3)该小组同学继续用酸性 溶液和草酸(
溶液和草酸( )溶液进行实验,设计实验方案如表所示。请回答相关问题:
)溶液进行实验,设计实验方案如表所示。请回答相关问题:
①实验时,分别量取 溶液和酸性
溶液和酸性 溶液,迅速混合并开始计时,通过测定
溶液,迅速混合并开始计时,通过测定___________ 来判断反应的快慢。
②实验a、b、c所加的 溶液均要过量。理由是
溶液均要过量。理由是___________ 。
③实验a和b是探究___________ 对化学反应速率的影响。实验b和c是探究___________ 对化学反应速率的影响。
④实验a和b起初反应均很慢,过了一会儿速率突然增大,可能原因是___________ 。

(1)利用实验I探究锌与稀硫酸反应的速率,需要记录的实验数据有:
(2)利用实验II探究浓度对化学平衡的影响。已知:
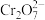 (橙色)
(橙色)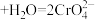 (黄色)
(黄色)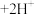 ,推测B试管中的实验现象为:
,推测B试管中的实验现象为:(3)该小组同学继续用酸性
 溶液和草酸(
溶液和草酸( )溶液进行实验,设计实验方案如表所示。请回答相关问题:
)溶液进行实验,设计实验方案如表所示。请回答相关问题:| 编号 | 温度℃ |  溶液 溶液 | 酸性 溶液 溶液 | ||
浓度/( ) ) | 体积/mL | 浓度/( ) ) | 体积/mL | ||
| a | 25 | 0.10 | 2.0 | 0.010 | 4.0 |
| b | 25 | 0.20 | 2.0 | 0.010 | 4.0 |
| c | 50 | 0.20 | 2.0 | 0.010 | 4.0 |
 溶液和酸性
溶液和酸性 溶液,迅速混合并开始计时,通过测定
溶液,迅速混合并开始计时,通过测定②实验a、b、c所加的
 溶液均要过量。理由是
溶液均要过量。理由是③实验a和b是探究
④实验a和b起初反应均很慢,过了一会儿速率突然增大,可能原因是
您最近一年使用:0次
名校
解题方法
8 . 探究化学反应的快慢和限度具有十分重要的意义。
I.某实验小组欲通过用酸性 和
和 (草酸)反应测定单位时间内生成
(草酸)反应测定单位时间内生成 的速率研究影响反应速率的因素,设计实验方案如下(
的速率研究影响反应速率的因素,设计实验方案如下( 溶液已酸化),实验装置如图甲所示:
溶液已酸化),实验装置如图甲所示:

(1)上述反应的离子方程式为:___________ ,该实验是探究___________ 对反应速率的影响。
(2)若实验①在2min末收集了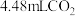 (标准状况下),则在2min末,
(标准状况下),则在2min末,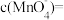
___________ mol/L(假设混合溶液的体积为50mL,反应前后体积变化忽略不计)。
(3)小组同学发现反应速率变化如图乙,其中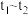 时间内速率变快的主要原因可能是:
时间内速率变快的主要原因可能是:___________ 。
Ⅱ.溶液中存在平衡 (橙色)
(橙色)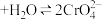 (黄色)
(黄色)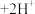 。用溶液进行下列实验:
。用溶液进行下列实验:

(4)向 溶液中加入
溶液中加入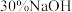 溶液,溶液呈
溶液,溶液呈___________ 色。向 溶液中逐滴加入
溶液中逐滴加入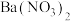 溶液(已知
溶液(已知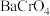 为黄色沉淀),则平衡向着
为黄色沉淀),则平衡向着___________ 方向移动,溶液颜色变化为___________ 。
(5)对比实验②和④可得出的结论是___________ 。
I.某实验小组欲通过用酸性
 和
和 (草酸)反应测定单位时间内生成
(草酸)反应测定单位时间内生成 的速率研究影响反应速率的因素,设计实验方案如下(
的速率研究影响反应速率的因素,设计实验方案如下( 溶液已酸化),实验装置如图甲所示:
溶液已酸化),实验装置如图甲所示:
| 实验序号 | A溶液 | B溶液 |
| ① | 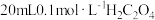 溶液 溶液 | 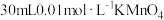 溶液 溶液 |
| ② | 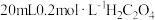 溶液 溶液 | 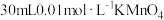 溶液 溶液 |
(2)若实验①在2min末收集了
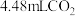 (标准状况下),则在2min末,
(标准状况下),则在2min末,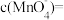
(3)小组同学发现反应速率变化如图乙,其中
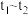 时间内速率变快的主要原因可能是:
时间内速率变快的主要原因可能是:Ⅱ.溶液中存在平衡
 (橙色)
(橙色)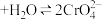 (黄色)
(黄色)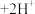 。用溶液进行下列实验:
。用溶液进行下列实验:
(4)向
 溶液中加入
溶液中加入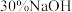 溶液,溶液呈
溶液,溶液呈 溶液中逐滴加入
溶液中逐滴加入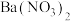 溶液(已知
溶液(已知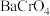 为黄色沉淀),则平衡向着
为黄色沉淀),则平衡向着(5)对比实验②和④可得出的结论是
您最近一年使用:0次
2021-12-21更新
|
272次组卷
|
2卷引用:江西省景德镇市乐平中学20222-2023学年高二上学期第一次月考化学试题
名校
9 . 探究化学反应的快慢和限度具有十分重要的意义。
Ⅰ.某实验小组欲通过用酸性KMnO4和H2C2O4(草酸)反应测定单位时间内生成CO2的速率研究影响反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:

(1)上述反应的离子方程式为:___ ,该实验探究的是___ 对化学反应速率的影响。
(2)若实验①在2min末收集了4.48mLCO2(标准状况下),则在2min末,c(MnO )=
)=____ mol·L-1(假设混合溶液的体积为50mL,反应前后体积变化忽略不计)。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定____ 来比较化学反应速率。
(4)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:___ 。
Ⅱ.K2Cr2O7溶液中存在平衡:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+。用K2Cr2O7溶液进行下列实验:
(黄色)+2H+。用K2Cr2O7溶液进行下列实验:

(5)向K2Cr2O7溶液中加入30%NaOH溶液,溶液呈____ 色,若再加入过量稀硫酸,则溶液呈____ 色。
(6)向K2Cr2O7溶液中逐滴加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向着____ 方向移动,溶液颜色变化为___ 。对比实验②和④可得出的结论是___ 。
Ⅰ.某实验小组欲通过用酸性KMnO4和H2C2O4(草酸)反应测定单位时间内生成CO2的速率研究影响反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL0.1mol·L-1 H2C2O4溶液 | 30mL0.01mol·L-1 KMnO4溶液 |
| ② | 20mL0.2mol·L-1 H2C2O4溶液 | 30mL0.01mol·L-1 KMnO4溶液 |
(2)若实验①在2min末收集了4.48mLCO2(标准状况下),则在2min末,c(MnO
 )=
)=(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定
(4)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:
Ⅱ.K2Cr2O7溶液中存在平衡:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+。用K2Cr2O7溶液进行下列实验:
(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
(5)向K2Cr2O7溶液中加入30%NaOH溶液,溶液呈
(6)向K2Cr2O7溶液中逐滴加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向着
您最近一年使用:0次
2021-09-30更新
|
430次组卷
|
3卷引用:江西省吉安市(吉安县三中、泰和二中、安福二中、井大附中 )2021-2022学年高二上学期9月联考化学试题



