名校
1 . CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l) H2O(l)+NH2CONH2(l) ΔH=
H2O(l)+NH2CONH2(l) ΔH=___________ kJ/mol。
Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(2)制备“合成气”反应历程分两步:
上述反应中C(ads)为吸附性活性炭,反应历程的能量图变化如下图所示:
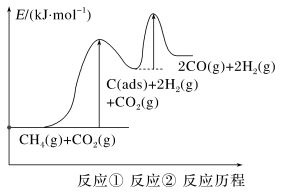
①反应速率快慢比较:反应①___________ 反应②(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因___________ 。
②一定温度下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=___________ (用k1、k2、k3、k4表示)。
(3)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
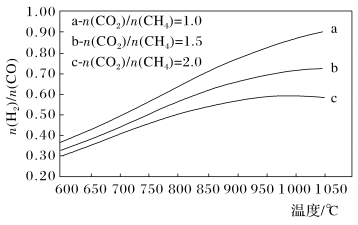
随着进料比 的增加,
的增加, 的值
的值___________ (填“增大”、“不变”或“减小”),其原因是___________ 。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)
 H2O(l)+NH2CONH2(l) ΔH=
H2O(l)+NH2CONH2(l) ΔH=Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。(2)制备“合成气”反应历程分两步:
| 步骤 | 反应 | 正反应速率方程 | 逆反应速率方程 |
| 反应① | CH4(g) C(ads)+2H2(g) C(ads)+2H2(g) | v正=k1·c(CH4) | v逆=k2·c2(H2) |
| 反应② | C(ads)+CO2(g) 2CO(g) 2CO(g) | v正=k3·c(CO2) | v逆=k4·c2(CO) |

①反应速率快慢比较:反应①
②一定温度下,反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=(3)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
随着进料比
 的增加,
的增加, 的值
的值
您最近一年使用:0次
2 . 我国在第75届联合国大会上正式提出了2030年实现碳达峰、2060年实现碳中和的目标,所以研发利用二氧化碳技术,降低空气中二氧化碳含量成为重要的任务。
Ⅰ.化石燃料的燃烧产生大量的二氧化碳。已知25℃时,相关物质的燃烧热数据如表:
(1)则25℃时H2(g)和C(石墨,s)生成C2H2(l)的热化学方程式为___________ 。
Ⅱ.二氧化碳甲烷化反应合成替代天然气,是利用二氧化碳的技术之一
甲烷化主反应:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH =-165 kJ∙mol-1
CH4(g)+2H2O(g) ΔH =-165 kJ∙mol-1
副反应:ⅰ.CO(g)+3H2(g) CH4(g)+H2O(g) ΔH1 =___________;
CH4(g)+H2O(g) ΔH1 =___________;
ⅱ.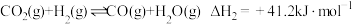 ;
;
ⅲ. =-90kJ∙mol-1;
=-90kJ∙mol-1;
ⅳ. C(s)+H2O(g) CO(g)+H2(g) ΔH4 = +131.3kJ∙mol-1。
CO(g)+H2(g) ΔH4 = +131.3kJ∙mol-1。
(2)反应ⅰ的ΔH1=___________ 。
(3)在恒温恒容的密闭容器中,关于反应ⅲ叙述正确的是___________。
(4)某容器中加入一定量的CO2和H2,保持温度和压强不变的情况下,达平衡后再向该容器中注入Ar稀释,反应ⅲ的化学平衡将___________ (填“正向移动”“逆向移动”或“不移动”),平衡时,CO2的分压P(CO2)___________ (填“增大”、“减小”或“不变”,下同)。
(5)以4molH2和1molCO2为初始原料,在催化剂(Ni/xMg)作用下保持总压为P0时,若只发生反应 ,不同温度下在相同时间测得CO2的转化率如图所示。
,不同温度下在相同时间测得CO2的转化率如图所示。
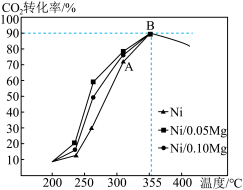
①B点的平衡常数KP___________ 。
②由图像可知,影响该催化剂活性的因素有___________ 。
Ⅰ.化石燃料的燃烧产生大量的二氧化碳。已知25℃时,相关物质的燃烧热数据如表:
| 物质 | H2(g) | C(石墨,s) | C2H2(l) |
| 燃烧热ΔH(kJ∙mol-1) | -285.8 | -393.5 | -1299.5 |
Ⅱ.二氧化碳甲烷化反应合成替代天然气,是利用二氧化碳的技术之一
甲烷化主反应:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH =-165 kJ∙mol-1
CH4(g)+2H2O(g) ΔH =-165 kJ∙mol-1副反应:ⅰ.CO(g)+3H2(g)
 CH4(g)+H2O(g) ΔH1 =___________;
CH4(g)+H2O(g) ΔH1 =___________;ⅱ.
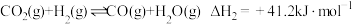 ;
;ⅲ.
 =-90kJ∙mol-1;
=-90kJ∙mol-1;ⅳ. C(s)+H2O(g)
 CO(g)+H2(g) ΔH4 = +131.3kJ∙mol-1。
CO(g)+H2(g) ΔH4 = +131.3kJ∙mol-1。(2)反应ⅰ的ΔH1=
(3)在恒温恒容的密闭容器中,关于反应ⅲ叙述正确的是___________。
| A.用CO2、H2、H2O表示的速率之比为1:2:2,可以作为判断化学平衡的依据。 |
| B.容器中气体的压强不变,不能作为平衡的判断依据。 |
| C.容器内的气体密度不变时,可以作为平衡的判断依据。 |
| D.使用催化剂不能改变平衡转化率。 |
(5)以4molH2和1molCO2为初始原料,在催化剂(Ni/xMg)作用下保持总压为P0时,若只发生反应
 ,不同温度下在相同时间测得CO2的转化率如图所示。
,不同温度下在相同时间测得CO2的转化率如图所示。
①B点的平衡常数KP
②由图像可知,影响该催化剂活性的因素有
您最近一年使用:0次
解题方法
3 . 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料。实验室可用苯甲醛和乙酸酐、醋酸钠等原料经下列反应制取肉桂酸,其中苯甲醛为无色油状液体。已知:
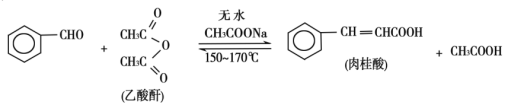
I.合成:反应装置如图所示。向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀。在150~170℃加热1小时,保持微沸状态。
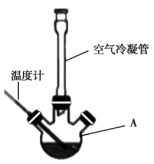
(1)仪器A的名称为____ 。
(2)空气冷凝管的作用是____ ,该装置加热要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是____ 。
(3)不能把无水CH3COONa换成CH3COONa•3H2O的原因是____ 。
II.粗品精制:已知水蒸气蒸馏是分离提纯有机化合物的重要方法之一,在水蒸气蒸馏操作中,水蒸气起到载热体和降低沸点的作用,可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的。
将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
a.在搅拌下,向反应液中加入20mL水
b.再慢慢加入碳酸钠溶液
c.然后进行水蒸气蒸馏
d.待烧瓶内溶液冷却至室温,在搅拌下,加入盐酸酸化,析出大量晶体,过滤,洗涤,干燥。
(4)饱和Na2CO3溶液的作用有____ 。水蒸气蒸馏可除去的杂质是____ ;如何判断蒸馏终点____ 。
(5)若得到的肉桂酸晶体产品不纯,应采用____ 法可得到纯度更高的产品。
(6)若最后得到纯净的肉桂酸5.2g,则该反应中的产率是____ (保留两位有效数字)。

| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇水易水解成乙酸 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |
| 相对分子质量 | 106 | 102 | 148 | 60 |

(1)仪器A的名称为
(2)空气冷凝管的作用是
(3)不能把无水CH3COONa换成CH3COONa•3H2O的原因是
II.粗品精制:已知水蒸气蒸馏是分离提纯有机化合物的重要方法之一,在水蒸气蒸馏操作中,水蒸气起到载热体和降低沸点的作用,可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的。
将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
a.在搅拌下,向反应液中加入20mL水
b.再慢慢加入碳酸钠溶液
c.然后进行水蒸气蒸馏
d.待烧瓶内溶液冷却至室温,在搅拌下,加入盐酸酸化,析出大量晶体,过滤,洗涤,干燥。
(4)饱和Na2CO3溶液的作用有
(5)若得到的肉桂酸晶体产品不纯,应采用
(6)若最后得到纯净的肉桂酸5.2g,则该反应中的产率是
您最近一年使用:0次
2022-09-05更新
|
260次组卷
|
2卷引用:山东省泰安市2021-2022学年高二下学期期末考试化学试题
名校
解题方法
4 . 苯甲酸甲酯是重要的化工原料,某化学兴趣小组仿照实验室制乙酸乙酯的原理以苯甲酸和甲醇为原料制备苯甲酸甲酯。有关数据如下:
Ⅰ.合成苯甲酸甲酯粗产品。在圆底烧瓶中加入适量苯甲酸和过量甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,在圆底烧瓶上连接冷凝回流装置后,小心加热2小时,得苯甲酸甲酯粗产品。回答下列问题:
(1)该反应的化学方程式为_________ 。
(2)实验中,应选择_______ (填序号)作为冷凝回流装置,该仪器的名称为________ 。__________ 。
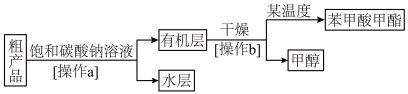
Ⅱ.粗产品的精制。苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用如图流程图进行精制。_________ ,操作b的名称为_______ 。
(5)该实验中制得的甲醇可以在Cu的作用下被氧化为甲醛,方程式为_______ 。
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/( ) ) | 水溶性 | |
| 苯甲酸 | 122 | 122.4 | 249 | 1.2659 | 微溶 |
| 甲醇 | 32 | -97 | 64.6 | 0.792 | 互溶 |
| 苯甲酸甲酯 | 136 | -12.3 | 196.6 | 1.0888 | 不溶 |
Ⅰ.合成苯甲酸甲酯粗产品。在圆底烧瓶中加入适量苯甲酸和过量甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,在圆底烧瓶上连接冷凝回流装置后,小心加热2小时,得苯甲酸甲酯粗产品。回答下列问题:
(1)该反应的化学方程式为
(2)实验中,应选择
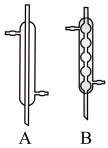
Ⅱ.粗产品的精制。苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用如图流程图进行精制。
(5)该实验中制得的甲醇可以在Cu的作用下被氧化为甲醛,方程式为
您最近一年使用:0次
2020-08-31更新
|
230次组卷
|
2卷引用:山东省枣庄市第三中学2019-2020学年高二下学期期中考试化学试题



