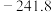解题方法
1 . 乙烯是一种基本化工原料,广泛应用于高新材料合成、医药合成等。工业上,乙烯的制备途径有多种。回答下列问题:
(1)二氧化碳催化加氢制备乙烯
反应原理: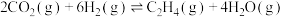
 。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓(
。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓( )是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。
)是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。
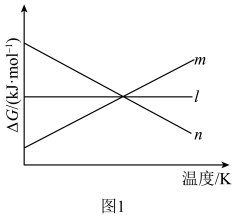
①△H=______ ;△G随着温度变化的三种趋势如图1所示,能用来表示该反应的曲线是________ (填字母标号)。 和3mol
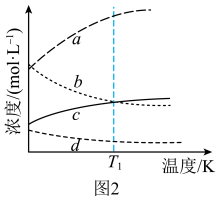
和3mol  ,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表
,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表 的曲线是
的曲线是______ (填字母标号); K时,该反应的化学平衡常数
K时,该反应的化学平衡常数
___________ 。
主反应:
副反应:
某温度下,向0.5L恒容密闭容器中充入1mol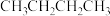 (g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。
(g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。
①反应开始至达平衡过程中,副反应平均反应速率v(丙烯)=_______ 。
②平衡时乙烯的选择性η(乙烯)=_________ 。
[已知选择性 ]
]
③第12min时,其他条件不变,扩大容器容积至1L,至14min体系再次达到平衡,请在图3中画出乙烯的浓度随时间的变化曲线示意图_________ 。
(1)二氧化碳催化加氢制备乙烯
反应原理:
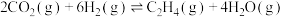
 。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓(
。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓( )是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。
)是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。物质 |
|
|
|
|
|
| 0 | 52.3 |
|
 和3mol
和3mol  ,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表
,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表 的曲线是
的曲线是 K时,该反应的化学平衡常数
K时,该反应的化学平衡常数
主反应:

副反应:

某温度下,向0.5L恒容密闭容器中充入1mol
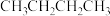 (g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。
(g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。①反应开始至达平衡过程中,副反应平均反应速率v(丙烯)=
②平衡时乙烯的选择性η(乙烯)=
[已知选择性
 ]
]③第12min时,其他条件不变,扩大容器容积至1L,至14min体系再次达到平衡,请在图3中画出乙烯的浓度随时间的变化曲线示意图

您最近半年使用:0次
2 . 下列事实中,不能用勒夏特列原理解释的是
①在含有 的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
② ,工业上将钾蒸气从反应混合体系中分离出来,以制备金属钾
,工业上将钾蒸气从反应混合体系中分离出来,以制备金属钾
③实验室常用排饱和食盐水的方法收集氯气
④恒温恒压的容器中有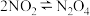 ,若通入Ar,气体的颜色先变浅后逐渐加深
,若通入Ar,气体的颜色先变浅后逐渐加深
⑤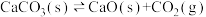 ,平衡时将容器的体积缩小至一半,新平衡的
,平衡时将容器的体积缩小至一半,新平衡的 浓度与原平衡相同
浓度与原平衡相同
⑥由 (g)、
(g)、 (g)和HI(g)组成的平衡体系加压后颜色变深
(g)和HI(g)组成的平衡体系加压后颜色变深
⑦500℃时比室温更有利于合成氨的反应
⑧将混合气体中的氨液化有利于合成氨反应
①在含有
 的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去②
 ,工业上将钾蒸气从反应混合体系中分离出来,以制备金属钾
,工业上将钾蒸气从反应混合体系中分离出来,以制备金属钾③实验室常用排饱和食盐水的方法收集氯气
④恒温恒压的容器中有
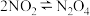 ,若通入Ar,气体的颜色先变浅后逐渐加深
,若通入Ar,气体的颜色先变浅后逐渐加深⑤
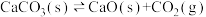 ,平衡时将容器的体积缩小至一半,新平衡的
,平衡时将容器的体积缩小至一半,新平衡的 浓度与原平衡相同
浓度与原平衡相同⑥由
 (g)、
(g)、 (g)和HI(g)组成的平衡体系加压后颜色变深
(g)和HI(g)组成的平衡体系加压后颜色变深⑦500℃时比室温更有利于合成氨的反应
⑧将混合气体中的氨液化有利于合成氨反应
| A.①②⑥⑧ | B.①③⑥⑧ | C.⑤⑥⑦ | D.②③⑦⑧ |
您最近半年使用:0次
名校
3 . 实验室以活性炭为催化剂,由CoCl2·6H2O制备[Co(NH3)6]Cl3的流程如下。

已知:Co2+在pH=9.4时完全沉淀为Co(OH)2。
下列说法错误的是

已知:Co2+在pH=9.4时完全沉淀为Co(OH)2。
下列说法错误的是
| A.步骤①中NH4Cl可抑制NH3·H2O电离,防止生成Co(OH)2 |
B.步骤②中的反应为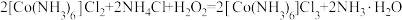 |
| C.温度越高,越有利于[Co(NH3)6]Cl3的生成 |
| D.步骤③中加入浓盐酸,降低了[Co(NH3)6]Cl3在水中的溶解度 |
您最近半年使用:0次
名校
4 . CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l) H2O(l)+NH2CONH2(l) ΔH=
H2O(l)+NH2CONH2(l) ΔH=___________ kJ/mol。
Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(2)制备“合成气”反应历程分两步:
上述反应中C(ads)为吸附性活性炭,反应历程的能量图变化如下图所示:
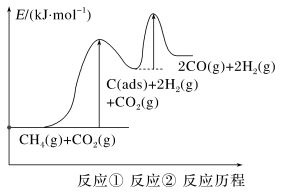
①反应速率快慢比较:反应①___________ 反应②(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因___________ 。
②一定温度下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=___________ (用k1、k2、k3、k4表示)。
(3)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
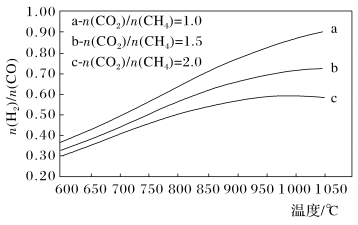
随着进料比 的增加,
的增加, 的值
的值___________ (填“增大”、“不变”或“减小”),其原因是___________ 。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)
 H2O(l)+NH2CONH2(l) ΔH=
H2O(l)+NH2CONH2(l) ΔH=Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。(2)制备“合成气”反应历程分两步:
| 步骤 | 反应 | 正反应速率方程 | 逆反应速率方程 |
| 反应① | CH4(g) C(ads)+2H2(g) C(ads)+2H2(g) | v正=k1·c(CH4) | v逆=k2·c2(H2) |
| 反应② | C(ads)+CO2(g) 2CO(g) 2CO(g) | v正=k3·c(CO2) | v逆=k4·c2(CO) |

①反应速率快慢比较:反应①
②一定温度下,反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=(3)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
随着进料比
 的增加,
的增加, 的值
的值
您最近半年使用:0次
名校
5 . KSCN是实验室常用的化学试剂。
(1)探究KCl浓度对Fe3+与SCN-显色反应的影响
将25mL0.005mol•L-1FeCl3与25mL0.01mol•L-1KSCN溶液混合得红色溶液,各取3mL溶液分别加KCl晶体进行透光实验,结果如图所示。
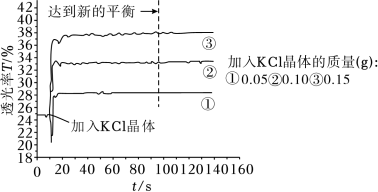
已知:i.溶液颜色越浅,透光率(T)越高;
ii.FeCl3溶液中存在Fe3++4Cl- [FeCl4]-(黄色)。
[FeCl4]-(黄色)。
①采用FeCl3稀溶液是为了避免_______ (填离子符号)的颜色对实验干扰。
②由实验结果分析,随着KCl浓度增大,Fe(SCN)3的浓度_______ (填“增大”“减小”或“不变”),从平衡移动的角度分析可能的原因_______ 。
(2)探究KSCN在铜含量测定过程中的作用
步骤如下:取1.0g铜盐样品溶于稀盐酸配成250mL溶液,取10.00mL加入过量KI充分反应,用0.0100mol•L-1的Na2S2O3标准液滴定至终点。
已知:i.2Cu2++4I-=2CuI↓+I2;2S2O +I2=S4O
+I2=S4O +2I-;
+2I-;
ii.I2+I- I
I ,CuI沉淀强烈吸附I
,CuI沉淀强烈吸附I ;
;
iii.Ksp(CuI)=1.0×10-12;Ksp(CuSCN)=4.8×10-15
①以淀粉为指示剂,滴定终点的颜色变化为_______ ;根据信息预测最终测定的结果将_______ (填“偏大”“偏小”或“无影响”)。
②通过实验探究,在滴定过程中加入KSCN可使测定结果更准确,写出发生反应的离子方程式_______ ;到达滴定终点时消耗标准液20.00mL,样品中铜元素质量分数为_______ ,滴定后仍存在少量CuI沉淀,测得溶液中c(I-)=0.2mol•L-1,则c(SCN-)=_______ 。
(1)探究KCl浓度对Fe3+与SCN-显色反应的影响
将25mL0.005mol•L-1FeCl3与25mL0.01mol•L-1KSCN溶液混合得红色溶液,各取3mL溶液分别加KCl晶体进行透光实验,结果如图所示。

已知:i.溶液颜色越浅,透光率(T)越高;
ii.FeCl3溶液中存在Fe3++4Cl-
 [FeCl4]-(黄色)。
[FeCl4]-(黄色)。①采用FeCl3稀溶液是为了避免
②由实验结果分析,随着KCl浓度增大,Fe(SCN)3的浓度
(2)探究KSCN在铜含量测定过程中的作用
步骤如下:取1.0g铜盐样品溶于稀盐酸配成250mL溶液,取10.00mL加入过量KI充分反应,用0.0100mol•L-1的Na2S2O3标准液滴定至终点。
已知:i.2Cu2++4I-=2CuI↓+I2;2S2O
 +I2=S4O
+I2=S4O +2I-;
+2I-;ii.I2+I-
 I
I ,CuI沉淀强烈吸附I
,CuI沉淀强烈吸附I ;
;iii.Ksp(CuI)=1.0×10-12;Ksp(CuSCN)=4.8×10-15
①以淀粉为指示剂,滴定终点的颜色变化为
②通过实验探究,在滴定过程中加入KSCN可使测定结果更准确,写出发生反应的离子方程式
您最近半年使用:0次
2024-04-05更新
|
51次组卷
|
3卷引用:山东省青岛第十五中学2023-2024学年高二下学期期初考试化学试卷
解题方法
6 . 下列叙述与对应的图示相符合的是
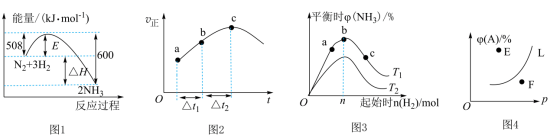

A.图1为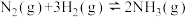 反应过程中的能量变化图,利用勒夏特列原理能解释工业上选择 反应过程中的能量变化图,利用勒夏特列原理能解释工业上选择 左右合成氨比室温更有利 左右合成氨比室温更有利 |
B.图2为在绝热恒容密闭容器中通入 和 和 ,反应 ,反应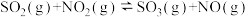 的 的 图,由图可知该反应为放热反应 图,由图可知该反应为放热反应 |
C.图3为合成氨反应中,保持其他条件不变,起始时 用量、反应温度对反应的影响图,则图中温度 用量、反应温度对反应的影响图,则图中温度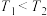 , , 、 、 、 、 三点均处于平衡状态,反应物 三点均处于平衡状态,反应物 的平衡转化率:a<b<c 的平衡转化率:a<b<c |
D.图4为反应 平衡时 平衡时 的体积分数与反应压强的关系图,则 的体积分数与反应压强的关系图,则 点: 点: |
您最近半年使用:0次
名校
7 . 下列有关对应图像的说法正确的是

A.据①知,某温度下,平衡状态由A变到B时,平衡常数 |
B.据平衡常数的负对数(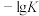 )—温度(T)图像②知,30℃时,B点对应状态的 )—温度(T)图像②知,30℃时,B点对应状态的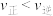 |
C.由 的稳定性与溶液pH的关系可知图③中 的稳定性与溶液pH的关系可知图③中 |
D.图④所示体系中气体平均摩尔质量: , , |
您最近半年使用:0次
8 . 关于反应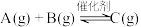
 ,下列说法正确的是
,下列说法正确的是
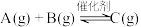
 ,下列说法正确的是
,下列说法正确的是| A.一定是自发反应 |
| B.温度升高,逆反应速率减慢 |
| C.反应物浓度增大,平衡向正反应方向进行 |
| D.催化剂不参与化学反应 |
您最近半年使用:0次
9 . 已知:[Co( H2O)6]2+呈粉红色,[CoCl4]2-呈蓝色,[ZnCl4]2- 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下: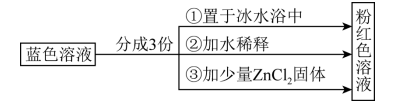
| A.由实验①可推知正反应为放热反应 |
| B.等物质的量的 [Co( H2O)6]2+和 [CoCl4]2-中σ键数之比为 9:2 |
| C.实验②是由于c(H2O)增大,导致平衡逆向移动 |
| D.由实验③可知配离子的稳定性:[ZnCl4]2->[CoCl4]2- |
您最近半年使用:0次
2024-03-24更新
|
50次组卷
|
2卷引用:山东省泰安市新泰第一中学老校区(新泰中学)2023-2024学年高二下学期第一次月考化学试题
10 . CO2的回收与利用是科学家研究的热点课题。工业上有一种用 CO2生产甲醇燃料的方法:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。将6mol CO2和8mol H2充入2L的恒温刚性密闭容器中,测得的氢气物质的量随时间变化如图所示(实线)。

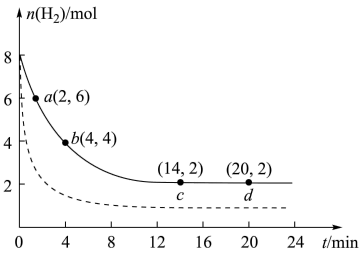
(1)a点正反应速率___________ (填大于、等于或小于)b点逆反应速率,前4min内,用CH3OH表示的平均反应速率为___________ mol/(L·min)(保留两位有效数字)。
(2)平衡时CO2的转化率为___________ ,该条件下反应的平衡常数K=___________ 。
(3)若达到平衡后往容器中分别充入CO2、H2O各2mol,请问v正___________ v逆(填“大于”,“小于”或者“等于”)。
(4)仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是___________ 。
(5)如果要加快反应速率并且提高CO2平衡转化率,可以采取的措施有___________ (写任意两个即可)。


(1)a点正反应速率
(2)平衡时CO2的转化率为
(3)若达到平衡后往容器中分别充入CO2、H2O各2mol,请问v正
(4)仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,对应的实验条件改变的是
(5)如果要加快反应速率并且提高CO2平衡转化率,可以采取的措施有
您最近半年使用:0次

 (g)
(g)