1 . 已知 ,在酸化的KI溶液中通入
,在酸化的KI溶液中通入 ,观察到溶液变为棕色并出现混浊,继续通入
,观察到溶液变为棕色并出现混浊,继续通入 ,直到溶液棕色恰好褪去,发生的反应分别为:
,直到溶液棕色恰好褪去,发生的反应分别为: ,
, ,下列说法错误的是
,下列说法错误的是
 ,在酸化的KI溶液中通入
,在酸化的KI溶液中通入 ,观察到溶液变为棕色并出现混浊,继续通入
,观察到溶液变为棕色并出现混浊,继续通入 ,直到溶液棕色恰好褪去,发生的反应分别为:
,直到溶液棕色恰好褪去,发生的反应分别为: ,
, ,下列说法错误的是
,下列说法错误的是A. 和水在KI的催化下可以发生氧化还原反应 和水在KI的催化下可以发生氧化还原反应 |
| B.物质的氧化性或还原性强弱与浓度有关 |
C.整个过程中被氧化的 和被还原的 和被还原的 物质的量比为1:2 物质的量比为1:2 |
| D.配制碘酒时可以加入一定量KI |
您最近一年使用:0次
2 .  是制备新能源汽车钴酸锂电池的重要原料。某化学学习小组设计如图实验装置制备
是制备新能源汽车钴酸锂电池的重要原料。某化学学习小组设计如图实验装置制备 ,并探究其有关性质。
,并探究其有关性质。

已知:ⅰ.无水 为蓝色,易溶于水及乙醇等有机溶剂。
为蓝色,易溶于水及乙醇等有机溶剂。
ⅱ. 常用作吸水剂,遇水剧烈水解生成
常用作吸水剂,遇水剧烈水解生成 和
和 ,其熔点
,其熔点 ,沸点
,沸点 ,
, 以上时易分解。
以上时易分解。
回答下列问题:
(1)仪器a的名称是_______ 。
(2)滴加 ,一段时间后容器A中充满白雾,发生反应的化学方程式为
,一段时间后容器A中充满白雾,发生反应的化学方程式为_______ 。
(3)无水 的作用是
的作用是_______ 。
(4)将A中反应混合物隔绝空气减压蒸馏,得到无水 晶体。下列装置适合作为冷凝和接收装置的是
晶体。下列装置适合作为冷凝和接收装置的是_______ (填序号)。

(5)某同学向无水氯化钴中加入95%乙醇溶液,得到蓝色溶液,滴加蒸馏水溶液由蓝色变为粉红色【查阅资料得知 为蓝色、
为蓝色、 为粉红色】。
为粉红色】。
①变色过程中发生反应的离子方程式为_______ 。
②资料显示变色反应为可逆反成,请选取合适试剂设计实验进行证明,简述实验方案_______ (可进用的试剂,浓盐酸、蒸馏水、稀硫酸)。
 是制备新能源汽车钴酸锂电池的重要原料。某化学学习小组设计如图实验装置制备
是制备新能源汽车钴酸锂电池的重要原料。某化学学习小组设计如图实验装置制备 ,并探究其有关性质。
,并探究其有关性质。
已知:ⅰ.无水
 为蓝色,易溶于水及乙醇等有机溶剂。
为蓝色,易溶于水及乙醇等有机溶剂。ⅱ.
 常用作吸水剂,遇水剧烈水解生成
常用作吸水剂,遇水剧烈水解生成 和
和 ,其熔点
,其熔点 ,沸点
,沸点 ,
, 以上时易分解。
以上时易分解。回答下列问题:
(1)仪器a的名称是
(2)滴加
 ,一段时间后容器A中充满白雾,发生反应的化学方程式为
,一段时间后容器A中充满白雾,发生反应的化学方程式为(3)无水
 的作用是
的作用是(4)将A中反应混合物隔绝空气减压蒸馏,得到无水
 晶体。下列装置适合作为冷凝和接收装置的是
晶体。下列装置适合作为冷凝和接收装置的是
(5)某同学向无水氯化钴中加入95%乙醇溶液,得到蓝色溶液,滴加蒸馏水溶液由蓝色变为粉红色【查阅资料得知
 为蓝色、
为蓝色、 为粉红色】。
为粉红色】。①变色过程中发生反应的离子方程式为
②资料显示变色反应为可逆反成,请选取合适试剂设计实验进行证明,简述实验方案
您最近一年使用:0次
解题方法
3 . 铬与铝性质相似,但活泼性比铝弱、熔点比铝高。下列说法错误的是
| A.可用铝热反应制备铬 |
| B.常温下铬在浓硝酸中发生钝化 |
C.可直接蒸发 溶液制备无水 溶液制备无水 |
D.已知碱性条件下,Cr(Ⅲ)可被氧化为Cr(Ⅵ),则其氧化产物为 |
您最近一年使用:0次
4 . 利用某一工业钴渣(主要成分为 ,含少量
,含少量 、
、 、MgO、CuO)制备金属钴的流程如图所示:
、MgO、CuO)制备金属钴的流程如图所示:
①沉淀1为黄钠铁矾,化学式为: 。
。
②当某离子浓度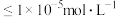 时认为沉淀完全,
时认为沉淀完全, ,
, ,
, ,
, ,
,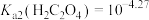
③氧化性:
(1)“浸出”过程中 元发生反应的离子方程式为
元发生反应的离子方程式为_______ ,用盐酸代替硫酸的缺点是_______ 。
(2)“浸出液”中加入 的作用是
的作用是_______ ,试剂a为_______ 。
(3)有机萃取剂用HR表示,发生萃取的反应可表示为 ,为回收
,为回收 ,可向有机相中加入一定浓度的
,可向有机相中加入一定浓度的 ,将其反萃取到水相,其原理是
,将其反萃取到水相,其原理是_______ 。
(4)沉淀2为 ,当
,当 恰好沉淀完全时,溶液中HF浓度为
恰好沉淀完全时,溶液中HF浓度为 ,则此时溶液的pH=
,则此时溶液的pH=_______ 。用 溶液沉钴,其水溶液中存在反应
溶液沉钴,其水溶液中存在反应 ,其平衡常数为K,则K=
,其平衡常数为K,则K=_______ 。
(5)已知氧化性: 。工业上采用惰性电极电解
。工业上采用惰性电极电解 溶液制取钴,不用
溶液制取钴,不用 溶液代替
溶液代替 溶液的原因是
溶液的原因是_______ 。
 ,含少量
,含少量 、
、 、MgO、CuO)制备金属钴的流程如图所示:
、MgO、CuO)制备金属钴的流程如图所示: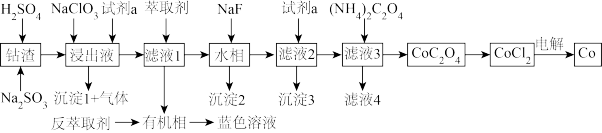
①沉淀1为黄钠铁矾,化学式为:
 。
。②当某离子浓度
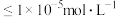 时认为沉淀完全,
时认为沉淀完全, ,
, ,
, ,
, ,
,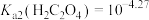
③氧化性:

(1)“浸出”过程中
 元发生反应的离子方程式为
元发生反应的离子方程式为(2)“浸出液”中加入
 的作用是
的作用是(3)有机萃取剂用HR表示,发生萃取的反应可表示为
 ,为回收
,为回收 ,可向有机相中加入一定浓度的
,可向有机相中加入一定浓度的 ,将其反萃取到水相,其原理是
,将其反萃取到水相,其原理是(4)沉淀2为
 ,当
,当 恰好沉淀完全时,溶液中HF浓度为
恰好沉淀完全时,溶液中HF浓度为 ,则此时溶液的pH=
,则此时溶液的pH= 溶液沉钴,其水溶液中存在反应
溶液沉钴,其水溶液中存在反应 ,其平衡常数为K,则K=
,其平衡常数为K,则K=(5)已知氧化性:
 。工业上采用惰性电极电解
。工业上采用惰性电极电解 溶液制取钴,不用
溶液制取钴,不用 溶液代替
溶液代替 溶液的原因是
溶液的原因是
您最近一年使用:0次
5 . 下列各组实验所选玻璃仪器和试剂,不能达到实验目的的是(不考虑存放试剂的容器)
| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 测定某NaOH溶液的浓度 | 酸式滴定管、碱式滴定管、烧杯 |  HCl溶液、酚酞试剂、待测NaOH溶液、蒸馏水 HCl溶液、酚酞试剂、待测NaOH溶液、蒸馏水 |
| B | 探究浓度对化学平衡的影响 | 胶头滴管、试管、量筒 | 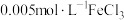 溶液、 溶液、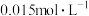 KSCN溶液、 KSCN溶液、 KSCN溶液 KSCN溶液 |
| C | 比较氯、溴、碘的非金属性 | 试管、胶头滴管 | 新制氯水、溴水、NaBr溶液、NaI溶液 |
| D | 验证铁盐的氧化性 | 试管、胶头滴管 |  溶液、KI溶液、淀粉溶液 溶液、KI溶液、淀粉溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层) RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤酸浸过程中发生氧化还原反应的化学方程式为______________________ 。
(2)萃取时应加入适量碱的作用是___________________ 。
(3)步骤④中反应的离子方程式为___________________ 。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____ mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______ 。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为VO+,则V2O5与氢碘酸反应的离子方程式为_________________ 。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______ mol/L(萃取的量=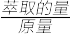 ×100%)
×100%)

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)
 RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)回答下列问题:
(1)步骤酸浸过程中发生氧化还原反应的化学方程式为
(2)萃取时应加入适量碱的作用是
(3)步骤④中反应的离子方程式为
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为VO+,则V2O5与氢碘酸反应的离子方程式为
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=
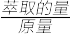 ×100%)
×100%)
您最近一年使用:0次
2018-03-20更新
|
586次组卷
|
4卷引用:山东省潍坊市2018届高三下学期一模考试理综化学试题
名校
解题方法
7 . 缓冲和供氧是维持人体正常生理活动的两个重要平衡系统,回答下列问题:
Ⅰ.人体血液中存在平衡:H2CO3 (aq) H+(aq)+HCO3-(aq) ΔH,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) ΔH,该平衡可使血液的pH维持在一定范围内。
(1)已知:CO2(g) CO2(aq) ΔH1=akJ·mol-l;
CO2(aq) ΔH1=akJ·mol-l;
CO2(aq)+H2O(l) H2CO3 (aq) ΔH2=bkJ·mol-1;
H2CO3 (aq) ΔH2=bkJ·mol-1;
HCO (aq)
(aq) H+(aq)+CO
H+(aq)+CO (aq) ΔH3=ckJ·mol-1;
(aq) ΔH3=ckJ·mol-1;
CO2(g)+H2O(l) 2H+(aq)+ CO
2H+(aq)+ CO (aq) ΔH4=dkJ·mol-1。
(aq) ΔH4=dkJ·mol-1。
则上述电离方程式中ΔH =_____________ (用含a、b、c、d的代数式表示)。
(2)若某人血液中c(HCO ):c(H2CO3) = 20:1,pKa1(H2CO3)=6.1,则该人血液的pH为
):c(H2CO3) = 20:1,pKa1(H2CO3)=6.1,则该人血液的pH为______________ 。(lg2=0.3)若pH升高,则c(H2CO3)/c(HCO )=
)=___________ (填“增大”“减小”或“不变”)。
(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:_____________ 。
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡

(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的ΔH_______________ (填“>”或“<”)0。
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:
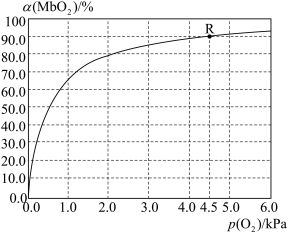
①利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________________ (氧气的平衡浓度可用氧气的平衡分压代替求算)。
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=___________________ 。
Ⅰ.人体血液中存在平衡:H2CO3 (aq)
 H+(aq)+HCO3-(aq) ΔH,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) ΔH,该平衡可使血液的pH维持在一定范围内。(1)已知:CO2(g)
 CO2(aq) ΔH1=akJ·mol-l;
CO2(aq) ΔH1=akJ·mol-l;CO2(aq)+H2O(l)
 H2CO3 (aq) ΔH2=bkJ·mol-1;
H2CO3 (aq) ΔH2=bkJ·mol-1;HCO
 (aq)
(aq) H+(aq)+CO
H+(aq)+CO (aq) ΔH3=ckJ·mol-1;
(aq) ΔH3=ckJ·mol-1;CO2(g)+H2O(l)
 2H+(aq)+ CO
2H+(aq)+ CO (aq) ΔH4=dkJ·mol-1。
(aq) ΔH4=dkJ·mol-1。则上述电离方程式中ΔH =
(2)若某人血液中c(HCO
 ):c(H2CO3) = 20:1,pKa1(H2CO3)=6.1,则该人血液的pH为
):c(H2CO3) = 20:1,pKa1(H2CO3)=6.1,则该人血液的pH为 )=
)=(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡

(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的ΔH
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:

①利用R点所示数据,计算37 ℃时该反应的平衡常数K=
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=
您最近一年使用:0次
2018-03-19更新
|
477次组卷
|
3卷引用:山东省菏泽市2018届高三第一次模拟考试理综化学试题



