解题方法
1 . 工业上合成氨的化学反应,在容积为10L的密闭容器中,通入40molN2和120molH2在一定条件下进行反应,4s后达到平衡状态,此时N2的浓度为2mol/L。通过计算回答下列问题:
(1)用N2表示的4s内化学反应的平均速率是___________ 。
(2)若生成17g氨气,放出46.2kJ热量,写出生成2摩尔氨反应的热化学方程式___________ 。
(3)若外界条件改变为降低温度,则平衡向___________ (填“正反应”或“逆反应”)方向移动,达到平衡后,N2的物质的量浓度___________ (填“大于、小于、等于”)2mol/L
(4)上述反应达到平衡后,在其它条件不变的情况下,通过增大容器体积减小压强,则NH3的合成率___________ (填“增大”“减少”或“不变”)。
(1)用N2表示的4s内化学反应的平均速率是
(2)若生成17g氨气,放出46.2kJ热量,写出生成2摩尔氨反应的热化学方程式
(3)若外界条件改变为降低温度,则平衡向
(4)上述反应达到平衡后,在其它条件不变的情况下,通过增大容器体积减小压强,则NH3的合成率
您最近一年使用:0次
名校
2 . 探究化学反应的快慢和限度具有十分重要的意义。
Ⅰ.某实验小组欲通过用酸性KMnO4和H2C2O4(草酸)反应测定单位时间内生成CO2的速率研究影响反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:

(1)上述反应的离子方程式为:___ ,该实验探究的是___ 对化学反应速率的影响。
(2)若实验①在2min末收集了4.48mLCO2(标准状况下),则在2min末,c(MnO )=
)=____ mol·L-1(假设混合溶液的体积为50mL,反应前后体积变化忽略不计)。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定____ 来比较化学反应速率。
(4)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:___ 。
Ⅱ.K2Cr2O7溶液中存在平衡:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+。用K2Cr2O7溶液进行下列实验:
(黄色)+2H+。用K2Cr2O7溶液进行下列实验:

(5)向K2Cr2O7溶液中加入30%NaOH溶液,溶液呈____ 色,若再加入过量稀硫酸,则溶液呈____ 色。
(6)向K2Cr2O7溶液中逐滴加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向着____ 方向移动,溶液颜色变化为___ 。对比实验②和④可得出的结论是___ 。
Ⅰ.某实验小组欲通过用酸性KMnO4和H2C2O4(草酸)反应测定单位时间内生成CO2的速率研究影响反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL0.1mol·L-1 H2C2O4溶液 | 30mL0.01mol·L-1 KMnO4溶液 |
| ② | 20mL0.2mol·L-1 H2C2O4溶液 | 30mL0.01mol·L-1 KMnO4溶液 |
(2)若实验①在2min末收集了4.48mLCO2(标准状况下),则在2min末,c(MnO
 )=
)=(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定
(4)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:
Ⅱ.K2Cr2O7溶液中存在平衡:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+。用K2Cr2O7溶液进行下列实验:
(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
(5)向K2Cr2O7溶液中加入30%NaOH溶液,溶液呈
(6)向K2Cr2O7溶液中逐滴加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向着
您最近一年使用:0次
2021-09-30更新
|
430次组卷
|
3卷引用:江西省吉安市(吉安县三中、泰和二中、安福二中、井大附中 )2021-2022学年高二上学期9月联考化学试题
3 . 为探讨化学平衡移动原理与氧化还原反应规律的联系,小睿同学通过改变浓度研究:“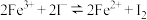 ”反应中Fe3+和Fe2+的相互转化。实验如下:
”反应中Fe3+和Fe2+的相互转化。实验如下:
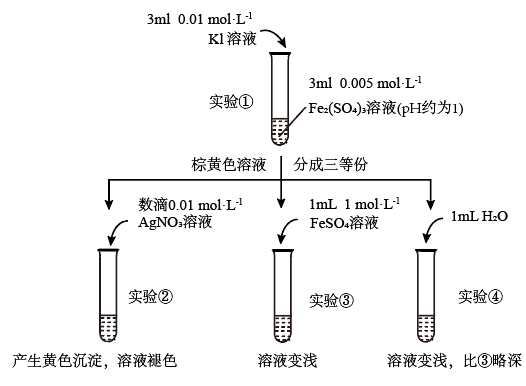
(1)待实验①溶液颜色不再改变时,再进行实验②③④,目的是使实验①的反应达到_______ 。
(2)实验④是实验③的_______ 试验,目的是_______ 。
(3)实验②的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。根据氧化还原反应的规律,该同学推测实验②中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致 的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
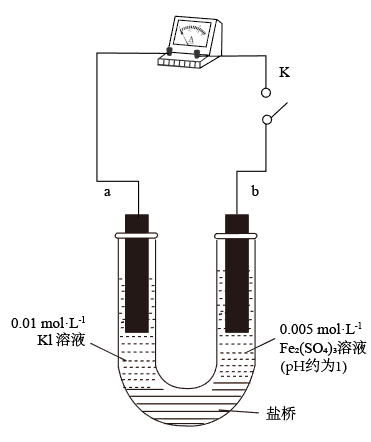
①K闭合时,指针向右偏转,b作_______ 极。
②当指针归零(反应达到平衡)后,向U形管左管滴加0.01 mol/LAgNO3溶液,产生的现象证实了其推测,该现象是_______ 。
(4)按照(3)的原理,该同学用上图装置再进行实验,证实了实验③中Fe2+向Fe3+转化的原因。
①转化原因是_______ 。
②与(3)实验对比,不同的操作是_______ 。
(5)实验①中,还原性:I->Fe2+,而实验②③中,还原性:Fe2+>I-,将(3)和(4)作对比,得出的结论是_______ 。
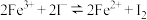 ”反应中Fe3+和Fe2+的相互转化。实验如下:
”反应中Fe3+和Fe2+的相互转化。实验如下:
(1)待实验①溶液颜色不再改变时,再进行实验②③④,目的是使实验①的反应达到
(2)实验④是实验③的
(3)实验②的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。根据氧化还原反应的规律,该同学推测实验②中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致
 的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
①K闭合时,指针向右偏转,b作
②当指针归零(反应达到平衡)后,向U形管左管滴加0.01 mol/LAgNO3溶液,产生的现象证实了其推测,该现象是
(4)按照(3)的原理,该同学用上图装置再进行实验,证实了实验③中Fe2+向Fe3+转化的原因。
①转化原因是
②与(3)实验对比,不同的操作是
(5)实验①中,还原性:I->Fe2+,而实验②③中,还原性:Fe2+>I-,将(3)和(4)作对比,得出的结论是
您最近一年使用:0次
2021-04-26更新
|
289次组卷
|
3卷引用:江西省吉安市(吉安县三中、泰和二中、安福二中、井大附中 )2021-2022学年高二上学期9月联考化学试题
江西省吉安市(吉安县三中、泰和二中、安福二中、井大附中 )2021-2022学年高二上学期9月联考化学试题江苏省昆山市2020-2021学年高二下学期期中教学质量调研化学试题(已下线)2.3.2 影响化学平衡状态的因素-2021-2022学年高二化学课后培优练(人教版选修4)
名校
解题方法
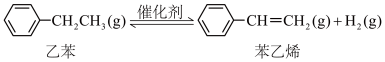
4 . 乙苯是一种常见的有机原料,可以利用乙苯催化脱氢制苯乙烯反应:
(1)已知:
计算上述反应的△H=___ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为a,则在该温度下反应的平衡常数Kp=__ (Kp为以分压表示的平衡常数,用a等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)随温度变化示意图如图所示:
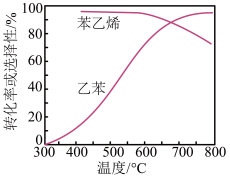
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实:__ 。
②控制反应温度最佳为__ ,理由是__ 。

(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ·mol-1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为a,则在该温度下反应的平衡常数Kp=
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)随温度变化示意图如图所示:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实:
②控制反应温度最佳为
您最近一年使用:0次
2020-08-22更新
|
104次组卷
|
2卷引用:江西省萍乡市芦溪中学2021-2022学年高二上学期期中考试化学(理)试题
5 . 粉煤灰是燃煤产生的重要污染物,主要成分有A12O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。

已知:i伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
ii Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-⇌[FeCl6]3-
(1)写出过程I中Fe2O3发生反应的离子方程式:____ 。
(2)过程II加入过量H2O2的作用是___ 。
(3)过程II加入伯胺一煤油对浸取液进行分离,该操作的名称是_____ 。
(4)从化学平衡角度解释过程III利用NaCI溶液进行反萃取的原理:_____ 。
(5) N2H4具有碱性,可与H+结合生成N2H5+。过程IV中先用过量的N2H4将水层2中Fe3+转化为Fe2+并生成N2,反应的离子方程式为____ ,得到的Fe2+再被O2氧化为FeOOH。
(6)纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。
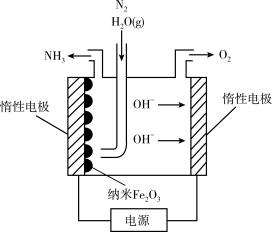
已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生电极反应生成中间体Fe。用化学用语表示Fe2O3在阴极催化生成NH3的反应过程。
第一步:____ ,
第二步:____ 。

已知:i伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O
 Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。ii Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-⇌[FeCl6]3-
(1)写出过程I中Fe2O3发生反应的离子方程式:
(2)过程II加入过量H2O2的作用是
(3)过程II加入伯胺一煤油对浸取液进行分离,该操作的名称是
(4)从化学平衡角度解释过程III利用NaCI溶液进行反萃取的原理:
(5) N2H4具有碱性,可与H+结合生成N2H5+。过程IV中先用过量的N2H4将水层2中Fe3+转化为Fe2+并生成N2,反应的离子方程式为
(6)纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。

已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生电极反应生成中间体Fe。用化学用语表示Fe2O3在阴极催化生成NH3的反应过程。
第一步:
第二步:
您最近一年使用:0次
2019-06-23更新
|
703次组卷
|
4卷引用:江西省丰城中学、高安二中等六校2021届高三1月联考理综化学试题
江西省丰城中学、高安二中等六校2021届高三1月联考理综化学试题(已下线)大题02 化学工艺流程题(二)-【考前抓大题】备战2021年高考化学(全国通用)【区级联考】北京市海淀区2019届高三5月期末练习(二模)理综化学试题福建省“百校联考”2020届高三7月教学摸底质量检查理科综合化学试题
真题
名校
6 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
(1)“滤渣1”含有S和__________________________ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________ 。
(2)“氧化”中添加适量的MnO2的作用是将________________________ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________ 。
(6)写出“沉锰”的离子方程式___________________________________________________ 。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=
时,z=___________ 。
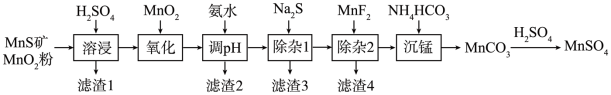
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和
(2)“氧化”中添加适量的MnO2的作用是将
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
 时,z=
时,z=
您最近一年使用:0次
2019-06-09更新
|
19622次组卷
|
29卷引用:江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题
江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)天津市第二十五中学2021-2022学年高三上学期第一次月考化学试题2019年全国统一高考化学试题(新课标Ⅲ)河北省张家口市第四中学2018-2019学年高二下学期6月月考理科综合化学试题 河北省辛集中学2020届高三上学期入学考试化学试题安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题甘肃省高台县第一中学2020届高三上学期期中考试化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训河北省承德市围场卉原中学2020届高三模拟自测联考试卷理综化学试卷2020届四川省成都市第七中学高三三月份网络教学质量监测卷化学试题(已下线)专题6.1 无机化工流程题(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题四川省宜宾市叙州区第二中学校2020届高三第一次高考适应性考试理综化学试题河南省信阳市罗山县2021届高三第一次调研(8月联考)化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)四川省泸州市泸县第五中学2022届高三高考适应性考试理综化学试题(已下线)专题18 工艺流程题(已下线)T26-工业流程题黑龙江省七台河市勃利县高级中学2022-2023学年高三上学期11月期中考试化学试题陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题河南省济源市高级中学2023-2024学年高三上学期高考模拟检测(10月)理科综合试题-高中化学



