9-10高一下·河北·阶段练习
名校
解题方法
1 . 工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2+O2 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是| A.使用催化剂是为了加快反应速率,提高生产效率 |
| B.在上述条件下,SO2不可能100%地转化为SO3 |
| C.为了提高SO2的转化率,应适当提高O2的浓度 |
| D.达到平衡时,SO2的浓度与SO3的浓度相等 |
您最近一年使用:0次
2020-09-27更新
|
511次组卷
|
44卷引用:2015-2016学年宁夏育才中学高一下期中化学试卷
2015-2016学年宁夏育才中学高一下期中化学试卷(已下线)09—10学年衡中高一下学期第二次调研化学试卷(已下线)09~10年锦州一中高一下学期期中考试化学卷(已下线)2011-2012学年湖北省部分中学高一下学期期中考试化学试卷(已下线)2011-2012学年云南省武定县第一中学高二5月月考化学试卷(已下线)2011-2012年吉林长春外国语学校高一下学期期中考试文科化学试卷(已下线)2011-2012学年云南省玉溪一中高一下学期期中考试化学试卷(已下线)2011-2012学年甘肃省武威五中高一下学期期末考试化学试卷(已下线)2012-2013学年湖北省孝感高级中学高一下学期期中考试化学试卷(已下线)2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(已下线)2013-2014安徽省淮南市下学期期末考试高一化学试卷2014-2015学年陕西岐山县高一下学期期末质量检测化学试卷2015-2016学年江苏省泰州中学高一下第一次月考化学试卷2015-2016学年广东省佛山一中高一下期中化学试卷2015-2016学年河南省周口市高一下期末化学试卷(已下线)同步君 必修2 第2章 第3节 化学反应的限度河北省定州市第二中学2016-2017学年高一4月月考化学试题河南省兰考县第二高级中学2016-2017学年高一下学期期末考试化学试题云南省峨山彝族自治县第一中学2016-2017学年高二下学期期末考试化学试题高中化学人教版 必修2 第二章 化学反应与能量 第三节 化学反应的速率和限度 化学反应的限度河南省兰考县第二高级中学2017-2018学年高一下学期期末抽测调研化学试题【全国市级联考】湖北省襄阳市2017-2018学年高一下学期期末调研统一考试化学试题【全国市级联考】辽宁省大连市2017-2018学年高一下学期期末考试(文)化学试题【全国百强校】吉林省实验中学2019届高三上学期第四次模拟考试化学试题【全国百强校】天津市静海区第一中学2018-2019学年高一(合格班)下学期5月月考化学试题广东省佛山市三水区实验中学2018-2019学年高一下学期第三学段考试化学试题四川省遂宁市2018-2019学年高一下学期期末考试化学试题湖南省长郡中学2018-2019学年高一下学期期末考试化学试题广东省惠州市2018-2019学年高二上学期期末考试化学(理科)试题山东省济南外国语学校2019-2020学年高二下学期3月份“空中课堂”阶段性测试化学试题甘肃省甘南藏族自治州合作第一中学2018-2019学年高一下学期期末考试化学试题四川省成都市成华区2019-2020学年高一下学期期末化学试题山西省孝义市第二中学校2019-2020学年高一下学期期末考试化学(B卷)试题四川省武胜烈面中学校2020-2021学年高二上学期开学考试化学试题河南省开封市2019-2020学年高一下学期期末调研考试化学试题广西壮族自治区桂林市第十八中学2020-2021学年高二上学期开学考试化学试题安徽省合肥市第三中学2019-2020学年高二分班考试化学试题贵州省思南中学2020-2021学年高二上学期第一次月考化学试题天津市红桥区2019-2020学年高二上学期期末考试化学试题山西省柳林县2019-2020学年高一下学期期末教学质量检测化学试题四川省南充市2020-2021学年高二上期期末考试化学试题广西桂林市第十八中学2020-2021学年高一下学期期中考试化学试题(已下线)专题2.2.3 影响化学平衡的因素(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)云南省玉溪第二中学2020- 2021学年高二下学期期中考试化学试题
名校
解题方法
2 . 下列解释事实的离子方程式不正确的是
A.铝片放入NaOH溶液中有气体产生:2Al+ 2OH-+2H2O=2AlO +3H2 ↑ +3H2 ↑ |
B.向K2Cr2O7溶液中滴加少量浓 H2SO4,溶液橙色加深:Cr2O (橙色)+H2O (橙色)+H2O 2 CrO 2 CrO (黄色)+ 2H+ (黄色)+ 2H+ |
C.向Na2SiO3溶液中通入过量CO2制备硅酸凝胶:SiO +CO2 +H2O=H2SiO3(胶体) + CO +CO2 +H2O=H2SiO3(胶体) + CO |
D.用Na2CO3溶液浸泡锅炉水垢(含CaSO4):CaSO4+CO  CaCO3+SO CaCO3+SO |
您最近一年使用:0次
2020-09-10更新
|
90次组卷
|
3卷引用:湖南省衡阳市第一中学等十校2019-2020学年高二5月联考化学试题
2020高三·全国·专题练习
名校
解题方法
3 . K2FeO4在水中不稳定,发生反应:4FeO +10H2O
+10H2O 4Fe(OH)3(胶体)+8OH-+3O2↑,其稳定性与温度(T)和溶液pH的关系分别如图所示。下列说法正确的是( )
4Fe(OH)3(胶体)+8OH-+3O2↑,其稳定性与温度(T)和溶液pH的关系分别如图所示。下列说法正确的是( )

 +10H2O
+10H2O 4Fe(OH)3(胶体)+8OH-+3O2↑,其稳定性与温度(T)和溶液pH的关系分别如图所示。下列说法正确的是( )
4Fe(OH)3(胶体)+8OH-+3O2↑,其稳定性与温度(T)和溶液pH的关系分别如图所示。下列说法正确的是( )
| A.由图I可知K2FeO4的稳定性随温度的升高而升高 |
| B.由图II可知图中a>c |
| C.由图I可知温度:T1>T2>T3 |
| D.由图I可知上述反应ΔH<0 |
您最近一年使用:0次
2020-08-10更新
|
772次组卷
|
6卷引用:第17讲 化学平衡计算与图像-2021年高考化学一轮复习名师精讲练
(已下线)第17讲 化学平衡计算与图像-2021年高考化学一轮复习名师精讲练(已下线)本册综合检测(二)——2020-2021学年高二化学选修四同步单元AB卷(人教版)宁夏银川市第二中学2021-2022学年高二下学期期中考试化学试题陕西省汉中中学2021-2022学年高二上学期第三次月考化学试题福建省福州第三中学2022-2023学年高二上学期期末考试化学试题辽宁省东北育才学校2023-2024学年高二上学期第一次月考化学试题
11-12高二下·浙江温州·期中
名校
4 . 已知:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
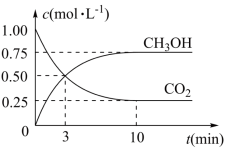

A.升高温度能使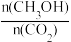 增大 增大 |
| B.反应达到平衡状态时,CO2的平衡转化率为75% |
| C.3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075mol·L-1·min-1 |
您最近一年使用:0次
2020-04-14更新
|
416次组卷
|
20卷引用:宁夏育才中学2019-2020学年高二上学期期末考试化学试题
宁夏育才中学2019-2020学年高二上学期期末考试化学试题(已下线)2011-2012学年浙江瑞安中学高二下学期期中考试化学试卷(已下线)2012-2013学年辽宁瓦房店高级中学高二上学期期中考试化学试卷(已下线)2014届甘肃省武威市第六中学高三上学期第五次月考化学试卷(已下线)2013届北京四中高三上学期开学检测化学试卷2015-2016学年重庆市三峡名校联盟高二上学期12月联考化学试卷【全国百强校】四川省彭州中学2018-2019学年高二上学期10月月考化学试题福建省永春县第一中学2018-2019学年高二上学期期末考试(理)化学试题四川省棠湖中学2019-2020学年高二上学期第一次月考化学试题步步为赢 高二化学寒假作业:作业五 化学平衡的图像分析甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期期末考试化学试题鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第2节 化学反应的限度(已下线)第04练 化学平衡-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)甘肃省天水市第一中学2021-2022学年高二下学期开学检测化学试题甘肃省甘南藏族自治州合作第一中学2021-2022学年高二上学期期末考试化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题 北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题河北省石家庄市第十五中学2023-2024学年高二上学期12月阶段考试化学试题四川省内江市资中县第二中学2023-2024学年高二上学期12月月考化学试题
名校
5 . 溶洞和钟乳石是大自然的杰作。溶洞和钟乳石的形成与自然界中碳及其化合物间的转化有着密切联系。下列有关自然界中碳及其化合物间的转化的说法,不正确的是( )
| A.溶洞是通过CaCO3与H2O、CO2作用生成可溶性的Ca(HCO3)2形成的 |
| B.游客的参观不会对其造成影响 |
| C.溶洞和钟乳石的形成过程中没有涉及氧化还原反应 |
| D.钟乳石是在一定条件下可溶性的Ca(HCO3)2转化成CaCO3的结果 |
您最近一年使用:0次
名校
6 . 下列能用勒沙特列原理解释的是( )
| A.氯化铁溶液加氢氧化钠振荡后产生红褐色沉淀 |
| B.SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| C.棕红色NO2加压后颜色先变深后变浅 |
| D.H2、I2、HI平衡混和气加压后颜色变深 |
您最近一年使用:0次
名校
7 . 下列事实中,不能用勒夏特列原理解释的是
A.溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后颜色变浅 HBr+HBrO,当加入NaOH溶液后颜色变浅 |
B.合成氨反应:N2+3H2 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施 |
C.反应:CO+NO2 CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动 CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动 |
D.对2H2O2 2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率 2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率 |
您最近一年使用:0次
名校
8 . (1)K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
①写出有关的离子方程式____ 。
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol·L-1的NaOH溶液,试管中溶液呈___ 色。
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈___ 色。
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡____ (填“向左移动”或“向右移动”),溶液颜色将___ 。
(2)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①升高温度时,平衡向___ 反应方向移动,正反应为____ (填“吸热”或“放热”)反应,平衡时B、C的浓度之比 将
将____ 。(填“增大”“减小”或“不变”,下同)。
②减小压强时平衡向___ 反应方向移动, A的质量分数___ ,且m+n__ p(填“>”或“<”)。
③若容积不变加入B,则B的转化率____ ,A的转化率____ 。
④若加入催化剂,平衡时气体混合物的总物质的量____ 。
⑤恒温恒容时,通入氦气,A的质量分数____ 。
①写出有关的离子方程式
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol·L-1的NaOH溶液,试管中溶液呈
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡
(2)现有反应:mA(g)+nB(g)
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:①升高温度时,平衡向
 将
将②减小压强时平衡向
③若容积不变加入B,则B的转化率
④若加入催化剂,平衡时气体混合物的总物质的量
⑤恒温恒容时,通入氦气,A的质量分数
您最近一年使用:0次
2019-10-21更新
|
95次组卷
|
2卷引用:宁夏长庆高级中学2019-2020学年高二上学期第一次月考化学试题
名校
9 . 下列不能用勒沙特列原理解释的是( )
| A.Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B.棕红色NO2加压后颜色先变深后变浅 |
| C.SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D.高压比常压有利于NH3的合成 |
您最近一年使用:0次
14-15高二上·河南洛阳·阶段练习
名校
10 . 下列不能用勒夏特列原理解释的事实是
| A.红棕色的NO2加压后颜色先变深后变浅 |
| B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 |
| C.黄绿色的氯水光照后颜色变浅 |
| D.合成氨工业使用高压以提高氨的产量 |
您最近一年使用:0次
2019-09-09更新
|
484次组卷
|
14卷引用:宁夏吴忠中学2017-2018学年高二下学期开学考试化学试题
宁夏吴忠中学2017-2018学年高二下学期开学考试化学试题(已下线)2014-2015学年河南省洛阳市第八中学高二10月月考化学试卷陕西省黄陵中学2017-2018学年高二(普通班)上学期期末考试化学试题吉林省吉林地区普通高中友好学校联合体2017-2018学年高二上学期期末考试化学试题(已下线)2018年9月15日 《每日一题》人教选修4-周末培优【全国百强校】黑龙江省大庆市铁人中学2018-2019学年高二上学期期中考试化学试题【全国百强校】甘肃省会宁县第一中学2018-2019学年高二上学期第二次月考化学试题【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题(已下线)2019年9月14日《每日一题》选修4—— 周末培优山西省朔州市怀仁县第一中学2018-2019学年高二上学期第二次月考化学试题甘肃省临夏中学2019-2020学年高二上学期期中考试化学(理)试题云南省广南县二中2019-2020学年高二上学期期末考试化学试题湖北省沙市中学2019-2020学年高二上学期期末考试化学试题辽宁省凌源市第二高级中学2019-2020学年高二下学期第二次网测化学试题



