名校
解题方法
1 . 在一密闭容器中,反应 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是| A.平衡向逆反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增大了 | D. |
您最近半年使用:0次
2023-11-14更新
|
355次组卷
|
25卷引用:宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题
宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期末考试化学试题吉林省长春希望高中2021-2022学年高二上学期期末考试化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题天津市第二南开学校2022-2023学年高二上学期9月阶段性线上练习化学试题 天津市宁河区芦台第一中学2022-2023学年高二上学期第一次学习诊断化学试题黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期阶段考试(12月)化学试题(已下线)【浙江新东方】双师118安徽省淮北市树人高级中学2020-2021学年高二上学期第一次联考化学试题天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题广西百色中学2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期中阶段性检测化学试题浙江省金华第一中学2022-2023学年高一下学期6月期末化学试题山西省太原市第五中学校2023-2024学年高二上学期10月月考化学试题浙江省浙东北联盟(ZDB)2023-2024学年高二上学期期中考试化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题 北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业03 化学平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题河北省石家庄市第十五中学2023-2024学年高二上学期12月阶段考试化学试题安徽省阜阳市临泉第一中学(高铁分校)2023-2024学年高二上学期期末考试化学试题广东省汕头市潮阳区河溪中学2023-2024学年高二上学期月考化学试题
名校
解题方法
2 . 一定条件下,某可逆反应在密闭容器中建立化学平衡,在t1时刻改变某一个条件,建立新的平衡,其v-t图像如下:
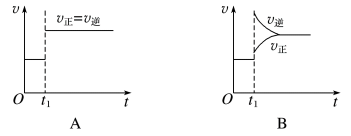
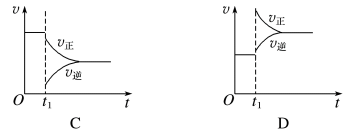
(1)对于反应:2SO2(g)+O2(g)⇌2SO3(g),t1时刻增大压强,其图像为___________ ,平衡___________ (填“向正反应方向”“向逆反应方向”或“不”,下同)移动。
(2)对于反应2NH3(g)⇌N2(g)+3H2(g),t1时刻增大容器体积,其图像为___________ ,平衡___________ 移动。
(3)对于反应N2(g)+3H2(g)⇌2NH3(g) ΔH=-92kJ·mol-1,达到平衡t1时刻其图像为B,则改变的反应条件是___________
(4)对于反应H2(g)+I2(g)⇌2HI(g),t1时刻缩小容器体积,其图像为___________ ,平衡___________ 移动。


(1)对于反应:2SO2(g)+O2(g)⇌2SO3(g),t1时刻增大压强,其图像为
(2)对于反应2NH3(g)⇌N2(g)+3H2(g),t1时刻增大容器体积,其图像为
(3)对于反应N2(g)+3H2(g)⇌2NH3(g) ΔH=-92kJ·mol-1,达到平衡t1时刻其图像为B,则改变的反应条件是
(4)对于反应H2(g)+I2(g)⇌2HI(g),t1时刻缩小容器体积,其图像为
您最近半年使用:0次
名校
3 . 有一处于平衡状态的反应:X(g)+3Y(g)⇌2Z(g) ΔH>0(正反应为吸热反应)。为了使平衡向生成Z的方向移动,可以选择下列哪些条件
①高温②低温③高压④低压⑤加催化剂⑥移除Z
①高温②低温③高压④低压⑤加催化剂⑥移除Z
| A.①④⑥ | B.②③⑤ | C.①③⑥ | D.②③⑥ |
您最近半年使用:0次
名校
4 . 关于下列说法正确的是
| A.化学平衡发生移动,化学反应速率一定改变;化学反应速率改变,化学平衡也一定发生移动 |
B.C(s)+CO2(g) 2CO(g) ΔH>0,其他条件不变时,升高温度,反应速率v(CO2)和CO2的平衡转化率均增大 2CO(g) ΔH>0,其他条件不变时,升高温度,反应速率v(CO2)和CO2的平衡转化率均增大 |
C.向平衡体系FeCl3+3KSCN Fe(SCN)3+3KCl中加入适量KCl固体,平衡逆向移动,溶液的颜色变浅 Fe(SCN)3+3KCl中加入适量KCl固体,平衡逆向移动,溶液的颜色变浅 |
D.对于2NO2(g) N2O4(g)的平衡体系,压缩体积,增大压强,平衡正向移动,混合气体的颜色变浅 N2O4(g)的平衡体系,压缩体积,增大压强,平衡正向移动,混合气体的颜色变浅 |
您最近半年使用:0次
名校
5 . 往 溶液中滴加少量
溶液中滴加少量 溶液,溶液呈红色,发生如下反应:
溶液,溶液呈红色,发生如下反应: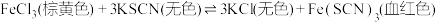 ,下列说法中正确的是
,下列说法中正确的是
 溶液中滴加少量
溶液中滴加少量 溶液,溶液呈红色,发生如下反应:
溶液,溶液呈红色,发生如下反应: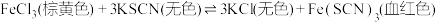 ,下列说法中正确的是
,下列说法中正确的是A.往上述溶液中滴入 溶液,溶液红色变浅 溶液,溶液红色变浅 |
B.往上述溶液中滴入 溶液,溶液红色变浅 溶液,溶液红色变浅 |
| C.往上述溶液中加入铁粉,溶液红色加深 |
D.往上述溶液中滴入 溶液,溶液红色不变 溶液,溶液红色不变 |
您最近半年使用:0次
2023-08-09更新
|
238次组卷
|
4卷引用:宁夏银川市第二中学2021-2022学年高二下学期第一次月考化学试题
宁夏银川市第二中学2021-2022学年高二下学期第一次月考化学试题(已下线)6.2.2 化学平衡(第2课时 化学平衡移动)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)浙江省台州市台州八校联盟2022-2023学年高二上学期11月期中联考化学试题天津市北辰区2023-2024学年高二上学期期中考试化学试题
名校
解题方法
6 . 在K2Cr2O7溶液中存在平衡:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+,溶液颜色介于黄色和橙色之间,现欲使溶液颜色变浅,可以在溶液中加入
(黄色)+2H+,溶液颜色介于黄色和橙色之间,现欲使溶液颜色变浅,可以在溶液中加入
①H+ ②OH- ③K+ ④H2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+,溶液颜色介于黄色和橙色之间,现欲使溶液颜色变浅,可以在溶液中加入
(黄色)+2H+,溶液颜色介于黄色和橙色之间,现欲使溶液颜色变浅,可以在溶液中加入①H+ ②OH- ③K+ ④H2O
| A.①③ | B.②④ | C.①④ | D.②③ |
您最近半年使用:0次
2023-01-05更新
|
426次组卷
|
9卷引用:宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题
宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题天津市河北区2022-2023学年高二上学期期末考试化学试题福建省厦门外国语学校2019-2020学年高二上学期期中考试化学试题云南省勐海县第三中学2019-2020学年高二上学期期末考试化学试题(已下线)2.3.1 浓度、压强变化对化学平衡的影响(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)第2课时 浓度、压强对化学平衡的影响第2课时 温度、浓度对化学平衡的影响(已下线)专题02 化学反应速率与化学平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(天津专用)天津北京师范大学静海附属学校2023-2024学年高二上学期第三次月考化学试题
名校
7 . 某兴趣小组将过量Cu与FeCl3溶液充分反应,静置后取上层清液于试管中,将KSCN溶液滴加到清液中,瞬间产生白色沉淀,局部出现红色,振荡试管,红色又迅速褪去。
已知:①CuCl2+Cu=2CuCl(白色)速率很慢
②2CuCl2+4KSCN=2CuSCN(白色)↓+(SCN)2+4KCl速率很快
③(SCN)2是拟卤素,化学性质和氯气相似。
下列说法正确的是
已知:①CuCl2+Cu=2CuCl(白色)速率很慢
②2CuCl2+4KSCN=2CuSCN(白色)↓+(SCN)2+4KCl速率很快
③(SCN)2是拟卤素,化学性质和氯气相似。
下列说法正确的是
| A.用KSCN溶液检验Fe3+时,Cu2+的存在会对检验产生干扰 |
| B.局部出现红色的主要原因是溶液中Fe2+被空气中O2氧化成Fe3+ |
| C.白色沉淀为CuCl,是溶液中CuCl2与反Cu应生成的 |
D.红色迅速褪去是因为Cu2+与SCN-发生反应②,使平衡Fe3++3SCN- Fe(SCN)3正向移动 Fe(SCN)3正向移动 |
您最近半年使用:0次
2022-10-18更新
|
134次组卷
|
2卷引用:宁夏固原市第一中学2023届高三上学期第二次月考化学试题
8 . 在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中发生反应:PCl3(g)+Cl2(g) PCl5(g)。5 min末达到平衡,有关数据如下表。下列判断正确的是
PCl5(g)。5 min末达到平衡,有关数据如下表。下列判断正确的是
 PCl5(g)。5 min末达到平衡,有关数据如下表。下列判断正确的是
PCl5(g)。5 min末达到平衡,有关数据如下表。下列判断正确的是| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/mol·L-1 | 2.0 | 1.0 | 0 |
| 平衡浓度/mol·L-1 | c1 | c2 | 0.4 |
| A.若升高温度,反应的平衡常数减小,则正反应吸热 |
| B.反应5 min内,v(PCl3)=0.04 mol·L-1·min-1 |
| C.当容器中Cl2为1.2mol时,可逆反应达到平衡状态 |
| D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)>0.2 mol/L |
您最近半年使用:0次
9 . 将CH4和CO2两种引发温室效应的气体转化为合成气(H2和CO),可以实现能量综合利用,对环境保护具有十分重要的意义。
(1)甲烷二氧化碳干式重整涉及以下反应
a.CH4(g)+CO2(g) 2CO(g)+2H2(g) ∆H1平衡常数K 1
2CO(g)+2H2(g) ∆H1平衡常数K 1
b.CO(g)+H2O(g) CO2(g)+H2(g) ∆H2平衡常数K 2
CO2(g)+H2(g) ∆H2平衡常数K 2
c.CH4(g)+2H2O(g) CO2(g)+ 4H2(g) ∆H3平衡常数K 3
CO2(g)+ 4H2(g) ∆H3平衡常数K 3
①∆H3=_______ (用∆H1、 ∆H2表示 )
②K3=_______ (用K1、 K2表示 )
③∆fHΘm为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。对于稳定相态单质,其∆fHΘm为零。根据下表所示数据,计算反应a的反应热∆H1=_______ ,该反应在_______ (填“高温”或“低温”)下能自发进行。
(2)甲烷的水蒸气重整涉及以下反应:
Ⅰ.CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
在一密闭容器中,通入1molCH4和3molH2O(g)发生甲烷的水蒸气重整反应。
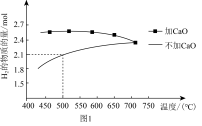
①压强为P0 kPa时,分别在加CaO和不加CaO时,平衡体系中H2的物质的量随温度变化如图1所示。温度低于700℃时,加入CaO可明显提高混合气中H2的物质的量,原因是_______ 。
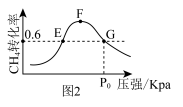
②500℃时,反应相同时间后测得CH4的转化率ɑ随压强的变化如图2所示。则图2中E点和G点CH4的浓度大小关系为c(G)_______ c(E)(填>”“<”或“=”),此温度下反应Ⅱ的分压平衡常数Kp(用分压代替浓度,分压等于总压×物质的量分数)为_______ 。
③甲烷蒸汽重整工业制氢面临着大量的“碳排放”,我国科技工作者发明了一种电化学分解甲烷的方法。其电化学反应原理如图3所示。请写出Ni-YSZ电极上发生的电极反应方程式:_______ 。

(1)甲烷二氧化碳干式重整涉及以下反应
a.CH4(g)+CO2(g)
 2CO(g)+2H2(g) ∆H1平衡常数K 1
2CO(g)+2H2(g) ∆H1平衡常数K 1b.CO(g)+H2O(g)
 CO2(g)+H2(g) ∆H2平衡常数K 2
CO2(g)+H2(g) ∆H2平衡常数K 2c.CH4(g)+2H2O(g)
 CO2(g)+ 4H2(g) ∆H3平衡常数K 3
CO2(g)+ 4H2(g) ∆H3平衡常数K 3①∆H3=
②K3=
③∆fHΘm为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。对于稳定相态单质,其∆fHΘm为零。根据下表所示数据,计算反应a的反应热∆H1=
| 物质 | CH4 | CO2 | CO |
| ∆fHΘm | -74.8 | -393.5 | -110.5 |
Ⅰ.CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)Ⅱ.CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)在一密闭容器中,通入1molCH4和3molH2O(g)发生甲烷的水蒸气重整反应。
①压强为P0 kPa时,分别在加CaO和不加CaO时,平衡体系中H2的物质的量随温度变化如图1所示。温度低于700℃时,加入CaO可明显提高混合气中H2的物质的量,原因是

②500℃时,反应相同时间后测得CH4的转化率ɑ随压强的变化如图2所示。则图2中E点和G点CH4的浓度大小关系为c(G)

③甲烷蒸汽重整工业制氢面临着大量的“碳排放”,我国科技工作者发明了一种电化学分解甲烷的方法。其电化学反应原理如图3所示。请写出Ni-YSZ电极上发生的电极反应方程式:

您最近半年使用:0次
10 . 从植物花汁中提取的一种有机物,可简化表示为HIn,在水溶液中因存在下列电离平衡,故可用作酸、碱指示剂:

在上述溶液中加入适量下列物质,最终能使指示剂显黄色的是

在上述溶液中加入适量下列物质,最终能使指示剂显黄色的是
| A.盐酸 | B.NaHCO3溶液 | C.NaHSO4溶液 | D.NaClO(固体) |
您最近半年使用:0次
2022-03-08更新
|
287次组卷
|
9卷引用:宁夏回族自治区银川一中2022-2023学年高二上学期期中考试化学试题
宁夏回族自治区银川一中2022-2023学年高二上学期期中考试化学试题(已下线)第30练 电离平衡-2023年高考化学一轮复习小题多维练(全国通用)福建省莆田第二中学2020-2021学年高二上学期期中考试化学试题(已下线)第三章 第一节 弱电解质的电离(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)专题3.2.2 酸碱中和滴定和pH的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)3.1.1 电离平衡-2021-2022学年高二化学课后培优练(人教版选修4)陕西省西安市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)3.1.2 电离平衡常数(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)河南省温县第一高级中学2021-2022学年高二上学期12月月考化学试题



