名校
1 . 已知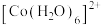 呈粉红色,
呈粉红色,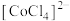 呈蓝色,
呈蓝色,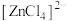 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: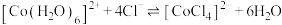 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
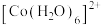 呈粉红色,
呈粉红色,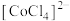 呈蓝色,
呈蓝色,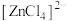 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: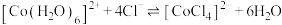 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
A.等物质的量的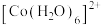 和 和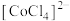 中 中 键数之比为 键数之比为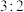 |
B.由实验1可推知 |
C.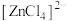 和 和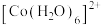 的配位数之比为 的配位数之比为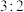 |
D.由实验③可知配离子的稳定性: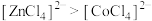 |
您最近半年使用:0次
名校
2 . 下述反应可制备特种陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) △H>0,该反应在某密闭容器中达到平衡时,下列分析正确的是
MgO(s)+CO2(g)+SO2(g) △H>0,该反应在某密闭容器中达到平衡时,下列分析正确的是
 MgO(s)+CO2(g)+SO2(g) △H>0,该反应在某密闭容器中达到平衡时,下列分析正确的是
MgO(s)+CO2(g)+SO2(g) △H>0,该反应在某密闭容器中达到平衡时,下列分析正确的是| A.恒温时,增大压强平衡逆向移动,平衡常数减小 |
| B.容积不变时,升高温度,混合气体的平均相对分子质量减小 |
| C.恒温恒容时,分离出部分CO2气体可提高MgSO4的转化率 |
D.恒温恒容时,冲入CO气体,达到新平衡时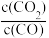 增大 增大 |
您最近半年使用:0次
名校
3 . 痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为:
 。下列说法
。下列说法
| A.饮食中摄入过多食盐,会加重痛风病病情 | B.大量饮水会增大痛风病发作的可能性 |
| C.寒冷季节更易诱发关节疼痛 | D.患痛风病的人应少吃能代谢产生更多尿酸的食物 |
您最近半年使用:0次
2024-02-21更新
|
132次组卷
|
41卷引用:北京市房山区2022-2023学年高二上学期期中质量检测化学试题
北京市房山区2022-2023学年高二上学期期中质量检测化学试题北京市第七中学2022-2023学年高二上学期期中化学试题北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题广东省信宜市第二中学2022-2023学年高二上学期11月月考化学试题广东省珠海市实验中学2022-2023学年高二上学期第一次段考化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二上学期11月期中检测化学试题北京市第一六六中学2022-2023学年高二上学期期中考试化学试卷河南省信阳市淮滨县2022-2023学年高二上学期11月期中考试化学试题北京市西城区2019-2020学年度高二上学期期末考试化学试题上海市奉贤区2020届高三5月教学质量调研(二模)化学试题湖北省黄冈市麻城市实验高中2020-2021学年高二上学期10月月考化学试题江西省赣州市南康中学2020-2021学年高二上学期第二次大考化学试题内蒙古阿荣旗第一中学2020-2021学年高二上学期期中考试化学试题山西省朔州市怀仁县大地学校2020-2021学年高二上学期第三次月考化学试题北京市第四十三中学2020-2021学年高二上学期12月月考化学试题辽宁省葫芦岛市2020-2021学年高二上学期期末考试化学试题北京市房山区2020-2021学年高二上学期期末考试化学试题河南省焦作市县级重点中学2021-2022学年高二上学期期中考试化学试题吉林省长白山第二高级中学校2021-2022学年高三上学期第二次月考化学试题北京市第四十四中学2021-2022学年高二上学期期中考试化学试题北京市顺义区杨镇第一中学2021-2022学年高二上学期期中考试化学试题 北京市顺义区2023届高三第一次统练化学试题广东省汕头市聿怀中学2022-2023学年高二上学期期末线上考试化学试题安徽省宣城市2022-2023学年高二上学期期末调研考试化学试题广东省河源市龙川县第一中学2022-2023学年高二上学期期末考试化学试题(已下线)专题15 化学反应速率和化学平衡新疆乌鲁木齐市第四中学2022-2023学年高二下学期期中阶段诊断测试化学试题(已下线)第05讲 影响化学平衡的因素-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)云南省玉溪师范学院附属中学2022-2023学年高二下学期期末考试化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题北京市清华大学附属中学2023-2024学年高二上学期期中考试化学试题北京市第六十六中学2023-2024学年高二上学期期中质量检测化学试题黑龙江省哈尔滨市第三十二中学校2023-2024学年高二上学期11月期中考试化学试题北京市大兴区兴华中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属中学2023-2024学年高二上学期期中考试化学试卷北京师范大学第二附属中学2023-2024学年高二上学期期中考试化学试题浙江省宁波三锋教研联盟2023-2024学年高二上学期期中联考化学试题甘肃省平凉市第二中学2022-2023学年高二上学期期末考试(延考)化学试题四川省内江市2025届第三中学高二上学期化学试卷北京市北京师范大学附属中学平谷第一分校2023-2024学年高二上学期期中考试化学试题北京市顺义区2022-2023学年高三上学期第一次统练化学试卷
名校
4 . 下列事实不能用勒夏特列原理解释的是
A.用饱和食盐水来除 中的 中的 | B.红棕色的 加压后颜色变深 加压后颜色变深 |
| C.开启啤酒瓶后,瓶中马上泛起大量泡沫 | D.增大压强,有利于 与 与 反应生成 反应生成 |
您最近半年使用:0次
2024-02-13更新
|
117次组卷
|
2卷引用:陕西省咸阳市实验中学2022-2023学年高三上学期第二次月考化学试题
名校
解题方法
5 . 某MOFs多孔材料孔径大小和形状恰好将N2O4“固定”,能高选择性吸附NO2。废气中的NO2被吸附后,经处理能全部转化为HNO3。原理示意图如下:
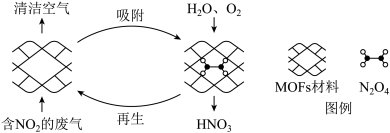
下列说法不正确的是

下列说法不正确的是
A.使用多孔材料不能改变 的焓变 的焓变 |
B.使用多孔材料能促进 平衡正向移动 平衡正向移动 |
C.加入 和 和 ,发生的反应方程式为 ,发生的反应方程式为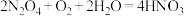 |
D.温度升高会提高 的平衡转化率 的平衡转化率 |
您最近半年使用:0次
名校
6 . 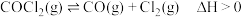 .当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加
.当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加 的浓度 ④减压 ⑤恒压通入惰性气体 ⑥加催化剂,能提高
的浓度 ④减压 ⑤恒压通入惰性气体 ⑥加催化剂,能提高 转化率的是
转化率的是
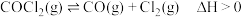 .当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加
.当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加 的浓度 ④减压 ⑤恒压通入惰性气体 ⑥加催化剂,能提高
的浓度 ④减压 ⑤恒压通入惰性气体 ⑥加催化剂,能提高 转化率的是
转化率的是| A.①②④ | B.③⑤⑥ | C.②③⑤ | D.①④⑤ |
您最近半年使用:0次
名校
7 . 氯化银的还原精炼技术是银回收精炼过程中的重要环节,有多种方法还原精炼。
(一)、甲小组选择强还原剂:肼(N2H4)。
在还原AgCl制取银的过程中有对环境无污染气体产生。
(1)①写出相关的化学反应方程式:___________ 。
【资料】工业上一般先向氯化银中加入氨水浆化,然后用N2H4还原,可有利于反应的进行。
②写出浆化过程中的离子反应式:___________ 。从N2H4发生的氧化反应(半反应)的角度分析加入氨水的作用___________ 。
(二)、乙小组换用铁粉还原AgCl制取银,探究其过程和影响因素。
【实验A】在试管中加入NaCl溶液,然后滴入AgNO3溶液,产生白色沉淀。滤出白色沉淀,继续实验如下:
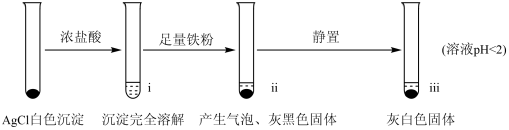
【资料】①AgCl+Cl- AgCl
AgCl
②Fe3++4Cl- FeCl
FeCl
(2)检验ⅱ中产物
①取ⅱ中上层清液,滴加K3[Fe(CN)6]溶液,___________ (填现象),说明溶液中含有Fe2+。
②取ⅱ中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入___________ (填试剂)溶解,再加入NaCl溶液生成白色沉淀,证明灰黑色固体中含有Ag。向另一份加入KI溶液,无明显现象。
(3)检验ⅲ中产物。
①取ⅲ中灰白色固体,洗涤。进行如下实验,确认灰白色固体中含AgCl:
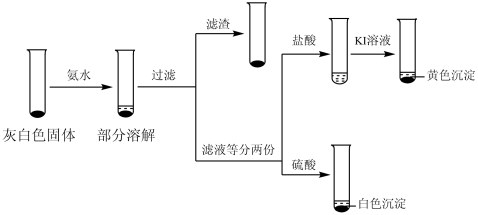
滤液加盐酸未产生沉淀,但加入硫酸后产生了白色沉淀,请结合离子方程式解释原因:___________ 。
②取iii中上层溶液,加几滴KSCN溶液。取样时间与溶液颜色如下表。
用离子方程式表示溶液变红的原因___________ ,Fe3++SCN- Fe(SCN)3。
Fe(SCN)3。
(4)小组同学认为不能排除O2直接氧化Ag继而生成AgCl,对此设计实验:___________ 。结果发现,该实验产生AgCl所需的时间更长。说明AgCl的产生主要与Fe3+有关。
(5)实验A中的i~iii中,i中AgCl溶解,iii中又生成AgCl的原因是:___________ 。
乙组实验反思:铁粉还原AgCl制取银时应控制铁粉、盐酸的浓度和浸泡时间等因素
(一)、甲小组选择强还原剂:肼(N2H4)。
在还原AgCl制取银的过程中有对环境无污染气体产生。
(1)①写出相关的化学反应方程式:
【资料】工业上一般先向氯化银中加入氨水浆化,然后用N2H4还原,可有利于反应的进行。
②写出浆化过程中的离子反应式:
(二)、乙小组换用铁粉还原AgCl制取银,探究其过程和影响因素。
【实验A】在试管中加入NaCl溶液,然后滴入AgNO3溶液,产生白色沉淀。滤出白色沉淀,继续实验如下:

【资料】①AgCl+Cl-
 AgCl
AgCl
②Fe3++4Cl-
 FeCl
FeCl
(2)检验ⅱ中产物
①取ⅱ中上层清液,滴加K3[Fe(CN)6]溶液,
②取ⅱ中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入
(3)检验ⅲ中产物。
①取ⅲ中灰白色固体,洗涤。进行如下实验,确认灰白色固体中含AgCl:

滤液加盐酸未产生沉淀,但加入硫酸后产生了白色沉淀,请结合离子方程式解释原因:
②取iii中上层溶液,加几滴KSCN溶液。取样时间与溶液颜色如下表。
| 取样时间 | 10分钟 | 12小时 | 24小时 |
| 溶液颜色 | 浅红色 | 红色 | 深红色 |
 Fe(SCN)3。
Fe(SCN)3。(4)小组同学认为不能排除O2直接氧化Ag继而生成AgCl,对此设计实验:
(5)实验A中的i~iii中,i中AgCl溶解,iii中又生成AgCl的原因是:
乙组实验反思:铁粉还原AgCl制取银时应控制铁粉、盐酸的浓度和浸泡时间等因素
您最近半年使用:0次
名校
解题方法
8 . 某化学小组通过测定溶液pH,计算K2Cr2O7溶液中“Cr2O (橙色)+H2O=2CrO
(橙色)+H2O=2CrO (黄色)+2H+”的平衡常数,结果如下:
(黄色)+2H+”的平衡常数,结果如下:
下列说法不合理的是
 (橙色)+H2O=2CrO
(橙色)+H2O=2CrO (黄色)+2H+”的平衡常数,结果如下:
(黄色)+2H+”的平衡常数,结果如下:| 实验序号 | 温度(°C) | K2Cr2O7溶液浓度(mol/L) | pH | 平衡常数 |
| ① | 26.3 | 0.1000 | a | 2.5×10-15 |
| ② | 26.3 | 0.3000 | 3.78 | b |
| ③ | 50.0 | 0.1000 | 3.75 | 1.01×10-14 |
| A.a大于3.78 |
| B.b等于2.5×10-15 |
| C.由实验①③结果可说明该反应为吸热反应 |
| D.向实验①2mL溶液中加入6滴6mol/LNaOH溶液,溶液橙色加深;恢复原温度,平衡常数不变 |
您最近半年使用:0次
名校
9 . 某实验小组同学依据资料深入探究Fe³+在水溶液中的行为。
资料:i.Fe³+在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;[Fe(H2O)6] 3+发生如下水解反应:[Fe(H2O)6]3+(几乎无色)+nH2O [Fe(H2O)6-n(OH)n]3−n(黄色)+nH3O+(n=0~6)。
[Fe(H2O)6-n(OH)n]3−n(黄色)+nH3O+(n=0~6)。
ii.[FeCl4(H2O)2]-为黄色。
进行实验:【实验I】

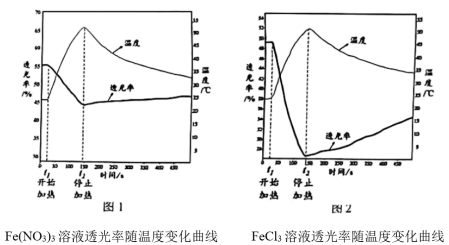
【实验Ⅱ】分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。
(1)实验1中,试管②溶液变为无色的原因是___________ 。
(2)实验I中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是___________ 。
(3)由实验Ⅱ图1、2可知:加热时,溶液颜色___________ (填“变浅"、“变深”或“不变”)。
(4)由实验Ⅱ,可以得出如下结论:
[结论一]FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]-+4H2O=[Fe(H2O)6]³++4Cl-得出此结论的理由是___________ 。
[结论二]结论一中反应的△H___________ (填“>0”或"<0")。
资料:i.Fe³+在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;[Fe(H2O)6] 3+发生如下水解反应:[Fe(H2O)6]3+(几乎无色)+nH2O
 [Fe(H2O)6-n(OH)n]3−n(黄色)+nH3O+(n=0~6)。
[Fe(H2O)6-n(OH)n]3−n(黄色)+nH3O+(n=0~6)。ii.[FeCl4(H2O)2]-为黄色。
进行实验:【实验I】

【实验Ⅱ】分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。

(1)实验1中,试管②溶液变为无色的原因是
(2)实验I中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是
(3)由实验Ⅱ图1、2可知:加热时,溶液颜色
(4)由实验Ⅱ,可以得出如下结论:
[结论一]FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]-+4H2O=[Fe(H2O)6]³++4Cl-得出此结论的理由是
[结论二]结论一中反应的△H
您最近半年使用:0次
名校
10 . 某同学研究浓度对化学平衡的影响,下列说法正确的是
已知: (aq) (橙色) +H2O(l)
(aq) (橙色) +H2O(l) 2
2 (aq) (黄色)+2H+(aq) △H=+13.8kJ/mol
(aq) (黄色)+2H+(aq) △H=+13.8kJ/mol
已知:
 (aq) (橙色) +H2O(l)
(aq) (橙色) +H2O(l) 2
2 (aq) (黄色)+2H+(aq) △H=+13.8kJ/mol
(aq) (黄色)+2H+(aq) △H=+13.8kJ/mol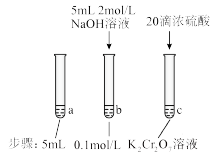 | 待试管b中颜色不变后与试管a比较,溶液颜色变浅。滴加浓硫酸,试管c温度略有升高,溶液颜色与试管a相比,变深。 |
| A.该反应为氧化还原反应 |
B.待试管b中溶液颜色不变的目的是使 完全反应 完全反应 |
| C.试管c中的现象说明影响平衡的主要因素是温度 |
| D.该实验不能证明减小生成物浓度平衡正向移动 |
您最近半年使用:0次



