1 . 下列事实不能用勒夏特列原理解释的是
| A.使用新型催化剂可使氮气与氢气在常温常压下合成氨气 |
| B.用排饱和食盐水的方法收集氯气 |
C. 溶液中加入固体KSCN后颜色变深 溶液中加入固体KSCN后颜色变深 |
| D.石灰石与稀盐酸在密闭瓶中反应结束后,打开瓶塞,溶液中有气泡产生 |
您最近半年使用:0次
名校
解题方法
2 . 对于任何一个化学反应平衡体系,采用以下措施,一定会使化学反应发生平衡移动的是
| A.加入一种反应物 | B.升高温度 |
| C.对平衡体系增加压强 | D.使用催化剂 |
您最近半年使用:0次
2022-11-12更新
|
101次组卷
|
77卷引用:新疆叶城县第八中学2021-2022学年高二上学期期末考试化学(理)试题
新疆叶城县第八中学2021-2022学年高二上学期期末考试化学(理)试题 新疆乌鲁木齐市第八十中学2022-2023学年高二上学期期中考试化学试题黑龙江省鸡西市第四中学2022-2023学年高二上学期第一次月考化学试题(已下线)2.2.1 化学平衡状态——同步学习必备知识云南省曲靖市富源县第一中学2021-2022学年高二下学期期中考试化学试题江西省赣州市十校协作2022-2023学年高二上学期期中联考化学试题安徽省宿州市十三所重点中学2022-2023学年高二上学期期中质量检测化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期第三次验收考试化学试题四川省广安市育才学校2022-2023学年高二上学期11月期中考试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期11月期中考试化学试题黑龙江省鹤岗市第一中学2022-2023学年高三上学期11月月考化学试题(已下线)09~10年大连23中高一下学期期末考试化学卷(已下线)2010-2011学年广西北海市合浦县教研室高二上学期期末考试化学试卷(已下线)2011-2012学年高二上学期单元测试期中考试化学试卷(已下线)2011-2012学年陕西省咸阳市渭城中学高二上学期期中考试化学试卷(已下线)2011-2012学年甘肃省张掖中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年吉林省扶余一中高二上学期期中考试化学试卷(已下线)2011-2012学年黑龙江省绥棱县第一中学高二上学期期末考试化学试卷(已下线)2011-2012学年广东省汕头市达濠中学高二上学期期末考试化学试卷(已下线)2011-2012学年浙江省嘉兴八校高二下学期期中联考化学试卷(已下线)2011-2012学年浙江湖州菱湖中学高二下学期期中考试化学试卷(已下线)2012-2013学年广东省汕头市达濠中学高二上学期期末理科化学试卷(已下线)2012-2013学年湖北省武汉市重点中学高二上学期期中考试化学试卷(已下线)2014年化学高考总复习课时演练 7-2化学平衡状态化学平衡移动练习卷(已下线)2013-2014学年江苏省淮安市高中协作体高二下学期期中考试化学试卷(已下线)2014届海南省海南中学高二下学期期中考试化学(理)试卷(已下线)2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(已下线)2014秋季甘肃省白银市一中高二第一学期期中理科化学试卷2014-2015学年重庆复旦中学高二上学期期中化学试卷2014-2015学年广东省东莞市三校高二上学期期中联考化学试卷2015-2016学年宁夏育才中学高二上学期期中测试化学试卷2015-2016学年海南省文昌中学高二上期中(理)化学试卷2015-2016学年辽宁师大附中高一下学期6月月考化学试卷2016-2017学年宁夏育才中学高二上第一次月考化学卷2016-2017学年陕西西藏民族学院附中高二上月考二化学卷2016-2017学年江苏省泰州中学高二上月考一化学试卷2017届宁夏银川二中高三上学期统练二化学试卷2017届广东省清远市清城区高三上期末B卷化学试卷2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷天津市第一中学2017-2018学年高二上学期期末考试化学试题湖南省邵东县第十中学2018-2019学年高二上学期期中考试理科班化学试题2019年10月22日《每日一题》2019-2020学年高二化学人教选修4——化学平衡移动的判断浙江省诸暨中学2019-2020学年高二上学期10月阶段性考试化学试题福建省永安市第三中学2019-2020学年高二10月月考化学试题甘肃省白银市会宁县第四中学2019-2020学年高二上学期期中考试化学试题安徽省蚌埠市第二中学2019-2020学年高二上学期期中考试化学试题浙江省东阳中学2019-2020学年高二上学期期中考试化学试题陕西省西安电子科技大学附属中学2019-2020学年高二上学期期中考试化学(理)试题湖南省永州市双牌县第二中学2019-2020学年高二上学期期中考试化学试题(选考)安徽省淮北市第一中学2019-2020学年高二12月月考化学试题陕西省渭南三贤中学2019-2020学年高二上学期期中考试化学试题吉林省普通高中联合体2018-2019学年高二下学期期末联考化学试题【懂做原理题】2020届高三化学选修4二轮专题练——化学平衡移动及其影响因素【精编25题】贵州省毕节市民族中学2019-2020学年高二上学期第二次月考化学试题福建省三明市2019-2020学年高二下学期期末考试化学试题(已下线)第02章 化学反应速率和化学平衡(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第2节 化学反应的限度(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)2.3.2影响化学平衡状态的因素(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)河南省安阳市第一中学2020-2021学年高二上学期第一次阶段考试化学试题山西省新绛县第二中学2019-2020学年高二上学期第一次考试化学试题天津市第八中学2020-2021学年高二上学期第三次统练化学试题安徽省蚌埠田家炳中学2020-2021学年高二12月月考化学试题江苏省泰州中学2020-2021学年高二上学期第一次月度质量检测化学试题浙江省杭州市西湖高级中学2020-2021学年高二上学期期末考试化学试题陕西省眉县槐芽中学2020-2021学年高二上学期期中考试化学试题四川省成都市蒲江县蒲江中学2020-2021学年高二3月月考化学试题云南省丽江市第一中学2020-2021学年高二下学期期中考试化学试题吉林省长春市第二十九中学2021-2022学年高二上学期第一学程考试化学试题广东省深圳市福田区外国语高级中学2021-2022学年高二上学期期中考试化学试题陕西省宝鸡市金台区2021-2022学年高二上学期期中考试化学(理)试题福建省南平市浦城县2021-2022学年高二上学期期中考试化学试题云南昆明师范专科学校附属中学2021-2022学年高二上学期期中考试化学试题宁夏吴忠市吴忠中学2021-2022学年高二上学期月考化学试题云南省蒙自市第一高级中学2022-2023学年高二下学期3月月考化学试题浙江省金华市东阳市外国语学校2023-2024学年高二上学期10月月考化学试题上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题
名校
3 . Ⅰ.已知: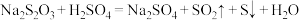 ,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
(1)Na2S2O3中S的化合价为 _______ 价
(2)该实验①、②可探究温度对反应速率的影响,因此
_______ ,V3=_______
(3)若实验①、③探究硫酸浓度对反应速率的影响,V4=_______ ,V5=_______ 。
Ⅱ.在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
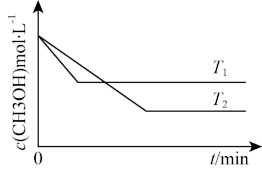
(4)△H_______ (填“>”“<”或“=”)0
(5)在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率_______ (填“增大”“减小”或“不变”)。
(6)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g) CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为_______ mol/(L·min)。
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡_______ (填“向左移动”、“向右移动”或“不移动”)。
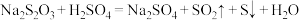 ,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:| 实验序号 | 反应温度/ |  溶液 溶液 | 稀 |  | ||
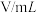 | 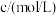 |  | 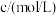 |  | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 |  | 0.10 |  | 0.50 |  |
| ③ | 20 |  | 0.10 | 4.0 | 0.50 | 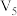 |
(2)该实验①、②可探究温度对反应速率的影响,因此
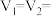
(3)若实验①、③探究硫酸浓度对反应速率的影响,V4=
Ⅱ.在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:

(4)△H
(5)在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率
(6)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)
 CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡
您最近半年使用:0次
名校
4 . 按要求填空
(1)某反应A(g)+B(g)= C(g)+D(g)过程中的能量变化如图所示,回答问题。
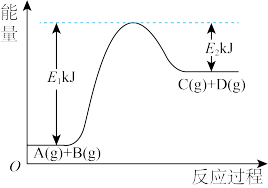
该反应是_______ (填“吸热”或“放热”)反应,该反应过程中,断裂旧化学键吸收的总能量_______ (填“>”“ <”或“=”)形成新化学键释放的总能量。
(2)由金红石(TiO2)制取单质Ti的步骤为:

已知:Ⅰ.

Ⅱ.
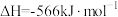
Ⅲ.
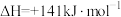
①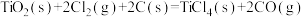 的
的
_______ kJ/mol。
②若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则Q1_______ Q2(填“>”、“<”或“=”)。
(3)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g) 2NO2(g) ΔH<0体系中,各成分浓度随时间的变化如图所示。
2NO2(g) ΔH<0体系中,各成分浓度随时间的变化如图所示。
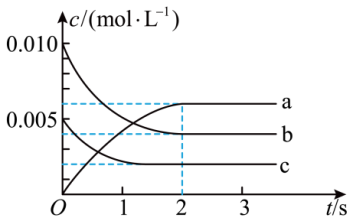
①用O2表示0~2 s内该反应的平均速率v =_______ mol/(L·s)。
②能使该反应的反应速率增大,且平衡向正反应方向移动的是_______ 。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
③达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是_______ 。
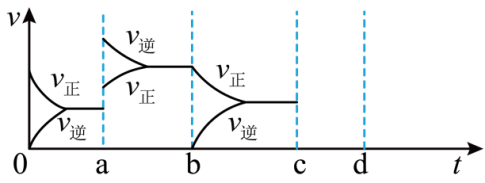
A.升温 B.增大压强 C.加入生成物 D.加入催化剂
(4)已知:①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
现有0.2 mol木炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93 kJ的热量,则混合物中C与H2的物质的量之比为
A.1∶2 B.1∶1 C.2∶3 D.3∶2
(1)某反应A(g)+B(g)= C(g)+D(g)过程中的能量变化如图所示,回答问题。

该反应是
(2)由金红石(TiO2)制取单质Ti的步骤为:

已知:Ⅰ.


Ⅱ.

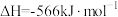
Ⅲ.

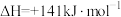
①
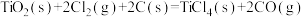 的
的
②若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则Q1
(3)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)
 2NO2(g) ΔH<0体系中,各成分浓度随时间的变化如图所示。
2NO2(g) ΔH<0体系中,各成分浓度随时间的变化如图所示。
①用O2表示0~2 s内该反应的平均速率v =
②能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
③达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是

A.升温 B.增大压强 C.加入生成物 D.加入催化剂
(4)已知:①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
现有0.2 mol木炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93 kJ的热量,则混合物中C与H2的物质的量之比为
A.1∶2 B.1∶1 C.2∶3 D.3∶2
您最近半年使用:0次
名校
5 . 以下化学平衡原理的应用正确的是
A.密闭容器中发生反应H2(g) + I2(g)  2HI(g),平衡后增大压强气体颜色变深 2HI(g),平衡后增大压强气体颜色变深 |
B.CO 中毒是因为 CO 吸入肺中发生反应:CO+HbO2(氧合血红蛋白)  O2+HbCO(碳氧血红蛋白),治疗的做法是把病人放入高压氧仓 O2+HbCO(碳氧血红蛋白),治疗的做法是把病人放入高压氧仓 |
C.关节滑液由于形成尿酸钠晶体:Ur-+Na+ NaUr(尿酸钠)ΔH<0 而引发关节炎,治疗的做法是采用冷敷 NaUr(尿酸钠)ΔH<0 而引发关节炎,治疗的做法是采用冷敷 |
D.合成氨反应N2 (g)+ 3H2(g)  2NH3(g) ΔH=-92.4kJ/mol。工业上采用高温条件更有利于合成氨 2NH3(g) ΔH=-92.4kJ/mol。工业上采用高温条件更有利于合成氨 |
您最近半年使用:0次
名校
6 . 根据下列反应原理设计的应用,不正确的是
A.CO +H2O +H2O HCO HCO +OH-用热的纯碱溶液清洗油污效果更佳 +OH-用热的纯碱溶液清洗油污效果更佳 |
B.Al3++3H2O Al(OH)3(胶体)+3H+明矾净水 Al(OH)3(胶体)+3H+明矾净水 |
C.Cl2+H2O HCl+HClO新制氯水中加入碳酸钙,提高次氯酸浓度 HCl+HClO新制氯水中加入碳酸钙,提高次氯酸浓度 |
D.Fe3++3H2O Fe(OH)3+3H+配制Fe2(SO4)3溶液时,加入一定量Fe粉 Fe(OH)3+3H+配制Fe2(SO4)3溶液时,加入一定量Fe粉 |
您最近半年使用:0次
2022-10-26更新
|
330次组卷
|
4卷引用:新疆乌鲁木齐市第七十中学2022-2023学年高二上学期期中考试化学试题
新疆乌鲁木齐市第七十中学2022-2023学年高二上学期期中考试化学试题重庆市巴蜀中学校2022-2023学年高二上学期第一次月考化学试题河南省洛阳六校2022-2023学年高二上学期第一次月考化学试题(已下线)实验05 盐类水解的应用-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
名校
7 . 一定温度下,某气态平衡体系的平衡常数表达式为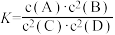 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是
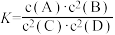 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是A.该反应的化学方程式为 |
| B.增大A浓度,平衡向正反应方向移动 |
| C.增大压强,C体积分数增加 |
| D.升高温度,若B的百分含量减少,则正反应是放热反应 |
您最近半年使用:0次
名校
8 . 下列说法不正确的是
| A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 |
| B.2014年西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
| C.金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火 |
| D.在4mL0.1mol∙L-1的K2Cr2O7溶液中滴加数滴1mol/L的NaOH溶液,溶液颜色从橙色变成黄色 |
您最近半年使用:0次
解题方法
9 . 500℃时向恒容密闭容器中充入1molNO2(g)发生如下反应:2NO2(g) N2O4(g),反应达到平衡后,向容器内再充入1molNO2,下列说法正确的是
N2O4(g),反应达到平衡后,向容器内再充入1molNO2,下列说法正确的是
 N2O4(g),反应达到平衡后,向容器内再充入1molNO2,下列说法正确的是
N2O4(g),反应达到平衡后,向容器内再充入1molNO2,下列说法正确的是| A.气体颜色最终比原平衡时还要浅 |
| B.平衡常数K增大 |
| C.平衡向正反应方向移动 |
| D.若恒容密闭体系中通入氦气,平衡正向移动 |
您最近半年使用:0次
2022-10-13更新
|
479次组卷
|
3卷引用:新疆昌吉州行知学校2022-2023学年高二上学期第一次线上月考化学试题
解题方法
10 . 下列关于工业合成氨的叙述错误的是
| A.在动力、设备,材料允许的情况下,反应尽可能在高压下进行 |
| B.温度越高越有利于工业合成氨 |
| C.在工业合成氨中,N2、H2的循环利用可降低成本 |
| D.及时从反应体系中分离出氨气有利于平衡向正反应方向移动 |
您最近半年使用:0次
2022-10-09更新
|
505次组卷
|
4卷引用:新疆乌鲁木齐市第八十中学2022-2023学年高二上学期期中考试化学试题
新疆乌鲁木齐市第八十中学2022-2023学年高二上学期期中考试化学试题(已下线)第二章 化学反应速率与化学平衡(A卷·知识通关练)【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)云南省保山市高(完)中C、D类学校2022-2023学年高二上学期10月份联考化学试题云南省文山州广南县第十中学校2023-2024学年高二上学期10月月考化学试题



