名校
解题方法
1 . NH3发生催化氧化反应生成NO,实验室也可以使用铜和稀硝酸制备少量NO。NH3在强碱条件下能被NaClO氧化生成N2H4;N2H4可被NaClO继续氧化生成N2,也可被HNO2氧化生成HN3,N2H4能与AgNO3溶液反应产生银镜;HN3是一种弱酸,酸性与醋酸相当。CO可将机动车尾气中的NO转化为N2,反应为: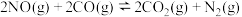 ,ΔH=-746.5kJ·mol-1下列说法正确的是
,ΔH=-746.5kJ·mol-1下列说法正确的是
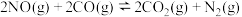 ,ΔH=-746.5kJ·mol-1下列说法正确的是
,ΔH=-746.5kJ·mol-1下列说法正确的是| A.该反应在任何条件下都能自发进行 |
B.反应的平衡常数可表示为 |
| C.使用高效的催化剂可以降低反应的焓变 |
D.其它条件不变,增大 的值,NO的转化率下降 的值,NO的转化率下降 |
您最近半年使用:0次
2023-09-24更新
|
191次组卷
|
2卷引用:江苏省扬州中学2022-2023学年高三上学期11月月考化学试题
名校
2 . 某小组设计实验研究单一组分浓度对化学平衡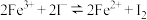 的影响。
的影响。
【实验过程】
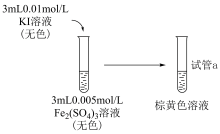
(1)待试管a中溶液的颜色不变后再进行后续实验,其目的是___________ 。
(2)实验I:研究增大反应物 浓度对平衡的影响,实验方案如下:
浓度对平衡的影响,实验方案如下:
取少量试管a中棕黄色溶液于试管中,加入1~2滴饱和 溶液,溶液颜色加深,原因是:
溶液,溶液颜色加深,原因是:___________ 。
(3)实验II:研究增大生成物 浓度对平衡的影响,实验方案如下图所示:
浓度对平衡的影响,实验方案如下图所示:

①请在图中将方案补充完整___________ 。
②能够证明增大生成物 浓度导致平衡移动的实验现象为
浓度导致平衡移动的实验现象为___________ 。
【实验反思】
(4)实验I、II从不同的角度佐证了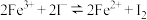 是一个可逆反应。
是一个可逆反应。
角度1:证明反应物不能完全被消耗,存在限度。相应的实验为___________ 。(填“I”或“II”)
角度2:___________ 。
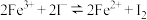 的影响。
的影响。【实验过程】

(1)待试管a中溶液的颜色不变后再进行后续实验,其目的是
(2)实验I:研究增大反应物
 浓度对平衡的影响,实验方案如下:
浓度对平衡的影响,实验方案如下:取少量试管a中棕黄色溶液于试管中,加入1~2滴饱和
 溶液,溶液颜色加深,原因是:
溶液,溶液颜色加深,原因是:(3)实验II:研究增大生成物
 浓度对平衡的影响,实验方案如下图所示:
浓度对平衡的影响,实验方案如下图所示:
①请在图中将方案补充完整
②能够证明增大生成物
 浓度导致平衡移动的实验现象为
浓度导致平衡移动的实验现象为【实验反思】
(4)实验I、II从不同的角度佐证了
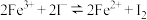 是一个可逆反应。
是一个可逆反应。角度1:证明反应物不能完全被消耗,存在限度。相应的实验为
角度2:
您最近半年使用:0次
2023-09-23更新
|
110次组卷
|
2卷引用:北京市八一学校2022-2023学年高二上学期期中考试化学试题
名校
3 . 硫酸工业中的核心反应: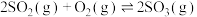
 ,如果要提高
,如果要提高 的平衡转化率,下列措施不可行的是
的平衡转化率,下列措施不可行的是
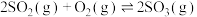
 ,如果要提高
,如果要提高 的平衡转化率,下列措施不可行的是
的平衡转化率,下列措施不可行的是A.增大 的浓度 的浓度 | B.增大压强 |
| C.升高温度 | D.及时将 从反应体系中移走 从反应体系中移走 |
您最近半年使用:0次
2023-09-23更新
|
130次组卷
|
2卷引用:北京市八一学校2022-2023学年高二上学期期中考试化学试题
名校
解题方法
4 . 请根据有关知识,填写下列空白:
(1)一种难溶的废弃矿渣杂卤石,其主要成分可表示为K2SO4·MgSO4·2CaSO4·2H2O,已知它在水溶液中存在如下平衡:K2SO4·MgSO4·2CaSO4·2H2O(s) 2K+(aq)+4
2K+(aq)+4 (aq)+Mg2+(aq)+2Ca2+(aq)+2H2O(l)。
(aq)+Mg2+(aq)+2Ca2+(aq)+2H2O(l)。
用化学平衡移动原理解释Ca(OH)2溶液能溶解出杂卤石中K+的原因:_____ 。
(2)向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L−1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.8×10−10,忽略溶液的体积变化,请计算:完全沉淀后,溶液中c(Ag+)=_____ mol·L−1.
(3)N2H4是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。
写出N2H4(g)完全燃烧生成氮气和气态水热化学方程式_____ 。
(4)硫酸亚铁溶液常压蒸干得到的固体物质是_____ ,原因是_____ 。
(5)NH4Cl溶液可作焊接时的除锈剂,原因是_____ 。
(1)一种难溶的废弃矿渣杂卤石,其主要成分可表示为K2SO4·MgSO4·2CaSO4·2H2O,已知它在水溶液中存在如下平衡:K2SO4·MgSO4·2CaSO4·2H2O(s)
 2K+(aq)+4
2K+(aq)+4 (aq)+Mg2+(aq)+2Ca2+(aq)+2H2O(l)。
(aq)+Mg2+(aq)+2Ca2+(aq)+2H2O(l)。用化学平衡移动原理解释Ca(OH)2溶液能溶解出杂卤石中K+的原因:
(2)向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L−1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.8×10−10,忽略溶液的体积变化,请计算:完全沉淀后,溶液中c(Ag+)=
(3)N2H4是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。
写出N2H4(g)完全燃烧生成氮气和气态水热化学方程式
(4)硫酸亚铁溶液常压蒸干得到的固体物质是
(5)NH4Cl溶液可作焊接时的除锈剂,原因是
您最近半年使用:0次
5 . 氧化镍(NiO)在冶金、化学及电子工业等领域中有广泛应用,某兴趣小组由工业废渣(主要成分:Fe、Ni,其它杂质不与酸反应)制备氧化镍的流程如下:

已知:
请回答:
(1)下列说法正确的是_______。
(2)滤液3经过一系列操作可得到氧化镍粗品,包含以下步骤:
a.将滤液放入烧杯中用煤气灯进行加热
b.将滤出的沉淀物进行烘干
c.用pH试纸测定溶液至不呈碱性
d.经马釜炉 焙烧
焙烧
e.过滤
①请给出合理的操作排序(从上述操作中选取,按先后次序列出字母)_______ 。为提高氧化镍产率,向滤液3中加入稍过量的碳酸铵固体→e→→→e→→→氧化镍粗品
②步骤a中对滤液进行加热的原因是_______ 。
(3)氧化镍产品的纯度可用配位滴定法测定。取1.500g氧化镍粗品,酸溶后配成250mL溶液,取25.00mL溶液于锥形瓶中,滴入几滴紫脲酸胺指示剂,用浓度为 的
的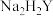 标准液滴定,平均消耗
标准液滴定,平均消耗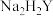 标准液
标准液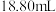 。
。
已知:Ⅰ.
Ⅱ.紫脲酸胺:紫色试剂,遇 显橙黄色。
显橙黄色。
①粗品中氧化镍的纯度是_______ 。(保留四位有效数字)
②下列操作会使测定结果偏低的是_______ 。
A.锥形瓶中溶液颜色由橙黄色局部变为紫色后立即停止滴定
B.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡
C.滴定前平视读数,滴定后俯视读数
D.振荡锥形瓶时,锥形瓶内溶液溅出

已知:

请回答:
(1)下列说法正确的是_______。
| A.通过冲击破碎的方式预处理工业废渣可加快其在酸溶时的反应速率 |
B.滤液1中的主要金属阳离子为 、 、 和 和 |
| C.操作Ⅱ与操作Ⅲ均为过滤,仅需用到的玻璃仪器:普通漏斗、烧杯 |
D.滤渣2中加入过量氨水发生的反应为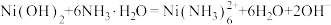 |
a.将滤液放入烧杯中用煤气灯进行加热
b.将滤出的沉淀物进行烘干
c.用pH试纸测定溶液至不呈碱性
d.经马釜炉
 焙烧
焙烧e.过滤
①请给出合理的操作排序(从上述操作中选取,按先后次序列出字母)
②步骤a中对滤液进行加热的原因是
(3)氧化镍产品的纯度可用配位滴定法测定。取1.500g氧化镍粗品,酸溶后配成250mL溶液,取25.00mL溶液于锥形瓶中,滴入几滴紫脲酸胺指示剂,用浓度为
 的
的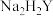 标准液滴定,平均消耗
标准液滴定,平均消耗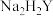 标准液
标准液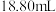 。
。已知:Ⅰ.

Ⅱ.紫脲酸胺:紫色试剂,遇
 显橙黄色。
显橙黄色。①粗品中氧化镍的纯度是
②下列操作会使测定结果偏低的是
A.锥形瓶中溶液颜色由橙黄色局部变为紫色后立即停止滴定
B.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡
C.滴定前平视读数,滴定后俯视读数
D.振荡锥形瓶时,锥形瓶内溶液溅出
您最近半年使用:0次
名校
6 . 下列不能用勒夏特列原理解释的事实是
| A.红棕色的NO2加压后颜色先变深后变浅 |
| B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 |
| C.实验室常用饱和食盐水的方法收集氯气 |
| D.合成氨工业使用高压以提高氨的产量 |
您最近半年使用:0次
2023-09-16更新
|
175次组卷
|
2卷引用:吉林省长春市新解放学校2022-2023学年高二上学期11月月考化学试题
名校
7 . Ⅰ.为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
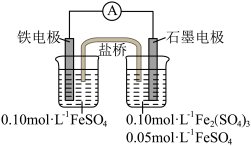
回答下列问题:
(1)实验室用FeSO4•7H2O固体和蒸馏水配制FeSO4溶液时,还需要加入少量铁粉和________ (写名称)。
(2)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增大,石墨电极上未见Fe析出。则石墨电极的电极反应式为________ ,因此,验证了Fe2+氧化性小于________ (写化学符号,下同)
Ⅱ.工业废水中常含有一定量有毒的Cr2O ,必须进行处理。常用的处理方法有两种。
,必须进行处理。常用的处理方法有两种。
方法一:还原沉淀法
该法的工艺流程为:CrO Cr2O
Cr2O
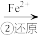 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
(3)第①步存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O。若平衡体系的pH=2,则溶液显
(橙色)+H2O。若平衡体系的pH=2,则溶液显________ 色。
(4)写出第②步的离子反应方程式:________ 。
方法二:电解法
该法用Fe做电极电解含Cr2O 的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为________ 。

回答下列问题:
(1)实验室用FeSO4•7H2O固体和蒸馏水配制FeSO4溶液时,还需要加入少量铁粉和
(2)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增大,石墨电极上未见Fe析出。则石墨电极的电极反应式为
Ⅱ.工业废水中常含有一定量有毒的Cr2O
 ,必须进行处理。常用的处理方法有两种。
,必须进行处理。常用的处理方法有两种。方法一:还原沉淀法
该法的工艺流程为:CrO
 Cr2O
Cr2O
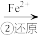 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓(3)第①步存在平衡:2CrO
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O。若平衡体系的pH=2,则溶液显
(橙色)+H2O。若平衡体系的pH=2,则溶液显(4)写出第②步的离子反应方程式:
方法二:电解法
该法用Fe做电极电解含Cr2O
 的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。(5)用Fe做电极的原因为
您最近半年使用:0次
名校
8 . 在硫酸工业中,通过下列反应使SO2氧化为SO3:2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是___________ 。
(2)在实际生产中,选定的温度为400℃~500℃,原因是___________
(3)在实际生产中,采用的压强为常压,原因是___________
(4)在实际生产中,通入过量的空气,原因是___________
(5)尾气中的SO2必须回收,原因是___________ 。
(6)在550℃、1MPa下,若SO2的起始浓度为2mol/L,O2的起始浓度为1mol/L,试求该条件下的平衡常数K=___________ 。
 2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 95.0 | 97.7 | 98.3 |
(2)在实际生产中,选定的温度为400℃~500℃,原因是
(3)在实际生产中,采用的压强为常压,原因是
(4)在实际生产中,通入过量的空气,原因是
(5)尾气中的SO2必须回收,原因是
(6)在550℃、1MPa下,若SO2的起始浓度为2mol/L,O2的起始浓度为1mol/L,试求该条件下的平衡常数K=
您最近半年使用:0次
9 . 从下列实验事实所得出的现象解释或结论错误的是
| 选项 | 实验事实 | 现象解释或结论 |
| A | 将0.1mol/L5mL的Na2S2O3溶液和0.1mol/L5mL的H2SO4溶液混合后平均分装在2支试管中,一支放入冷水中,另一支放入热水中 | 放置在热水的试管中的溶液先出现浑浊,说明升高温度,化学反应速率会加快 |
| B | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| C | 压缩针筒内的NO2和N2O4混合气体,颜色先变深后变浅 | 颜色先变深是浓度变大的原因,后变浅是压强变化对化学平衡的影响 |
| D | 向2mL0.1mol/L的FeCl3溶液中加入1滴KSCN溶液变为红色后,再加入少量KCl固体 | 溶液红色变浅,说明增大生成物浓度会使平衡逆向移动 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-09-10更新
|
360次组卷
|
4卷引用:安徽省芜湖市无为襄安中学2022-2023学年高二上学期11月期中考试化学试题
名校
10 . 下列事实不能用勒夏特列原理解释的是
| A.打开可乐饮料后会产生大量气泡 |
| B.用排饱和食盐水法收集氯气 |
| C.由H2、碘蒸气、HI组成的平衡体系加压后颜色变深 |
| D.向K2Cr2O7溶液中滴加NaOH溶液后溶液颜色变为黄色 |
您最近半年使用:0次
2023-09-10更新
|
257次组卷
|
2卷引用:安徽省芜湖市无为襄安中学2022-2023学年高二上学期11月期中考试化学试题



