名校
解题方法
1 . 电化学原理在生产生活中运用广泛,下面是常见的一些运用。
I.汽车尾气中氮氧化合物、碳氧化合物的处理会污染环境,运用电化学方法可以进行NO的消除和CO含量检测。
(1)间接电解法除NO。其原理如图所示,从A口中出来的气体是_______ ,电解池阴极的电极反应式_______ 。用离子方程式表示吸收柱中除去NO的原理_______ 。

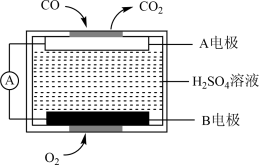
(2)用电化学气敏传感器测定汽车尾气中CO含量,原理如图所示,B电极是该电池的_______ (填“正极”或“负极”),A电极上的电极反应式为_______ 。
II.运用电解Na2CO3溶液制备小苏打和烧碱,原理如下图所示。
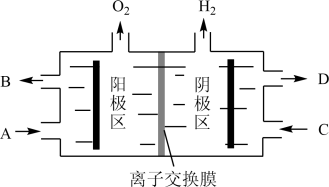
(3)B处排出的溶液主要溶质为_______ 。电解槽中的离子交换膜为_______ (填“阴”或“阳”)离子交换膜,当阳极区收集到1.12L气体(标准状况下),阴极区质量变化_______ g。
III.电解法可用于提纯金属。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应),某小组在实验室条件下以CuSO4溶液为电解液,用电解的方法实现粗铜精炼,并对阳极泥进行回收。
步骤一:电解精炼铜
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
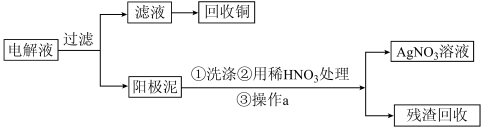
(4)步骤一结束后,电解过程中,CuSO4的浓度会_______ (填“增大”或“不变”或“减小”)
(5)残渣含有少量的黄金,为了回收金,查阅了相关资料(见下表)
从资料中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸按体积比1:3的混合物)。请从化学平衡的角度解释金能溶于王水的原因_______ 。
I.汽车尾气中氮氧化合物、碳氧化合物的处理会污染环境,运用电化学方法可以进行NO的消除和CO含量检测。
(1)间接电解法除NO。其原理如图所示,从A口中出来的气体是

(2)用电化学气敏传感器测定汽车尾气中CO含量,原理如图所示,B电极是该电池的

II.运用电解Na2CO3溶液制备小苏打和烧碱,原理如下图所示。

(3)B处排出的溶液主要溶质为
III.电解法可用于提纯金属。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应),某小组在实验室条件下以CuSO4溶液为电解液,用电解的方法实现粗铜精炼,并对阳极泥进行回收。
步骤一:电解精炼铜
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(4)步骤一结束后,电解过程中,CuSO4的浓度会
(5)残渣含有少量的黄金,为了回收金,查阅了相关资料(见下表)
| 反应原理 | 化学平衡常数 | |
| 反应1 | Au+6HNO3(浓)⇌Au(NO3)3+3NO2↑+3H2O | <<1 |
| 反应2 | Au3++4Cl-=AuCl | >>1 |
从资料中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸按体积比1:3的混合物)。请从化学平衡的角度解释金能溶于王水的原因
您最近一年使用:0次
2 . CO2催化加氢制甲醇,有利于减少CO2温室气体,其合成总反应可表示为:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH<0 。回答下列问题:
CH3OH(g)+H2O(g) ΔH<0 。回答下列问题:
(1)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol·L−1和3a mol·L−1,反应平衡时,CO2的转化率为1/3,则该温度下反应平衡常数的值为_______ 。
(2)恒压下,CO2和H2的起始物质的量比为1∶3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如下图所示,其中分子筛膜能选择性分离出H2O。
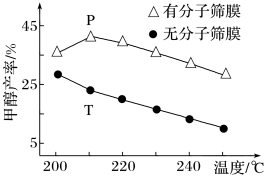
①甲醇平衡产率随温度升高而降低的原因为_______ 。
②P点甲醇产率高于T点的原因为_______ 。
(3)合成总反应在起始物n(H2)/n(CO2)=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH)。在t=250℃下的x(CH3OH)~p、在p=5×105pa下的x(CH3OH)~t如图所示。
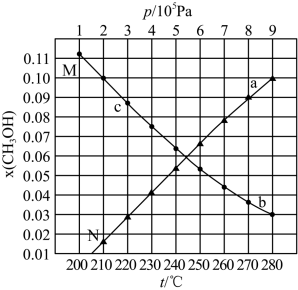
①图中对应等温过程的曲线是_______ (填“M”或“N”)。
②图中a、b、c三点对应的平衡常数分别为Ka、Kb、Kc,则Ka、Kb、Kc的数值由大到小的顺序为_______ 。
 CH3OH(g)+H2O(g) ΔH<0 。回答下列问题:
CH3OH(g)+H2O(g) ΔH<0 。回答下列问题:(1)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol·L−1和3a mol·L−1,反应平衡时,CO2的转化率为1/3,则该温度下反应平衡常数的值为
(2)恒压下,CO2和H2的起始物质的量比为1∶3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如下图所示,其中分子筛膜能选择性分离出H2O。

①甲醇平衡产率随温度升高而降低的原因为
②P点甲醇产率高于T点的原因为
(3)合成总反应在起始物n(H2)/n(CO2)=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH)。在t=250℃下的x(CH3OH)~p、在p=5×105pa下的x(CH3OH)~t如图所示。

①图中对应等温过程的曲线是
②图中a、b、c三点对应的平衡常数分别为Ka、Kb、Kc,则Ka、Kb、Kc的数值由大到小的顺序为
您最近一年使用:0次
名校
3 . 人体血液中存在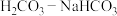 缓冲体系,建立下列平衡
缓冲体系,建立下列平衡 ,通过平衡的移动起到稳定血液pH的作用。下列说法不合理的是
,通过平衡的移动起到稳定血液pH的作用。下列说法不合理的是
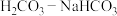 缓冲体系,建立下列平衡
缓冲体系,建立下列平衡 ,通过平衡的移动起到稳定血液pH的作用。下列说法不合理的是
,通过平衡的移动起到稳定血液pH的作用。下列说法不合理的是| A.人体代谢的碱性物质进入血液后,上述平衡向右移动,以维持血液pH的相对稳定 |
B.若人体内的 不能顺利排出体外,会造成血液pH的减小 不能顺利排出体外,会造成血液pH的减小 |
| C.若静脉滴注大量生理盐水,则体液的pH减小 |
| D.如果体内酸度或碱度过量,超过了人体缓冲体系的缓冲能力,就会造成酸中毒或碱中毒 |
您最近一年使用:0次
2022-01-16更新
|
211次组卷
|
3卷引用:福建省宁德市2021-2022学年高二上学期期末质量检测化学试题1
名校
4 . 联系生产生活实际,下列说法,不能根据平衡移动原理解释的是
| A.供热公司为了节能减排,将煤块粉碎燃烧 |
| B.可乐瓶开启后,马上泛起大量气泡,并可能将可乐冲出瓶口 |
| C.氯气在饱和食盐水中的溶解度比在水中小 |
| D.将一氧化碳中毒者放入高压氧舱,增大氧气浓度,缓解病情 |
您最近一年使用:0次
2021-12-02更新
|
148次组卷
|
2卷引用:福建省福州外国语学校2021-2022学年高二上学期期中考试化学试题
名校
5 . 铬是不锈钢中一种重要的元素,铬的毒性与其存在的价态有关,低价铬对人体基本无害,六价铬比三价铬毒性高100倍,并易被人体吸收且在体内蓄积,有关含铬化合物的相互转化关系如图甲。
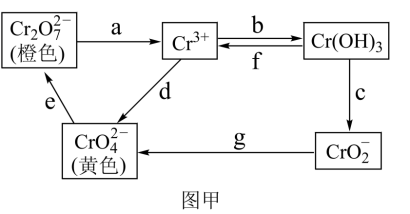
回答下列问题:
(1)从图甲中信息判断,Cr(OH)3是___________ 氢氧化物(填“酸性”、“碱性”或“两性”),相关反应的离子方程式为___________ 。
(2)图甲中所示转化过程中需要加入氧化剂的是___________ (填写表示转化过程的小写字母)。
(3)在水溶液中橙色的 与黄色的
与黄色的 有下列平衡关系:
有下列平衡关系: +H2O
+H2O 2
2 +2H+。向K2Cr2O7稀溶液中加入NaOH溶液后,溶液颜色的变化是
+2H+。向K2Cr2O7稀溶液中加入NaOH溶液后,溶液颜色的变化是___________ 。
(4)CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率( )随温度的变化如图乙所示。
)随温度的变化如图乙所示。
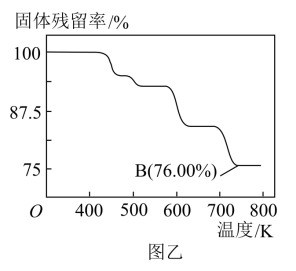
①三氧化铬在稀硫酸环境中氧化乙醇,CrO3变为绿色的Cr2(SO4)3,乙醇被完全氧化为CO2,则其化学方程式是___________ 。
②图乙中B点所示固体的化学式是___________ 。

回答下列问题:
(1)从图甲中信息判断,Cr(OH)3是
(2)图甲中所示转化过程中需要加入氧化剂的是
(3)在水溶液中橙色的
 与黄色的
与黄色的 有下列平衡关系:
有下列平衡关系: +H2O
+H2O 2
2 +2H+。向K2Cr2O7稀溶液中加入NaOH溶液后,溶液颜色的变化是
+2H+。向K2Cr2O7稀溶液中加入NaOH溶液后,溶液颜色的变化是(4)CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率(
 )随温度的变化如图乙所示。
)随温度的变化如图乙所示。
①三氧化铬在稀硫酸环境中氧化乙醇,CrO3变为绿色的Cr2(SO4)3,乙醇被完全氧化为CO2,则其化学方程式是
②图乙中B点所示固体的化学式是
您最近一年使用:0次
名校
6 . 关于下列各图的叙述,正确的是
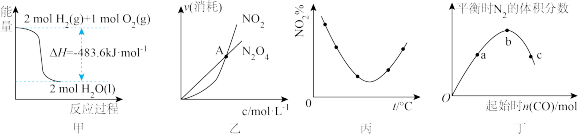
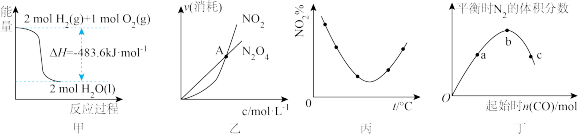
| A.甲表示H2与O2发生反应过程中的能量变化,则H2的摩尔燃烧焓为483.6 kJ·mol-1 |
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
C.丙表示等量NO2在恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g)相同时间后测得NO2体积分数的曲线。则该反应的正反应ΔH<0 N2O4(g)相同时间后测得NO2体积分数的曲线。则该反应的正反应ΔH<0 |
D.丁表示反应4CO(g)+2NO2(g) N2(g)+4CO2(g) △H<0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c N2(g)+4CO2(g) △H<0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c |
您最近一年使用:0次
7 . N2(g)+3H2(g)⇌2NH3(g),∆H=-akJ·mol-1反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应活化能的数值,E2表示无催化剂时逆反应活化能的数值)。下列说法错误的是


| A.合成氨工业生产中适当增大氮气浓度可提高氢气的转化率 |
| B.a=E2-E1 |
| C.恒温恒压条件下通入氦气,反应速率减小 |
| D.催化剂通过改变反应的活化能和反应物分子的能量来改变化学反应速率 |
您最近一年使用:0次
名校
解题方法
8 . 在两个容积均为1L的密闭容器中以不同的氢碳比 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如图所示。下列说法中正确的是
C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如图所示。下列说法中正确的是
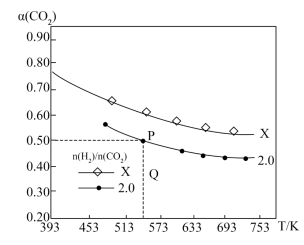
 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如图所示。下列说法中正确的是
C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如图所示。下列说法中正确的是
| A.改进催化剂后,上述曲线将发生变化 |
| B.氢碳比:X<2.0 |
| C.在氢碳比为2.0时,Q点v(正)小于v(逆) |
| D.P点时,容器中,CO2与H2的物质的量之比为1:1 |
您最近一年使用:0次
名校
9 . 下列事实中,不能用勒夏特列原理解释的是
| A.打开汽水瓶盖时,溶液中有气泡产生 |
| B.实验室可用排饱和食盐水法收集氯气 |
| C.合成氨工业中常采用高压条件 |
| D.H2(g)、I2(g)、HI(g)平衡混合气加压颜色变深 |
您最近一年使用:0次
2021-11-13更新
|
73次组卷
|
2卷引用:福建省龙岩第一中学2021-2022学年高二上学期期中考试化学试题
名校
10 . 在恒容密闭容器中充入一定量的CO2和H2,在不同温度下发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H <0。 CH3OH 的体积分数与起始时H2与CO2的投料比值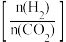 的关系如图甲所示,投料比值 一定时,CH3OH的浓度与温度的关系如图乙所示。
的关系如图甲所示,投料比值 一定时,CH3OH的浓度与温度的关系如图乙所示。
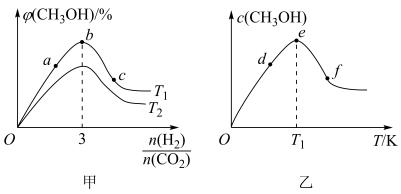
下列推断正确的是
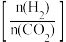 的关系如图甲所示,投料比值 一定时,CH3OH的浓度与温度的关系如图乙所示。
的关系如图甲所示,投料比值 一定时,CH3OH的浓度与温度的关系如图乙所示。
下列推断正确的是
| A.图甲中,T1>T2 |
| B.图甲中,CO2的转化率: b>a>c |
| C.图乙中,T1之前随着温度的升高,平衡正向移动 |
| D.图乙中,CO2的转化率: e>d>f |
您最近一年使用:0次
2021-11-12更新
|
178次组卷
|
2卷引用:福建省南安市侨光中学、昌财实验中学2021-2022学年高二上学期第二次阶段考化学试题



