名校
解题方法
1 . 在一容积可变的密闭容器中加入一定量的X、Y,发生反应mX(g)⇌nY(g) ∆H=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如表所示:
下列说法正确 的是
| 温度(℃) | c(Y)/(mol/L) | ||
| 1L | 2L | 4L | |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0.90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
| A.m>n |
| B.Q<0 |
| C.体积不变,温度升高,平衡向逆反应方向移动 |
| D.温度不变,压强增大,Y的质量分数减少 |
您最近半年使用:0次
2024-01-18更新
|
30次组卷
|
22卷引用:吉林省白城市第一中学2018-2019学年高一下学期期末考试化学试题
吉林省白城市第一中学2018-2019学年高一下学期期末考试化学试题吉林省延边朝鲜族自治州汪清县第四中学2020-2021学年高二上学期期末考试化学试题(已下线)2011-2012学年江西省上高二中高二上学期第三次月考化学试卷(已下线)2011-2012学年湖南省望城县第一中学高二上学期期末质量检测化学试卷(已下线)2012-2013学年河北省邢台一中高一下学期第三次月考化学试卷(已下线)2013-2014学年黑龙江省哈师大附中高二上学期期中化学试卷(已下线)2013-2014学年安徽省屯溪一中高二上学期期中考试化学试卷(已下线)2014年高二化学人教版选修四 8化学平衡移动练习卷(已下线)2015届黑龙江省双鸭山市第一中学高三9月月考化学试卷(已下线)2014-2015湖南省新化一中高二上学期期中化学试卷2014-2015学年内蒙古包头市第一中学高一下学期期末考试化学试卷2015-2016浙江宁波效实中学高二上期中考试化学试题卷2015-2016学年云南省昆明三中高二下期中化学试卷2016-2017学年四川省成都开发区实验中学高二10月月考化学卷辽宁省大连市第二十四中学2017-2018学年高二上学期期中考试化学试题黑龙江省孙吴县第一中学2017-2018学年高二上学期期中考试化学试题步步为赢 高二化学暑假作业:作业九 化学反应速率和化学平衡福建省三明市三地三校2020-2021学年高二上学期期中联考化学试题黑龙江省鹤岗市第一中学2021-2022学年高二上学期期中考试化学试题湖南师范大学附属中学2021-2022学年高一下学期期末考试化学试题湖南省常德市第一中学2023-2024学年高二上学期12月月考化学试题海南省琼海市嘉积中学2023-2024学年高二上学期期末考试化学试题A卷
名校
解题方法
2 . 在一密闭容器中,反应 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是| A.平衡向逆反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增大了 | D. |
您最近半年使用:0次
2023-11-14更新
|
352次组卷
|
25卷引用:吉林省长春希望高中2021-2022学年高二上学期期末考试化学试题
吉林省长春希望高中2021-2022学年高二上学期期末考试化学试题黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期阶段考试(12月)化学试题(已下线)【浙江新东方】双师118安徽省淮北市树人高级中学2020-2021学年高二上学期第一次联考化学试题天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题广西百色中学2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期中阶段性检测化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期末考试化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题天津市第二南开学校2022-2023学年高二上学期9月阶段性线上练习化学试题 天津市宁河区芦台第一中学2022-2023学年高二上学期第一次学习诊断化学试题浙江省金华第一中学2022-2023学年高一下学期6月期末化学试题宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题山西省太原市第五中学校2023-2024学年高二上学期10月月考化学试题浙江省浙东北联盟(ZDB)2023-2024学年高二上学期期中考试化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题 北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业03 化学平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题河北省石家庄市第十五中学2023-2024学年高二上学期12月阶段考试化学试题安徽省阜阳市临泉第一中学(高铁分校)2023-2024学年高二上学期期末考试化学试题广东省汕头市潮阳区河溪中学2023-2024学年高二上学期月考化学试题
名校
3 . 现有反应:mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_______ 热反应,且m+n ______ p (填“>”、“<”或“=”)。
(2)减压时,A 的质量分数_______ (填“增大”、“减小”或“不变”,下同)。
(3)若加入 B(体积不变),则A的转化率__________ 。
(4)若升高温度,则平衡时B、C的浓度之比[B]/[C]将_______ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量_______ 。
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:(1)该反应的逆反应为
(2)减压时,A 的质量分数
(3)若加入 B(体积不变),则A的转化率
(4)若升高温度,则平衡时B、C的浓度之比[B]/[C]将
(5)若加入催化剂,平衡时气体混合物的总物质的量
您最近半年使用:0次
2023-02-07更新
|
240次组卷
|
7卷引用:吉林省吉化第一高级中学校2019-2020学年高二9月月考化学试题
4 . 开发CO2催化加氢合成甲醇技术是有效利用CO2资源,实现“碳达峰、碳中和”目标的重要途径。某温度下,在恒容密闭容器中发生反应: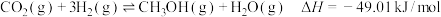 。下列有关说法正确的是
。下列有关说法正确的是
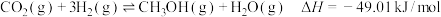 。下列有关说法正确的是
。下列有关说法正确的是| A.升高温度有利于提高H2(g)的平衡转化率 |
| B.增大体系的压强,单位体积内活化分子百分数增大 |
| C.提高CO2与H2的进料比,一定可以提高产物CH3OH的百分含量 |
| D.加入合适的催化剂,能提高单位时间内CH3OH的产量 |
您最近半年使用:0次
2023-10-14更新
|
294次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2023-2024学年高二上学期第二次月考化学试题
5 . 回答下列问题:
Ⅰ.一定条件下,在容积为 的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
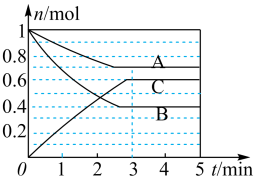
(1)达到平衡后加压,C的含量_______ (填写“变大”“变小”或“不变”)。
(2)该反应的反应速率v随时间t的关系如图所示。
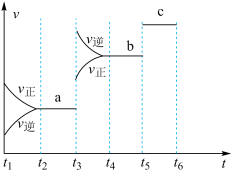
①根据图判断,在 时刻改变的外界条件是
时刻改变的外界条件是_______ 。
②a、b、c对应的平衡状态中,A的转化率最大的是状态_______ 。
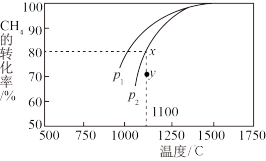
Ⅱ.在密闭容器中充入一定量的 ,发生反应
,发生反应
 。如图所示为
。如图所示为 气体分解生成
气体分解生成 和
和 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。

(3)该反应的逆反应是_______ (填“吸热反应”或“放热反应”)。
(4)N点 的体积分数是
的体积分数是_______ 。
(5)M点对应的平衡常数
_______  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅰ.一定条件下,在容积为
 的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
的密闭容器中, A、B、C三种气体的物质的量n随时间t的变化如图所示。已知达到平衡后,降低温度,A的体积分数减小。
(1)达到平衡后加压,C的含量
(2)该反应的反应速率v随时间t的关系如图所示。

①根据图判断,在
 时刻改变的外界条件是
时刻改变的外界条件是②a、b、c对应的平衡状态中,A的转化率最大的是状态
Ⅱ.在密闭容器中充入一定量的
 ,发生反应
,发生反应
 。如图所示为
。如图所示为 气体分解生成
气体分解生成 和
和 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。
(3)该反应的逆反应是
(4)N点
 的体积分数是
的体积分数是(5)M点对应的平衡常数

 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
您最近半年使用:0次
名校
解题方法
6 . 现有反应:mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变小;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_______ 热反应,(填“吸”或“放”)且m+n_______ p(填“>”“=”“<”)。
(2)减压时,A的质量分数_______ 。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_______ ,B的转化率_______ 。
(4)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______ ;而维持容器内压强不变,充入氖气时,混合物颜色_______ (填“变深”“变浅”或“不变”)。
(1)该反应的逆反应为
(2)减压时,A的质量分数
(3)若加入B(体积不变),则A的转化率
(4)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色
您最近半年使用:0次
2021-06-23更新
|
278次组卷
|
3卷引用:吉林省长春市希望高中2021-2022学年高二上学期期中考试化学试题
吉林省长春市希望高中2021-2022学年高二上学期期中考试化学试题江西省赣州市信丰中学2020-2021学年高二上学期入学考试化学试题(已下线)第二章 第三节化学平衡(第2课时 化学平衡的影响因素)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(原卷版)
名校
7 . 甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、 和
和 )在催化剂作用下可合成甲醇,发生的主要反应如下:
)在催化剂作用下可合成甲醇,发生的主要反应如下:
I.
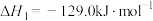
II.

III.

回答下列问题:
(1)
_______ 。
(2)将2.0mol 和3.0mol
和3.0mol  通入容积为3L的恒容密闭容器中,在一定条件下发生反应II,测得
通入容积为3L的恒容密闭容器中,在一定条件下发生反应II,测得 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
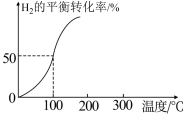
①100℃时反应达到平衡所需的时间为5min,则反应从起始至5min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为_______ 。
②100℃时,反应II的平衡常数K=_______ 。
③下列可用来判断该反应已达到平衡状态的有_______ (填标号)。
A.CO的含量保持不变 B.容器中
C.容器中混合气体的密度保持不变 D.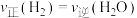
(3)利用天然气制取合成气的原理 ,在密闭容器中通入物质的量浓度均为1
,在密闭容器中通入物质的量浓度均为1 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
_______  (填“大于”或“小于”);压强为
(填“大于”或“小于”);压强为 时,在Y点:
时,在Y点:
_______ 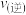 (填“大于”“小于”或“等于”)。为了提高该反应中
(填“大于”“小于”或“等于”)。为了提高该反应中 的转化率,除温度、压强外还可以采取的措施是
的转化率,除温度、压强外还可以采取的措施是_______ 。
 和
和 )在催化剂作用下可合成甲醇,发生的主要反应如下:
)在催化剂作用下可合成甲醇,发生的主要反应如下:I.

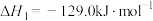
II.


III.


回答下列问题:
(1)

(2)将2.0mol
 和3.0mol
和3.0mol  通入容积为3L的恒容密闭容器中,在一定条件下发生反应II,测得
通入容积为3L的恒容密闭容器中,在一定条件下发生反应II,测得 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
①100℃时反应达到平衡所需的时间为5min,则反应从起始至5min内,用
 表示该反应的平均反应速率为
表示该反应的平均反应速率为②100℃时,反应II的平衡常数K=
③下列可用来判断该反应已达到平衡状态的有
A.CO的含量保持不变 B.容器中

C.容器中混合气体的密度保持不变 D.
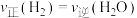
(3)利用天然气制取合成气的原理
 ,在密闭容器中通入物质的量浓度均为1
,在密闭容器中通入物质的量浓度均为1 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
 (填“大于”或“小于”);压强为
(填“大于”或“小于”);压强为 时,在Y点:
时,在Y点:
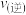 (填“大于”“小于”或“等于”)。为了提高该反应中
(填“大于”“小于”或“等于”)。为了提高该反应中 的转化率,除温度、压强外还可以采取的措施是
的转化率,除温度、压强外还可以采取的措施是
您最近半年使用:0次
2022-11-19更新
|
118次组卷
|
2卷引用:吉林省长春市第二实验中学2022-2023学年高二上学期期中考试化学试题
名校
8 . 恒温恒压下向密闭容器中充入4mol 和2mol
和2mol ,反应如下:
,反应如下: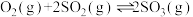 △H<0.2min反应达到平衡,生成1.4mol
△H<0.2min反应达到平衡,生成1.4mol ,同时放出热量QkJ。则下列分析正确的是
,同时放出热量QkJ。则下列分析正确的是
 和2mol
和2mol ,反应如下:
,反应如下: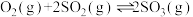 △H<0.2min反应达到平衡,生成1.4mol
△H<0.2min反应达到平衡,生成1.4mol ,同时放出热量QkJ。则下列分析正确的是
,同时放出热量QkJ。则下列分析正确的是A.若反应开始时容器体积为2L,则 |
B.2min后向容器中再通入一定量的 气体,重新达到平衡时, 气体,重新达到平衡时, 的含量增大 的含量增大 |
C.若把条件“恒温恒压”改为“绝热恒压”,则平衡后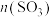 大于1.4mol 大于1.4mol |
| D.若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于QkJ |
您最近半年使用:0次
2022-11-11更新
|
212次组卷
|
3卷引用:吉林省BEST合作体八校2023-2024学年高二上学期1月期末化学试题
9 . 某温度下,密闭容器中发生反应aX(g) bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y的浓度是原来的1.8倍。则下列叙述中正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y的浓度是原来的1.8倍。则下列叙述中正确的是
 bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y的浓度是原来的1.8倍。则下列叙述中正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y的浓度是原来的1.8倍。则下列叙述中正确的是| A.可逆反应的化学方程式的化学计量数:a>b+c |
| B.压缩容器的容积时,v(正)增大,v(逆)减小 |
| C.达到新平衡时,物质X的转化率减小 |
| D.达到新平衡时,混合物中Z的质量分数增大 |
您最近半年使用:0次
2021-01-20更新
|
113次组卷
|
27卷引用:吉林省实验中学2017-2018学年高二上学期期中考试化学试题
吉林省实验中学2017-2018学年高二上学期期中考试化学试题吉林省白城市第一中学2018-2019学年高一6月月考化学试题(已下线)2011-2012学年陕西宝鸡金台区高二上学期期中质量检测化学试卷(已下线)2013-2014学年云南省玉溪一中高二上学期期中考试化学试卷2016届山东省泰安市高三上学期期末考试化学试卷(已下线)同步君 人教版 选修4 第2章 第3节 化学平衡状态河北省张家口市第一中学2016-2017学年高一(衔接班)6月月考(理)化学试题高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第三节 化学平衡 化学平衡第二课时(化学平衡状态)甘肃省兰州市第一中学2019-2020学年高二9月月考化学试题甘肃省靖远县第四中学2019-2020学年高二10月月考化学试题云南省玉溪市华宁县第二中学2019-2020学年高二上学期期末考试化学试题云南省昭通市永善县明志高级中学2019—2020学年高二上学期期末考试化学试题黑龙江省哈尔滨市第六中学2020-2021学年高二上学期期中考试化学试题河北省邯郸市大名一中、磁县一中,邯山区一中,永年一中等六校2020-2021学年高二上学期期中考试化学试题 甘肃省庆阳市镇原县第二中学2020-2021学年高二上学期期末考试化学试题(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记黑龙江省哈尔滨第九中学校2020-2021学年高二上学期期中考试化学试题宁夏青铜峡市高级中学2021-2022学年高二上学期第一次月考化学试题黑龙江省鹤岗市第一中学2021-2022学年高二上学期第一次月考化学试题云南省玉溪第一中学2021-2022学年高二上学期期中考试化学试题黑龙江省牡丹江市第三中学2021-2022学年高二上学期期中考试化学(理)试题云南省大理市下关第一中学2022-2023学年高二上学期段考(二)化学(A卷)试题新疆和田地区和田县2022-2023学年高二上学期11月期中化学试题黑龙江省双鸭山市第一中学2023-2024学年高二上学期10月月考化学试题广东省佛山市顺德区郑裕彤中学2023-2024学年上学期高一10月月考化学试题广东省 江门市棠下中学2023-2024学年高二上学期期中考试化学试题2023-2024学年广东省江门市棠下中学、广东实验江门学校高二(上)期中化学试卷
名校
10 . 一定条件下的密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1,下列叙述正确的是
4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1,下列叙述正确的是
 4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1,下列叙述正确的是
4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1,下列叙述正确的是| A.4molNH3和5molO2反应,达到平衡时放出的热量为905.9kJ |
B.平衡时,v正(O2)=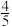 v逆(NO) v逆(NO) |
| C.平衡后降低压强(增大体积),混合气体的平均摩尔质量增大 |
| D.平衡后升高温度,混合气体中NO的含量降低 |
您最近半年使用:0次
2022-09-21更新
|
556次组卷
|
46卷引用:吉林省辽源市第五中学2016-2017学年高二下学期期末考试化学试题
吉林省辽源市第五中学2016-2017学年高二下学期期末考试化学试题(已下线)2011-2012学年云南省玉溪一中高二下学期期中考试化学试卷(已下线)2014年高中化学人教版选修四第二章 化学反应速率与化学平衡练习卷2015届辽宁省锦州市高三质量检测(二)理综化学试卷2014-2015学年河北省正定中学高一下学期期中化学试卷2016-2017学年新疆兵团第二师华山中学高二下学期学前考试化学试卷内蒙古杭锦后旗奋斗中学2017-2018学年高二下学期第一次月考化学试题【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期10月月考化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二上学期10月月考化学试题安徽省合肥市第九中学2018-2019学年高二上学期期中考试化学试题【校级联考】湖北省孝感市七校教学联盟2018-2019学年高二上学期期中联合考试化学试题广东省揭阳市惠来县第一中学2018-2019学年高二上学期期中考试化学试题山西省晋中市平遥县第二中学2018-2019学年高二上学期12月月考化学试题河北省承德第一中学2019-2020学年高二上学期开学考试化学试题海南省东方市八所中学2019-2020学年高二上学期第一次月考化学试题(已下线)【新东方】高中化学164四川省蓬溪县蓬南中学2019-2020学年高二上学期第四次月考化学试题广东省深圳市新安中学2019-2020学年高二上学期期中考试化学试题湖北省黄冈市浠水县实验高级中学2019-2020学年高二上学期期中复习检测化学试题广东省第二师范学院番禺附属中学2019-2020学年高二下学期期中段考化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节综合训练高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 第二节综合训练黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高二10月月考化学试题重庆市合川实验中学2020-2021学年高二上学期期中考试化学试题山西省太原市2020-2021学年高二上学期期中质量监测化学(理)试题山东省济宁市泗水县2020-2021学年高二上学期期中考试化学试题河北省沧州市黄骅中学2020-2021学年高二上学期第三次月考化学试题(已下线)练习6 化学平衡(一)-2020-2021学年【补习教材·寒假作业】高二化学(人教版)江苏省泰州中学2020-2021学年高二上学期期中考试化学试题福建省莆田第七中学2020-2021学年高二上学期期末考试化学试题河南省宏力学校2020-2021学年高二上学期期末考试化学试题选择性必修1 专题2 第三单元综合训练(已下线)专题七 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)湖北省孝感市2021-2022学年高二上学期期中联考化学试题河南省实验中学2021-2022学年高二上学期期中考试化学试题黑龙江省牡丹江市第三中学2021-2022学年高二上学期第一次月考化学(理)试题黑龙江省七台河市勃利县高级中学2021-2022学年高二上学期9月月考化学试题内蒙古通辽市开鲁县第一中学2021-2022学年高一下学期6月检测化学试题河南省三门峡市渑池县第二高级中学2021-2022学年高二上学期第二次月考化学试题湖北省华中师范大学潜江附属中学2021-2022学年高二上学期10月月考化学试题内蒙古赤峰市第四中学分校2021-2022学年高二上学期9月月考化学试题四川省广安代市中学校2021-2022学年高二上学期9月考化学试题2.3.1浓度 压强变化对化学平衡的影响 课后山东省鄄城县第一中学2022-2023学年高一下学期5月月考化学试题(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)(已下线)BBWYhjhx1104.pdf



