名校
1 . 1molCO2与足量的碳在恒容密闭容器中反应:C(s)+CO2(g)⇌2CO(g)。测得平衡时,体系中气体体积分数与温度的关系如图所示:
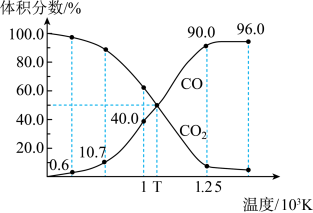
| A.1×103K时,若充入惰性气体,v正、v逆均减小,v逆变化幅度更大 |
| B.1×103K时,突然升温,v正、v逆均增大,v正变化幅度更大 |
| C.1×103K时,反应达平衡后CO2的转化率为25.0% |
| D.T×103K时,若再充入等体积的CO2和CO,平衡向逆反应方向移动 |
您最近半年使用:0次
2 . 一个质量可不计的活塞将一定量的理想气体封闭在上端开口的直立圆筒形气缸内,活塞上堆放着铁砂,如图所示,气体柱的高度为H0,压强等于大气压强p0(状态一),此时活塞被下方的卡扣挡住,无法继续下落。后续操作中活塞可自由移动,现对气体缓慢加热,当气体温度升高了△T=60 K时,活塞开始上升(状态二),继续加热直到气柱高度为H=1.5H0(状态三)。 此后,维持温度不变,取走铁砂,气柱高度变为H2=1.8H0(状态四),求此时气体的温度(不计活塞与气缸之间的摩擦)
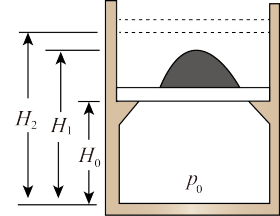

| A.480K | B.420 K | C.540 K | D.600 K |
您最近半年使用:0次
2023-05-25更新
|
198次组卷
|
2卷引用:2023年广西高中学生竞赛(高一、高二同卷)化学试题
3 . 在一定条件下,某密闭容器中发生反应:A(g)+B(g) 2C(g) ΔH<0,其他条件相同时,在甲、乙两种催化剂(催化剂活性不受压强影响)的作用下,反应相同时间,A的转化率与温度的关系如图所示。
2C(g) ΔH<0,其他条件相同时,在甲、乙两种催化剂(催化剂活性不受压强影响)的作用下,反应相同时间,A的转化率与温度的关系如图所示。

下列说法正确的是
 2C(g) ΔH<0,其他条件相同时,在甲、乙两种催化剂(催化剂活性不受压强影响)的作用下,反应相同时间,A的转化率与温度的关系如图所示。
2C(g) ΔH<0,其他条件相同时,在甲、乙两种催化剂(催化剂活性不受压强影响)的作用下,反应相同时间,A的转化率与温度的关系如图所示。
下列说法正确的是
| A.其它条件相同,压缩容器体积,M点A的转化率一定增大 |
| B.其它条件相同,压缩容器体积,甲曲线整体向左移动 |
| C.乙中约200°C后,A的转化率下降的可能原因是温度升高,平衡逆向移动 |
| D.其它条件相同,该反应用甲作催化剂的平衡转化率比用乙高 |
您最近半年使用:0次
名校
4 . 在某温度下,反应:N2(g)+3H2(g)⇌2NH3(g)(正反应为放热反应)在密闭容器中达到平衡,下列说法中正确的是
| A.温度不变,缩小体积,N2的转化率增大 |
| B.温度不变,增大体积,NH3的产率提高 |
| C.升高温度,增大体积,有利于平衡向正反应方向移动 |
| D.降低温度,体积不变,H2的转化率降低 |
您最近半年使用:0次
2021-09-24更新
|
547次组卷
|
5卷引用:浙江省磐安县第二中学2021-2022学年高二10月份竞赛化学试题
5 . 1molA气体和nmolB气体在密闭容器中发生如下反应:A(g)+nB(g)⇌mC(g)。反应进行一段时间后,测得A的转化率为50%。同温同压下,还测得反应前混合气体的密度是反应后混合气体密度的3/4。则n和m的数值可能是
| A.n=4,m=4 | B.n=3,m=3 | C.n=2,m=2 | D.n=1,m=1 |
您最近半年使用:0次
名校
6 . 已知反应:N2(g)+3H2(g)⇌2NH3(g) △H<0。某温度下,N2的平衡转化率(α)与体系总压强(P)的关系如图甲所示。将lmolN2与3molH2置于10L的密闭容器中,反应达到平衡后,下列说法正确的是
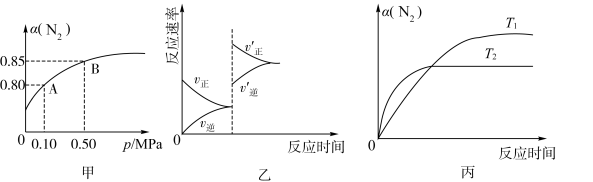

| A.由图甲知,A点N2的平衡浓度为0.2mol·L-1 |
| B.由图甲知,B点N2、H2、NH3的平衡浓度之比为1∶3∶2 |
| C.达到平衡后,缩小容器体积,则反应速率变化图象可以用图乙表示 |
| D.压强为0.5MPa时,在不同温度下N2的转化率与温度的关系如图丙,则T1<T2 |
您最近半年使用:0次
2021-08-16更新
|
337次组卷
|
2卷引用:第29届(2015年)全国高中化学奥林匹克竞赛山东省预赛试题
7 . 如图,I是恒压密闭容器,II是恒容密闭容器。其它条件相同时,在I、II中分n别加入2molX和2molY,起始时容器体积均为VL,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)⇌aZ(g)。此时I中X、Y、Z的物质的量之比为1∶3∶2,则下列说法一定正确的是
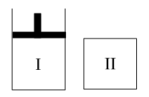

| A.若X、Y均为气态,则平衡时气体平均摩尔质量:II>I, |
| B.若X、Y不均为气态,则平衡时气体平均摩尔质量:I>II |
| C.若X为固态,Y为气态,则I、II中从起始到平衡所需时间相同 |
| D.平衡时I容器的体积小于VL |
您最近半年使用:0次
解题方法
8 . 乙烯在石油化工基础原料生产中占据主导地位,常以乙烯产量作为衡量一个国家或地区石油化工发展水平的重要标志之 一。作为我国第一经济大省, 广东省近几年来的乙烯产量一直居全国区域之首。工业上常用乙烷裂解制取乙烯:C2H6(g) C2H4(g) + H2(g)。请回答下列问题:
C2H4(g) + H2(g)。请回答下列问题:
(1)下表为一些化学键的键能数据,请计算上述反应的焓变△H__________ 。
(2)将1.00 mol乙烷充入容积为1.00 L的恒容密闭容器,一定温度下发生反应,平衡时测得乙烷的物质的量为0.20 mol。求该温度下反应的平衡常数及乙烷的平衡转化率________ ;__________ 。
(3)实际生产中,常在恒温恒压下采用加入水蒸气的方法来提高乙烯的产率(水蒸气在此条件下不参与反应),请用平衡移动的原理加以说明_________ 。
 C2H4(g) + H2(g)。请回答下列问题:
C2H4(g) + H2(g)。请回答下列问题:(1)下表为一些化学键的键能数据,请计算上述反应的焓变△H
化学键 | H-H | C-H | C-C | C=C |
键能E/ (kJ·mol-1) | 435.3 | 414.4 | 345.6 | 615.3 |
(3)实际生产中,常在恒温恒压下采用加入水蒸气的方法来提高乙烯的产率(水蒸气在此条件下不参与反应),请用平衡移动的原理加以说明
您最近半年使用:0次
解题方法
9 . 用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g) + 2N2(g)+ 6H2(g) Si3N4(s) + 12 HCl(g) ΔH<0
Si3N4(s) + 12 HCl(g) ΔH<0
(1)在一定温度下进行上述反应,若反应容器的容积为2 L, 3 min后达到平衡,测得固体的质量增加了2.80g,则H2的平均反应速率为___________ mol / (Lmin);该反应的平衡常数表达式K=___________
(2)上述反应达到平衡后,下列说法正确的是___________ 。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4的物质的量,平衡向左移动
d.其他条件不变,增大HCl的物质的量,平衡向左移动
(3) 一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是___________
a. 3v逆(N2) = v 正(H2)
b. v正 (HCl) = 4v 正(SiCl4)
c.混合气体密度保持不变
d. c(N2): c(H2) :c(HCl)= 1:3:6
(4)若平衡时H2和HCl的物质的量之比为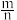 ,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比
,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比___________ 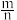 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
 Si3N4(s) + 12 HCl(g) ΔH<0
Si3N4(s) + 12 HCl(g) ΔH<0(1)在一定温度下进行上述反应,若反应容器的容积为2 L, 3 min后达到平衡,测得固体的质量增加了2.80g,则H2的平均反应速率为
(2)上述反应达到平衡后,下列说法正确的是
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4的物质的量,平衡向左移动
d.其他条件不变,增大HCl的物质的量,平衡向左移动
(3) 一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是
a. 3v逆(N2) = v 正(H2)
b. v正 (HCl) = 4v 正(SiCl4)
c.混合气体密度保持不变
d. c(N2): c(H2) :c(HCl)= 1:3:6
(4)若平衡时H2和HCl的物质的量之比为
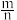 ,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比
,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比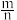 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
您最近半年使用:0次
10 . 填写下列空白:
Ⅰ.气体输运是人体血液系统的重要任务,由此给细胞供氧,所产生的CO2输运至肺,在此与吸入的空气进行气体交换。CO2的含量显著影响血液的pH。文献中关于人体血液的pH一般有两个数值:7.40和7.37。
(1)请指出人体血液的pH的这两个数值分别对应的血液是缺氧的还是富氧的,需简述理由_______ 。
Ⅱ.以下平衡对于血液缓冲至关重要:
①CO2(g)⇌CO2(aq) CO2的亨利常数为 KH =3.40 ×10-2 mol(L·atm)
②CO2(aq)+H2O⇌H2CO3 K2= 4.68 ×10-3
③H2CO3+H2O⇌H3O++ HCO pKa=3.77
pKa=3.77
由于平衡(2)是动力学上受阻的,其比反应(1)和(3)慢得多,细胞中通过碳酸酐酶将溶解的CO2直接转变成HCO :
:
④CO2(aq)+ 2H2O⇌H3O+ + HCO K4
K4
(2)计算K4=_______ 。
(3)当血液的pH=7.40时, c(HCO )= 24.0 mmol/L。计算这种血液中平衡时的c[CO2(aq)]=
)= 24.0 mmol/L。计算这种血液中平衡时的c[CO2(aq)]= _______ 。提示:若在(2)中,您没能求解出K4,此处和后续计算时可用以下值: K4= 8.7 ×10-7。
(4)计算肺中CO2的平均分压_______ 。提示:若您在(3)中没能求解,在此和后续计算时可用pH=7.40时的c[CO2(aq)]=2 mmol/L。
(5)一个人每分钟呼出274 mLCO2 (37.0,1013 ×102Pa) 。通过肺的血液流量的平均值为5.40 L/min。富含CO2的血液中,CO2和HCO 的浓度分别是
的浓度分别是_______ 、_______ 。
(6)对于水和CO2溶液体系,压力和温度如何影响溶液的pH?请简述理由_______ 。
Ⅰ.气体输运是人体血液系统的重要任务,由此给细胞供氧,所产生的CO2输运至肺,在此与吸入的空气进行气体交换。CO2的含量显著影响血液的pH。文献中关于人体血液的pH一般有两个数值:7.40和7.37。
(1)请指出人体血液的pH的这两个数值分别对应的血液是缺氧的还是富氧的,需简述理由
Ⅱ.以下平衡对于血液缓冲至关重要:
①CO2(g)⇌CO2(aq) CO2的亨利常数为 KH =3.40 ×10-2 mol(L·atm)
②CO2(aq)+H2O⇌H2CO3 K2= 4.68 ×10-3
③H2CO3+H2O⇌H3O++ HCO
 pKa=3.77
pKa=3.77由于平衡(2)是动力学上受阻的,其比反应(1)和(3)慢得多,细胞中通过碳酸酐酶将溶解的CO2直接转变成HCO
 :
:④CO2(aq)+ 2H2O⇌H3O+ + HCO
 K4
K4(2)计算K4=
(3)当血液的pH=7.40时, c(HCO
 )= 24.0 mmol/L。计算这种血液中平衡时的c[CO2(aq)]=
)= 24.0 mmol/L。计算这种血液中平衡时的c[CO2(aq)]= (4)计算肺中CO2的平均分压
(5)一个人每分钟呼出274 mLCO2 (37.0,1013 ×102Pa) 。通过肺的血液流量的平均值为5.40 L/min。富含CO2的血液中,CO2和HCO
 的浓度分别是
的浓度分别是(6)对于水和CO2溶液体系,压力和温度如何影响溶液的pH?请简述理由
您最近半年使用:0次



