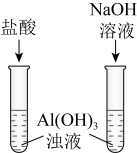
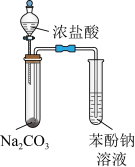
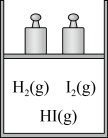
解题方法
1 . 下列实验装置及药品能达到相应实验目的的是
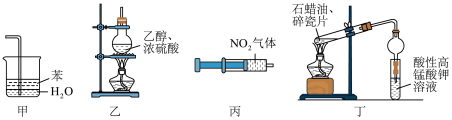
| A.利用甲装置在实验室中吸收尾气氨气 |
| B.利用乙装置在实验室中制备乙烯 |
| C.利用丙装置可验证压强对化学平衡的影响 |
| D.利用丁装置验证石蜡油受热分解产生乙烯 |
您最近半年使用:0次
2 . 为实现实验目的,下列实验操作和现象均正确的是
| 选项 | 实验目的 | 实验操作 | 实验现象 |
| A | 证明金属性 | 少量金属Na与胆矾隔绝空气加热 | 有红色固体生成 |
| B | 验证压强对化学平衡的影响 | 先将注射器充满 气体,然后将活塞往里推 气体,然后将活塞往里推 | 注射器内气体颜色加深,证明加压平衡朝生成 气体的方向移动 气体的方向移动 |
| C | 验证常温下,溶度积: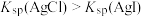 | 常温下,向盛有2滴 溶液的试管中滴加 溶液的试管中滴加 溶液,再向其中滴加 溶液,再向其中滴加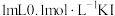 溶液 溶液 | 先有白色沉淀生成,后又产生黄色沉淀 |
| D | 证明浓硫酸具有强氧化性 | 加热浓硫酸、NaCl固体与 固体的混合物 固体的混合物 | 有黄绿色气体产生 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
3 . 下列装置或操作能达到实验目的的是
| 装置或操作 |
|
|
| 目的 | A.证明铝元素既有金属性又有非金属性 | B.验证碳酸的酸性比苯酚的强 |
| 装置或操作 |
|
|
| 目的 | C.验证改变压强能破坏化学平衡状态 | D.鉴别苯和己烷 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
4 . 根据实验操作及现象,下列结论中正确的是
| 选项 | 实验操作及现象 | 结论 |
| A | 向盛有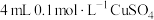 溶液的试管里滴加 溶液的试管里滴加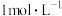 氨水至得到深蓝色的透明溶液,再向试管中加入 氨水至得到深蓝色的透明溶液,再向试管中加入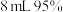 乙醇,析出深蓝色晶体 乙醇,析出深蓝色晶体 | 制备晶体为 |
| B | 用50 mL注射器吸入约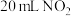 与 与 的混合气体,将细管端用橡胶塞封闭。然后往外拉活塞至40 mL处,混合气体的颜色先变浅又逐渐变深 的混合气体,将细管端用橡胶塞封闭。然后往外拉活塞至40 mL处,混合气体的颜色先变浅又逐渐变深 | 颜色逐渐变深是因为化学平衡发生移动 |
| C | 将红热的木炭缓慢放入盛有浓硝酸的试管中,有红棕色气体产生 | 木炭与浓硝酸反应产生 |
| D | 将乙醇和浓硫酸混合液迅速加热至170℃,将产生的气体通入溴水中,溴水褪色 | 乙烯与溴水发生了加成反应 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2024-04-16更新
|
280次组卷
|
2卷引用:广西壮族自治区柳州市2024届高三第三次模拟考试化学试题
5 . 在下列实验中,解释或结论正确的是
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 向某无色溶液中加入稀盐酸 | 生成的无色气体能使品红褪色 | 该无色溶液中存在 |
| B | 向FeBr3溶液中加入足量H2O2 | 生成大量气泡 | FeBr3作氧化剂且氧化性: Fe3+>H2O2 |
| C | 一定温度下,向某容器中充入HI气体,一段时间后压缩容器体积为原来的一半 | 气体颜色变深 | 气体压强增大使平衡正向移动 |
| D | 将溴乙烷制备乙烯生成的气体依次通过足量蒸馏水、酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 乙烯能被酸性高锰酸钾氧化 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
6 .  可作大型船舶的绿色燃料,可由CO或
可作大型船舶的绿色燃料,可由CO或 制备。工业上用
制备。工业上用 制备
制备 的原理如下:
的原理如下:
反应1:
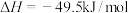
反应2:
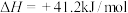 (副反应)
(副反应)
(1) ,该反应的
,该反应的
___________  。
。
(2)将 和
和 按
按 通入密闭容器中发生反应1和反应2,分别在
通入密闭容器中发生反应1和反应2,分别在 、
、 、
、 下改变反应温度,测得
下改变反应温度,测得 的平衡转化率(
的平衡转化率( )以及生成
)以及生成 、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。 下
下 随温度变化趋势的是曲线
随温度变化趋势的是曲线___________ (填“a”“b”或“c”)。
②随着温度升高,a、b、c三条曲线接近重合的原因是___________ 。
③P点对应的反应2的平衡常数
___________ (保留两位有效数字)。
④分子筛膜反应器可提高反应1的平衡转化率、且实现 选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是
选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是___________ 。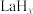 ,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
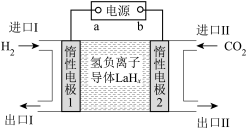
①电极a为电源的___________ (填“正极”或“负极”)。
②生成 的电极反应式为
的电极反应式为___________ 。
③若反应2也同时发生,出口Ⅱ为CO、 、
、 的混合气,且
的混合气,且 ,则惰性电极2的电流效率
,则惰性电极2的电流效率 为
为___________ (
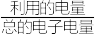 ×100%)。
×100%)。
 可作大型船舶的绿色燃料,可由CO或
可作大型船舶的绿色燃料,可由CO或 制备。工业上用
制备。工业上用 制备
制备 的原理如下:
的原理如下:反应1:

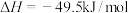
反应2:

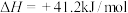 (副反应)
(副反应)(1)
 ,该反应的
,该反应的
 。
。(2)将
 和
和 按
按 通入密闭容器中发生反应1和反应2,分别在
通入密闭容器中发生反应1和反应2,分别在 、
、 、
、 下改变反应温度,测得
下改变反应温度,测得 的平衡转化率(
的平衡转化率( )以及生成
)以及生成 、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
 下
下 随温度变化趋势的是曲线
随温度变化趋势的是曲线②随着温度升高,a、b、c三条曲线接近重合的原因是
③P点对应的反应2的平衡常数

④分子筛膜反应器可提高反应1的平衡转化率、且实现
 选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是
选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是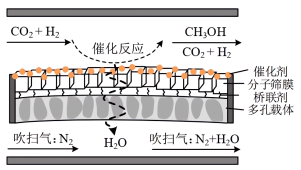
 ,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
①电极a为电源的
②生成
 的电极反应式为
的电极反应式为③若反应2也同时发生,出口Ⅱ为CO、
 、
、 的混合气,且
的混合气,且 ,则惰性电极2的电流效率
,则惰性电极2的电流效率 为
为
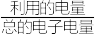 ×100%)。
×100%)。
您最近半年使用:0次
2023-06-03更新
|
674次组卷
|
5卷引用:重庆市巴蜀中学校2023学年高三模拟预测化学试题
重庆市巴蜀中学校2023学年高三模拟预测化学试题广西名校2023-2024学年高三上学期仿真卷(一)化学试题(已下线)专题14 化学反应原理综合题-2023年高考化学真题题源解密(新高考专用)湖南省长沙市雅礼中学2023-2024学年高三上学期1月期末化学试题湖南省宁乡市实验中学等多校联考2024届高三下学期一轮复习总结性考试(月考)化学试题
7 . 甲烷的直接转化具有较高的经济价值,因此备受科学家关注。请回答下列问题:
(1)用丝光沸石作催化剂可实现甲烷直接转化制备甲醇,合成方法有以下两种:
方法I:CH4(g)+ O2(g)
O2(g) CH3OH(g) △H1=-126.4kJ•mol-1
CH3OH(g) △H1=-126.4kJ•mol-1
方法II:CH4(g)+H2O(g) CH3OH(g)+H2(g) △H2
CH3OH(g)+H2(g) △H2
已知H2的燃烧热为285.8kJ/mol,H2O(l)=H2O(g) △H=+44kJ•mol-1,则△H2=_______ 。
(2)某工厂采用方法Ⅰ生产甲醇。在200℃下,向容积为5L的恒容密闭反应器中加入催化剂,并充入6.0kPaCH4、4.8kPaO2和一定量He使反应充分进行,体系的总压强随时间的变化如图所示。
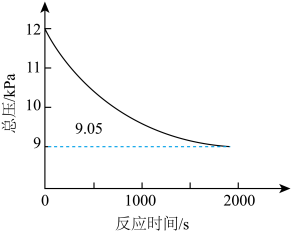
①下列措施可以提高CH4的平衡转化率的是_______ (填标号)。
A.升高温度
B.反应达到平衡后,再充入一定量He
C.投料比不变,增大反应物浓度
②达到平衡时体系中CH3OH的体积分数为_______ (精确到0.1%)。
③该反应温度下,方法I的标准压力平衡常数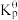 =
=_______ (列出计算式)。[已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g) gG(g)+hH(g),
gG(g)+hH(g), 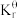 =
=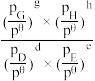 ,其中pθ=100kPa,pC、pH、pD、pE为各组分的平衡分压。]
,其中pθ=100kPa,pC、pH、pD、pE为各组分的平衡分压。]
④若将容器改为绝热容器,初始温度为200℃,其他条件不变,达到新平衡时,甲醇产率降低,原因是_______ 。
(3)为提高生产效率,利用方法Ⅱ进行连续生产时采用如图所示的步骤控制体系温度和通入气体(各阶段气体流速相同)。
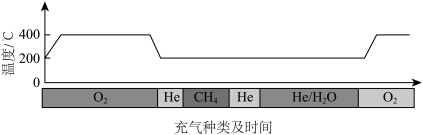
已知大多数气体分子在催化剂表面的吸附过程是放热的,He不会在催化剂表面吸附,吸附和解吸附不会导致体系温度的变化。通入CH4发生反应前,要往反应器中通入O2从而活化催化剂,活化催化剂后持续通入He一段时间的目的是_______ ;请从反应速率的角度说明,通入CH4后反应温度维持在200℃的原因:_______ 。
(4)用ZrO2/NiCo2O4作电解催化剂也可以实现甲烷的直接转化,装置如图所示。
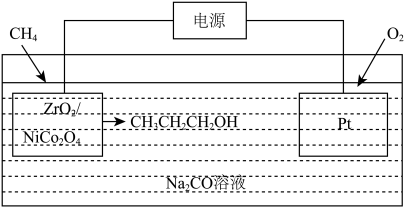
写出ZrO2/NiCo2O4电极的反应式:_______ 。
(1)用丝光沸石作催化剂可实现甲烷直接转化制备甲醇,合成方法有以下两种:
方法I:CH4(g)+
 O2(g)
O2(g) CH3OH(g) △H1=-126.4kJ•mol-1
CH3OH(g) △H1=-126.4kJ•mol-1方法II:CH4(g)+H2O(g)
 CH3OH(g)+H2(g) △H2
CH3OH(g)+H2(g) △H2已知H2的燃烧热为285.8kJ/mol,H2O(l)=H2O(g) △H=+44kJ•mol-1,则△H2=
(2)某工厂采用方法Ⅰ生产甲醇。在200℃下,向容积为5L的恒容密闭反应器中加入催化剂,并充入6.0kPaCH4、4.8kPaO2和一定量He使反应充分进行,体系的总压强随时间的变化如图所示。

①下列措施可以提高CH4的平衡转化率的是
A.升高温度
B.反应达到平衡后,再充入一定量He
C.投料比不变,增大反应物浓度
②达到平衡时体系中CH3OH的体积分数为
③该反应温度下,方法I的标准压力平衡常数
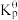 =
= gG(g)+hH(g),
gG(g)+hH(g), 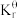 =
=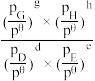 ,其中pθ=100kPa,pC、pH、pD、pE为各组分的平衡分压。]
,其中pθ=100kPa,pC、pH、pD、pE为各组分的平衡分压。]④若将容器改为绝热容器,初始温度为200℃,其他条件不变,达到新平衡时,甲醇产率降低,原因是
(3)为提高生产效率,利用方法Ⅱ进行连续生产时采用如图所示的步骤控制体系温度和通入气体(各阶段气体流速相同)。

已知大多数气体分子在催化剂表面的吸附过程是放热的,He不会在催化剂表面吸附,吸附和解吸附不会导致体系温度的变化。通入CH4发生反应前,要往反应器中通入O2从而活化催化剂,活化催化剂后持续通入He一段时间的目的是
(4)用ZrO2/NiCo2O4作电解催化剂也可以实现甲烷的直接转化,装置如图所示。

写出ZrO2/NiCo2O4电极的反应式:
您最近半年使用:0次
8 . 工业合成氨在人类历史上具有非常重要的意义。回答下列问题:
(1)断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表:
进行反应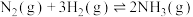 ,当生成2mol
,当生成2mol  时,将
时,将___________ (填“吸收”或“放出”)___________ kJ的热量。
(2)Bosch在研究合成氨工业的催化剂和装置时,发现氢气渗透到钢铁内部生成了一种能产生温室效应的气体,该气体为___________ (填名称),用铁催化氨合成时会产生FeN,氢气与FeN反应生成氨气,写出氢气与FeN反应的化学方程式___________ 。
(3)20世纪初、以Nernst和Haber为代表的研究小组研究不同反应条件下的合成氨反应、所得数据如下表:
试解释Haber采取的生产条件平衡混合气体中 所占体积分数高的原因
所占体积分数高的原因___________ 。
(4)以氨气和二氧化碳为原料制备尿素的化学方程式为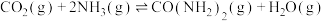 ,反应物平衡转化率随氨碳比的变化曲线如图所示,刚性容器中当投料比
,反应物平衡转化率随氨碳比的变化曲线如图所示,刚性容器中当投料比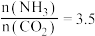 且初始压强为45MPa时,该反应的平衡常数
且初始压强为45MPa时,该反应的平衡常数
___________  。(结果用分数表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
。(结果用分数表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)

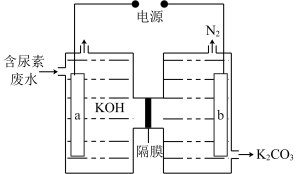
(5)尿素的过度使用会造成水体污染,科学家通过电解的方法处理含尿素的碱性废水、并向煤液化供氢。其装置如图所示,电极b上的电极反应式为___________ 。
(1)断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表:
| 共价键 | H-H | N-H | N≡N |
能量变化/( ) ) | 436.0 | 390.8 | 946.0 |
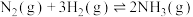 ,当生成2mol
,当生成2mol  时,将
时,将(2)Bosch在研究合成氨工业的催化剂和装置时,发现氢气渗透到钢铁内部生成了一种能产生温室效应的气体,该气体为
(3)20世纪初、以Nernst和Haber为代表的研究小组研究不同反应条件下的合成氨反应、所得数据如下表:
| 研究者 | 压强/atm | 温度/℃ | 催化剂 | 反应结果(平衡混合气体中 所占体积分数) 所占体积分数) |
| Nernst | 50 | 685 | 铂、锰 | 0.96% |
| Haber | 150~250 | 550 | 锇、铀 | 8.25% |
 所占体积分数高的原因
所占体积分数高的原因(4)以氨气和二氧化碳为原料制备尿素的化学方程式为
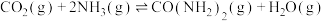 ,反应物平衡转化率随氨碳比的变化曲线如图所示,刚性容器中当投料比
,反应物平衡转化率随氨碳比的变化曲线如图所示,刚性容器中当投料比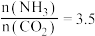 且初始压强为45MPa时,该反应的平衡常数
且初始压强为45MPa时,该反应的平衡常数
 。(结果用分数表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
。(结果用分数表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(5)尿素的过度使用会造成水体污染,科学家通过电解的方法处理含尿素的碱性废水、并向煤液化供氢。其装置如图所示,电极b上的电极反应式为

您最近半年使用:0次