解题方法
1 . 回答下列问题。
(1)已知可逆反应: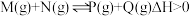 ,请回答下列问题:
,请回答下列问题:
①在某温度下,反应物的起始浓度分别为: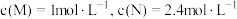 ;达到平衡后,M的转化率为
;达到平衡后,M的转化率为 ,此时N的转化率为
,此时N的转化率为_______ ;平衡常数是多少?(写出计算过程)
②若反应温度升高,M的转化率_______ (填“增大”“减小”或“不变”;)
③若反应温度不变,反应物的起始浓度分别为: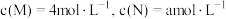 ;达到平衡后,
;达到平衡后,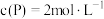 ,则
,则
_______ ;
(2)用酸性 溶液与
溶液与 溶液反应来探究“外界条件对化学反应速率的影响”。
溶液反应来探究“外界条件对化学反应速率的影响”。
实验前先用酸性 标准溶液滴定未知浓度的草酸。
标准溶液滴定未知浓度的草酸。
反应原理: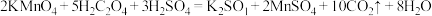 。
。
实验操作:取 待测
待测 溶液放入锥形瓶中,用
溶液放入锥形瓶中,用 酸性
酸性 标准溶液进行滴定。重复上述滴定操作2~3次,并记录数据。
标准溶液进行滴定。重复上述滴定操作2~3次,并记录数据。
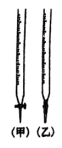
①滴定时,用_______ 滴定管盛装标准酸性 溶液(填“甲”或“乙”滴定终点的现象为
溶液(填“甲”或“乙”滴定终点的现象为_______ 。
②实验时记录的实验数据如下,试计算所测 溶液的浓度为
溶液的浓度为_______  。
。
(1)已知可逆反应:
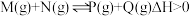 ,请回答下列问题:
,请回答下列问题:①在某温度下,反应物的起始浓度分别为:
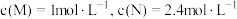 ;达到平衡后,M的转化率为
;达到平衡后,M的转化率为 ,此时N的转化率为
,此时N的转化率为②若反应温度升高,M的转化率
③若反应温度不变,反应物的起始浓度分别为:
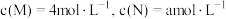 ;达到平衡后,
;达到平衡后,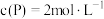 ,则
,则
(2)用酸性
 溶液与
溶液与 溶液反应来探究“外界条件对化学反应速率的影响”。
溶液反应来探究“外界条件对化学反应速率的影响”。实验前先用酸性
 标准溶液滴定未知浓度的草酸。
标准溶液滴定未知浓度的草酸。反应原理:
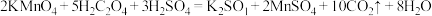 。
。实验操作:取
 待测
待测 溶液放入锥形瓶中,用
溶液放入锥形瓶中,用 酸性
酸性 标准溶液进行滴定。重复上述滴定操作2~3次,并记录数据。
标准溶液进行滴定。重复上述滴定操作2~3次,并记录数据。
①滴定时,用
 溶液(填“甲”或“乙”滴定终点的现象为
溶液(填“甲”或“乙”滴定终点的现象为②实验时记录的实验数据如下,试计算所测
 溶液的浓度为
溶液的浓度为 。
。| 实验次数编号 | 待测液体积 | 滴入的标准液体积 |
| 1 | 20.00 | 16.05 |
| 2 | 20.00 | 15.95 |
| 3 | 20.00 | 16.00 |
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
2 . 一定条件下,反应:CH3CH2CH3(g)  CH2=CHCH3(g)+H2(g) △H1=+123.8kJ/mol;丙烷平衡转化率x与平衡常数Kp的关系可表示为:
CH2=CHCH3(g)+H2(g) △H1=+123.8kJ/mol;丙烷平衡转化率x与平衡常数Kp的关系可表示为: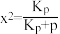 ,式中p为系统总压。p分别为0.10MPa和0.010MPa时,丙烷平衡转化率与温度的关系如图所示,其中表示0.10MPa下的关系曲线是
,式中p为系统总压。p分别为0.10MPa和0.010MPa时,丙烷平衡转化率与温度的关系如图所示,其中表示0.10MPa下的关系曲线是_______ (填“Ⅰ”或“Ⅱ”)。570℃时,KP=_______ MPa (保留2位有效数字)。

 CH2=CHCH3(g)+H2(g) △H1=+123.8kJ/mol;丙烷平衡转化率x与平衡常数Kp的关系可表示为:
CH2=CHCH3(g)+H2(g) △H1=+123.8kJ/mol;丙烷平衡转化率x与平衡常数Kp的关系可表示为: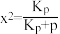 ,式中p为系统总压。p分别为0.10MPa和0.010MPa时,丙烷平衡转化率与温度的关系如图所示,其中表示0.10MPa下的关系曲线是
,式中p为系统总压。p分别为0.10MPa和0.010MPa时,丙烷平衡转化率与温度的关系如图所示,其中表示0.10MPa下的关系曲线是
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
3 . 1200K时,假定体系内只有反应C40H12 (g) C40H10(g) + H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平衡常数Kp为
C40H10(g) + H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平衡常数Kp为_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 C40H10(g) + H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平衡常数Kp为
C40H10(g) + H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平衡常数Kp为
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
4 . 升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g) 2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g)
2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
i:2NO(g) N2O2(g)(快),v1正=k1正·c2(NO) v1逆=k1逆·c(N2O2) ΔH1<0
N2O2(g)(快),v1正=k1正·c2(NO) v1逆=k1逆·c(N2O2) ΔH1<0
ii:N2O2(g)+O2(g) 2NO2(g)(慢),v2正=k2正·c(N2O2)·c(O2) v2逆=k2逆·c2(NO2) ΔH2<0
2NO2(g)(慢),v2正=k2正·c(N2O2)·c(O2) v2逆=k2逆·c2(NO2) ΔH2<0
一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=______ 。
 2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g)
2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:i:2NO(g)
 N2O2(g)(快),v1正=k1正·c2(NO) v1逆=k1逆·c(N2O2) ΔH1<0
N2O2(g)(快),v1正=k1正·c2(NO) v1逆=k1逆·c(N2O2) ΔH1<0ii:N2O2(g)+O2(g)
 2NO2(g)(慢),v2正=k2正·c(N2O2)·c(O2) v2逆=k2逆·c2(NO2) ΔH2<0
2NO2(g)(慢),v2正=k2正·c(N2O2)·c(O2) v2逆=k2逆·c2(NO2) ΔH2<0一定温度下,反应2NO(g)+O2(g)
 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
您最近一年使用:0次
解题方法
5 . 一定温度下,向密闭容器中加入足量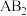 ,发生反应
,发生反应 。达到平衡状态后,测得
。达到平衡状态后,测得 ,保持温度不变,将容器的容积扩大一倍,达到新平衡时
,保持温度不变,将容器的容积扩大一倍,达到新平衡时 为
为
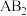 ,发生反应
,发生反应 。达到平衡状态后,测得
。达到平衡状态后,测得 ,保持温度不变,将容器的容积扩大一倍,达到新平衡时
,保持温度不变,将容器的容积扩大一倍,达到新平衡时 为
为A. | B. | C.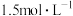 | D. |
您最近一年使用:0次
2023-11-14更新
|
108次组卷
|
3卷引用:河南省新乡市2023-2024学年高二上学期期中考试化学试题
河南省新乡市2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业03 化学平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)河南省郑州学森实验学校2023-2024学年高二上学期1月月考 化学试题
解题方法
6 . 顺1,2二甲基环丙烷和反1,2二甲基环丙烷可发生如下转化:

该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。已知:t1温度下,k(正)=0.006 s-1,k(逆)=0.002 s-1,该温度下反应的平衡常数值K=_______ 。

该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。已知:t1温度下,k(正)=0.006 s-1,k(逆)=0.002 s-1,该温度下反应的平衡常数值K=
您最近一年使用:0次
名校
7 . 在硫酸工业中,通过下列反应使SO2氧化为SO3:2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是___________ 。
(2)在实际生产中,选定的温度为400℃~500℃,原因是___________
(3)在实际生产中,采用的压强为常压,原因是___________
(4)在实际生产中,通入过量的空气,原因是___________
(5)尾气中的SO2必须回收,原因是___________ 。
(6)在550℃、1MPa下,若SO2的起始浓度为2mol/L,O2的起始浓度为1mol/L,试求该条件下的平衡常数K=___________ 。
 2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g)ΔH=-196.6kJ·mol-1.下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 95.0 | 97.7 | 98.3 |
(2)在实际生产中,选定的温度为400℃~500℃,原因是
(3)在实际生产中,采用的压强为常压,原因是
(4)在实际生产中,通入过量的空气,原因是
(5)尾气中的SO2必须回收,原因是
(6)在550℃、1MPa下,若SO2的起始浓度为2mol/L,O2的起始浓度为1mol/L,试求该条件下的平衡常数K=
您最近一年使用:0次
8 . H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)平衡时CO2的浓度为_______ 。
(2)H2S的平衡转化率α1=_______ %,反应平衡常数K=_______ 。
 COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。(1)平衡时CO2的浓度为
(2)H2S的平衡转化率α1=
您最近一年使用:0次
解题方法
9 . 已知25 ℃时,Ksp[Fe(OH)3]=8×10-39。
(1)该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数为
Fe3++3H2O的平衡常数为_________________ (列式并计算)。
(2)向0.001 mol·L-1 FeCl3溶液中通入氨气(体积变化忽略不计),开始沉淀时溶液的pH为___________ (lg 5=0.7)。
(1)该温度下反应Fe(OH)3+3H+
 Fe3++3H2O的平衡常数为
Fe3++3H2O的平衡常数为(2)向0.001 mol·L-1 FeCl3溶液中通入氨气(体积变化忽略不计),开始沉淀时溶液的pH为
您最近一年使用:0次
10 . 在一定温度下的密闭容器中,加入1 mol CO和1 mol H2O发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),达到平衡时测得n(H2)=0.5 mol,下列说法不正确的是
| A.在该温度下,反应的平衡常数K=1 |
| B.平衡常数与反应温度无关 |
| C.CO的平衡转化率为50% |
| D.平衡时n(H2O)=0.5 mol |
您最近一年使用:0次
2023-08-26更新
|
629次组卷
|
9卷引用:鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时1 化学平衡常数 平衡转化率
鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时1 化学平衡常数 平衡转化率黑龙江省哈尔滨师范大学附属中学2021-2022学年高二上学期开学考试化学试题河南省内乡县第三高级中学2021-2022学年高二上学期第一次月考化学试卷(已下线)第04讲 化学平衡状态 化学平衡常数-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)第1课时 化学平衡常数 平衡转化率陕西省渭南市蒲城县蒲城中学2023-2024学年高二上学期期中考试化学试题吉林省白城市洮南市第一中学2020-2021学年高二上学期第一次月考化学试题吉林省吉林市2022-2023学年高二上学期期中调研测试化学试题新疆塔城地区第一高级中学2023-2024学年高二上学期9月月考化学试题



