解题方法
1 . 二氧化碳捕集利用与封存、甲烷重整是实现“双碳”目标的重要途径。回答下列问题:
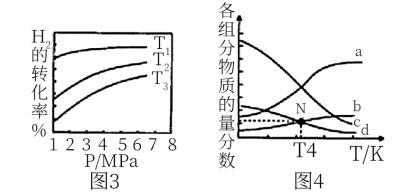
Ⅰ.化学家通过理论计算与研究,提出含氧空位的氧化铜对 加氢选择合成甲醇具有高活性,后续实验研究证实了该理论预测。
加氢选择合成甲醇具有高活性,后续实验研究证实了该理论预测。 加氢选择合成甲醇的主要反应如下:
加氢选择合成甲醇的主要反应如下:
①

②

③

298K时,测得键能数据如下表所示。
(1)有利于反应①自发进行的条件是___________ (填“高温”或“低温”);
___________  ,有利于提高甲醇产率的措施有
,有利于提高甲醇产率的措施有___________ (至少回答2条)。
(2)将 与
与 按物质的量之比为3:1投入15MPa、220℃的密闭容器中进行上述反应①,不能说明反应一定达到平衡状态的是___________。
按物质的量之比为3:1投入15MPa、220℃的密闭容器中进行上述反应①,不能说明反应一定达到平衡状态的是___________。
Ⅱ.甲烷重整工艺主要包括甲烷二氧化碳重整制氢、甲烷三重整制氢等。
(3)甲烷三重整制氢的主要反应为④
 。若将
。若将 与CO按物质的量之比3:1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为
与CO按物质的量之比3:1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为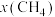 ,在
,在 条件下
条件下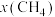 与p的关系、在
与p的关系、在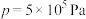 条件下
条件下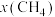 与t的关系如图a所示。当CO的平衡转化率为
与t的关系如图a所示。当CO的平衡转化率为 时,反应条件可能是
时,反应条件可能是___________ ;210℃条件下,反应④的压强平衡常数
___________  (保留三位有效数字)。甲烷三重整制氢工业一般将反应温度设置为750~920℃,将反应压力设置为2~3MPa,并向转化炉内通入空气或氧气,通入空气或氧气的目的是
(保留三位有效数字)。甲烷三重整制氢工业一般将反应温度设置为750~920℃,将反应压力设置为2~3MPa,并向转化炉内通入空气或氧气,通入空气或氧气的目的是___________ 。

(4) 与
与 重整制氢主要反应为⑤
重整制氢主要反应为⑤ ,该反应的阿伦尼乌斯经验公式实验数据如图b所示,已知阿伦尼乌斯经验公式
,该反应的阿伦尼乌斯经验公式实验数据如图b所示,已知阿伦尼乌斯经验公式 (
( 为活化能,k为速率常数,R和C为常数)。反应⑤逆反应的活化能为
为活化能,k为速率常数,R和C为常数)。反应⑤逆反应的活化能为___________  。
。

Ⅰ.化学家通过理论计算与研究,提出含氧空位的氧化铜对
 加氢选择合成甲醇具有高活性,后续实验研究证实了该理论预测。
加氢选择合成甲醇具有高活性,后续实验研究证实了该理论预测。 加氢选择合成甲醇的主要反应如下:
加氢选择合成甲醇的主要反应如下:①


②


③


298K时,测得键能数据如下表所示。
| 化学键 | C=O( ) ) | C-O | C-H | O-H | H-H |
键能 | 803 | 326 | 414 | 464 | 436 |

 ,有利于提高甲醇产率的措施有
,有利于提高甲醇产率的措施有(2)将
 与
与 按物质的量之比为3:1投入15MPa、220℃的密闭容器中进行上述反应①,不能说明反应一定达到平衡状态的是___________。
按物质的量之比为3:1投入15MPa、220℃的密闭容器中进行上述反应①,不能说明反应一定达到平衡状态的是___________。| A.容器体积不再发生改变 |
B. |
| C.混合气体的平均相对分子质量不再改变 |
D.某时刻测得 与 与 的物质的量之比为3:1 的物质的量之比为3:1 |
Ⅱ.甲烷重整工艺主要包括甲烷二氧化碳重整制氢、甲烷三重整制氢等。
(3)甲烷三重整制氢的主要反应为④

 。若将
。若将 与CO按物质的量之比3:1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为
与CO按物质的量之比3:1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为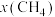 ,在
,在 条件下
条件下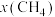 与p的关系、在
与p的关系、在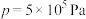 条件下
条件下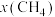 与t的关系如图a所示。当CO的平衡转化率为
与t的关系如图a所示。当CO的平衡转化率为 时,反应条件可能是
时,反应条件可能是
 (保留三位有效数字)。甲烷三重整制氢工业一般将反应温度设置为750~920℃,将反应压力设置为2~3MPa,并向转化炉内通入空气或氧气,通入空气或氧气的目的是
(保留三位有效数字)。甲烷三重整制氢工业一般将反应温度设置为750~920℃,将反应压力设置为2~3MPa,并向转化炉内通入空气或氧气,通入空气或氧气的目的是
(4)
 与
与 重整制氢主要反应为⑤
重整制氢主要反应为⑤ ,该反应的阿伦尼乌斯经验公式实验数据如图b所示,已知阿伦尼乌斯经验公式
,该反应的阿伦尼乌斯经验公式实验数据如图b所示,已知阿伦尼乌斯经验公式 (
( 为活化能,k为速率常数,R和C为常数)。反应⑤逆反应的活化能为
为活化能,k为速率常数,R和C为常数)。反应⑤逆反应的活化能为 。
。
您最近一年使用:0次
解题方法
2 . 环氧丙醇(GLD)常用作树脂改性剂。在液相有机体系中,可通过碳酸二甲酯(DMC)和丙三醇(GL)制得,体系中同时存在如下反应:
反应I: ΔH1<0
ΔH1<0
反应Ⅱ: ΔH2>0
ΔH2>0
反应Ⅲ: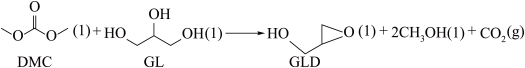 ΔH3<0
ΔH3<0
已知:
①敞口容器可看成恒压装置,体系压强在反应过程中与大气压( )相等;
)相等;
②反应中产生的 物质的量相对于空气中很少,故可忽略不计,空气中
物质的量相对于空气中很少,故可忽略不计,空气中 的体积分数约为0.04%;
的体积分数约为0.04%;
③气体和液体共存于同一体系,如在溶剂E中发生的反应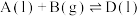 ,其平衡常数表达式可表示为
,其平衡常数表达式可表示为 [
[ 为气体分压,
为气体分压, 为液相体系中物质的物质的量分数,
为液相体系中物质的物质的量分数,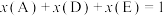 ]。
]。
回答下列问题:
(1)反应I、Ⅱ、Ⅲ的焓变 随温度T的变化如图所示。据图判断,表示反应I的焓变曲线为
随温度T的变化如图所示。据图判断,表示反应I的焓变曲线为________ (填“ ”“
”“ ”或“
”或“ ”)。
”)。

(2)为研究上述反应的平衡关系,向敞口反应容器中加入1.0molDMC和1.0molGL,控制温度为 ℃。平衡时,测得液相体系中GLD的物质的量分数
℃。平衡时,测得液相体系中GLD的物质的量分数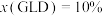 ,反应Ⅱ的平衡常数
,反应Ⅱ的平衡常数 ,平衡时GLD的产率=
,平衡时GLD的产率=________ %,体系放出热量=________ kJ,反应I各组分以液相体系中物质的量分数表示的平衡常数
________ 。
(3)同温下,向上述体系中注入惰性四氯化碳稀释,以W表示体系中加入 与反应物物质的量的比值。实验测定W不同时,DMC的平衡转化率和GLD的平衡产率随温度的变化关系如图所示。
与反应物物质的量的比值。实验测定W不同时,DMC的平衡转化率和GLD的平衡产率随温度的变化关系如图所示。

其中纵坐标表示GLD平衡产率的是图________ (填“甲”或“乙”);W最大的是________ (填“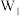 ”、“
”、“ ”或“
”或“ ”)。图丙为在不同催化剂下反应相同时间DMC的转化率随温度变化的关系,图丙上的b、d两点可能是甲、乙两图像所测绘时选取的位置,其原因为
”)。图丙为在不同催化剂下反应相同时间DMC的转化率随温度变化的关系,图丙上的b、d两点可能是甲、乙两图像所测绘时选取的位置,其原因为________ 。
反应I:
 ΔH1<0
ΔH1<0反应Ⅱ:
 ΔH2>0
ΔH2>0反应Ⅲ:
 ΔH3<0
ΔH3<0已知:
①敞口容器可看成恒压装置,体系压强在反应过程中与大气压(
 )相等;
)相等;②反应中产生的
 物质的量相对于空气中很少,故可忽略不计,空气中
物质的量相对于空气中很少,故可忽略不计,空气中 的体积分数约为0.04%;
的体积分数约为0.04%;③气体和液体共存于同一体系,如在溶剂E中发生的反应
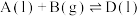 ,其平衡常数表达式可表示为
,其平衡常数表达式可表示为 [
[ 为气体分压,
为气体分压, 为液相体系中物质的物质的量分数,
为液相体系中物质的物质的量分数,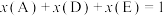 ]。
]。回答下列问题:
(1)反应I、Ⅱ、Ⅲ的焓变
 随温度T的变化如图所示。据图判断,表示反应I的焓变曲线为
随温度T的变化如图所示。据图判断,表示反应I的焓变曲线为 ”“
”“ ”或“
”或“ ”)。
”)。
(2)为研究上述反应的平衡关系,向敞口反应容器中加入1.0molDMC和1.0molGL,控制温度为
 ℃。平衡时,测得液相体系中GLD的物质的量分数
℃。平衡时,测得液相体系中GLD的物质的量分数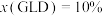 ,反应Ⅱ的平衡常数
,反应Ⅱ的平衡常数 ,平衡时GLD的产率=
,平衡时GLD的产率=
(3)同温下,向上述体系中注入惰性四氯化碳稀释,以W表示体系中加入
 与反应物物质的量的比值。实验测定W不同时,DMC的平衡转化率和GLD的平衡产率随温度的变化关系如图所示。
与反应物物质的量的比值。实验测定W不同时,DMC的平衡转化率和GLD的平衡产率随温度的变化关系如图所示。
其中纵坐标表示GLD平衡产率的是图
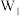 ”、“
”、“ ”或“
”或“ ”)。图丙为在不同催化剂下反应相同时间DMC的转化率随温度变化的关系,图丙上的b、d两点可能是甲、乙两图像所测绘时选取的位置,其原因为
”)。图丙为在不同催化剂下反应相同时间DMC的转化率随温度变化的关系,图丙上的b、d两点可能是甲、乙两图像所测绘时选取的位置,其原因为
您最近一年使用:0次
解题方法
3 . 有机物T常用作添加剂。在催化剂作用下,可通过甲醇与烯烃A和B的液相反应制得,体系中同时存在如下反应:
反应Ⅰ ΔH1=akJ/mol
ΔH1=akJ/mol
反应Ⅱ ΔH2=bkJ/mol
ΔH2=bkJ/mol
反应Ⅲ A B ΔH3=ckJ/mol
B ΔH3=ckJ/mol
回答下列问题:
(1)写出a、b、c的代数关系式___________ ;上述反应以物质的量分数表示的平衡常数Kx与温度T变化关系如图所示,则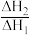 的数值范围是
的数值范围是___________ (填标号)
A.<-1 B.-1~0 C.0~1 D.>1

(2)T°C时,已知反应Ⅲ的平衡常数Kx3=4.0。
①向盛有惰性溶剂四氢呋哺的容器中加入一定量A、B和CH3OH;控制温度为T°C,AB物质的量浓度c随反应时间t的变化如表所示。0-100s内A的平均反应速率v(A)=___________ mol·L-1·s-1;t=100s时,反应Ⅲ的正反应速率v正___________ 逆反应速率v逆(填“>”“<”或“=”)。
②向另一容器中加入惰性溶剂四氢呋喃和1.0molT,平衡时测得T的转化率为0.2,则平衡体系中A的物质的量为___________ mol,反应Ⅱ的平衡常数Kx2=___________ 。同温下,再向该容器中注入四氢呋喃稀释,则下列说法正确的有___________ 。
a.反应Ⅰ的化学平衡将逆向移动
b.再次平衡时,CH3OH的物质的量分数为50%
c.再次平衡时,c(B):c(CH3OH)变小
d.再次平衡时,c(B):c(CH3OH)不变
反应Ⅰ
 ΔH1=akJ/mol
ΔH1=akJ/mol反应Ⅱ
 ΔH2=bkJ/mol
ΔH2=bkJ/mol反应Ⅲ A
 B ΔH3=ckJ/mol
B ΔH3=ckJ/mol回答下列问题:
(1)写出a、b、c的代数关系式
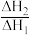 的数值范围是
的数值范围是A.<-1 B.-1~0 C.0~1 D.>1

(2)T°C时,已知反应Ⅲ的平衡常数Kx3=4.0。
①向盛有惰性溶剂四氢呋哺的容器中加入一定量A、B和CH3OH;控制温度为T°C,AB物质的量浓度c随反应时间t的变化如表所示。0-100s内A的平均反应速率v(A)=
| 时间t/s | t=0 | t=100 | t=200 | t=300 | |
| 浓度c/mol·L-1 | A | 0.050 | 0.028 | 0.018 | 0.018 |
| B | 0.250 | 0.115 | |||
a.反应Ⅰ的化学平衡将逆向移动
b.再次平衡时,CH3OH的物质的量分数为50%
c.再次平衡时,c(B):c(CH3OH)变小
d.再次平衡时,c(B):c(CH3OH)不变
您最近一年使用:0次
名校
解题方法
4 . 近年,甲醇的制取与应用在全球引发了关于“甲醇经济”的广泛探讨。二氧化碳加氢制甲醇已经成为研究热点,在某 催化加氢制
催化加氢制 的反应体系中,发生的主要反应如下:
的反应体系中,发生的主要反应如下:
Ⅰ.
Ⅱ.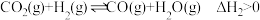
回答下列问题:
(1)下列能说明反应Ⅰ一定达到平衡状态的是_______(填标号)。
(2) 在催化剂作用下,将平均相对分子质量为16的
在催化剂作用下,将平均相对分子质量为16的 和
和 的混合气体充入一恒容密闭容器中发生反应Ⅰ、Ⅱ,已知反应Ⅱ的反应速率
的混合气体充入一恒容密闭容器中发生反应Ⅰ、Ⅱ,已知反应Ⅱ的反应速率 ,
, 为速率常数,x为物质的量分数。
为速率常数,x为物质的量分数。
①当 转化率达到60%时,反应达到平衡状态,这时
转化率达到60%时,反应达到平衡状态,这时 和
和 的平均相对分子质量为23,若反应Ⅱ的
的平均相对分子质量为23,若反应Ⅱ的 ,平衡时反应速率
,平衡时反应速率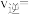
_______  ;
;
② 经验公式为
经验公式为 ,其中
,其中 为活化能,T为热力学温度,k为速率常数,R和C为常数,则
为活化能,T为热力学温度,k为速率常数,R和C为常数,则
_______  (用含
(用含 、
、 、T、R的代数式表示)。
、T、R的代数式表示)。
③由实验测得,随着温度的逐渐升高,反应Ⅰ为主反应,平衡逆向移动平衡时混合气体的平均相对分子质量几乎又变回16,原因是_______ 。
(3)其他条件相同时,反应温度对 选择性的影响如图所示:
选择性的影响如图所示: 选择性的实验值略高于其平衡值,可能的原因是
选择性的实验值略高于其平衡值,可能的原因是_______ 。
(4)利用甲醇分解制取烯烃,涉及反应如下。
a.
b.
c.
恒压条件下,平衡体系中各物质的量分数随温度变化如图所示: 时,
时, ,平衡体系总压强为P,则
,平衡体系总压强为P,则 反应c的平衡常数
反应c的平衡常数
_______ 。
 催化加氢制
催化加氢制 的反应体系中,发生的主要反应如下:
的反应体系中,发生的主要反应如下:Ⅰ.

Ⅱ.
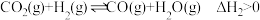
回答下列问题:
(1)下列能说明反应Ⅰ一定达到平衡状态的是_______(填标号)。
A. | B.平衡常数不再发生变化 |
| C.混合气体的密度不再发生变化 | D.混合气体中 的百分含量保持不变 的百分含量保持不变 |
 在催化剂作用下,将平均相对分子质量为16的
在催化剂作用下,将平均相对分子质量为16的 和
和 的混合气体充入一恒容密闭容器中发生反应Ⅰ、Ⅱ,已知反应Ⅱ的反应速率
的混合气体充入一恒容密闭容器中发生反应Ⅰ、Ⅱ,已知反应Ⅱ的反应速率 ,
, 为速率常数,x为物质的量分数。
为速率常数,x为物质的量分数。①当
 转化率达到60%时,反应达到平衡状态,这时
转化率达到60%时,反应达到平衡状态,这时 和
和 的平均相对分子质量为23,若反应Ⅱ的
的平均相对分子质量为23,若反应Ⅱ的 ,平衡时反应速率
,平衡时反应速率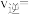
 ;
;②
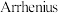 经验公式为
经验公式为 ,其中
,其中 为活化能,T为热力学温度,k为速率常数,R和C为常数,则
为活化能,T为热力学温度,k为速率常数,R和C为常数,则
 (用含
(用含 、
、 、T、R的代数式表示)。
、T、R的代数式表示)。③由实验测得,随着温度的逐渐升高,反应Ⅰ为主反应,平衡逆向移动平衡时混合气体的平均相对分子质量几乎又变回16,原因是
(3)其他条件相同时,反应温度对
 选择性的影响如图所示:
选择性的影响如图所示: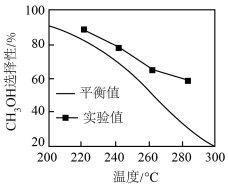
 选择性的实验值略高于其平衡值,可能的原因是
选择性的实验值略高于其平衡值,可能的原因是(4)利用甲醇分解制取烯烃,涉及反应如下。
a.

b.

c.

恒压条件下,平衡体系中各物质的量分数随温度变化如图所示:

 时,
时, ,平衡体系总压强为P,则
,平衡体系总压强为P,则 反应c的平衡常数
反应c的平衡常数
您最近一年使用:0次
2023-04-21更新
|
1451次组卷
|
6卷引用:押题密卷 02-【热题狂飙】2023年高考化学样卷(全国卷专用)
解题方法
5 . 我国科学家成功开发Pd—Fe/Fe2O3催化剂在低温条件下高选择性合成高纯度的乙烯,化学原理如下:
主反应:C2H2(g)+H2(g) C2H4(g) △H1
C2H4(g) △H1
副反应:C2H2(g)+2H2(g) C2H6(g) △H2
C2H6(g) △H2
(1)已知:a.几种共价键的键能如下表所示:
b.C2H2(g)、H2(g)、C2H6(g)的燃烧热△H分别为-1299.6kJ·mol-1、-285.8kJ·mol-1、-1559.8kJ·mol-1。
则△H1=_______ kJ·mol-1;乙烯加氢生成乙烷的热化学方程式是_______ 。
(2)在刚性密闭容器中充入一定量的C2H2(g)和H2(g),发生反应:C2H2(g)+H2(g) C2H4(g)。其他条件相同,在Cat1、Cat2两种催化剂作用下,反应相同时间时C2H2的转化率与温度的关系如图1所示。
C2H4(g)。其他条件相同,在Cat1、Cat2两种催化剂作用下,反应相同时间时C2H2的转化率与温度的关系如图1所示。
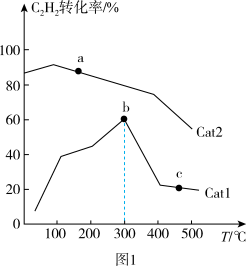
①催化效率较高的是_______ (填“Cat1”或“Cat2”);b点_______ (填“达到”或“未达到”)平衡。
②温度高于300℃,升高温度,b→c的原因可能是_______ (答1条即可)。
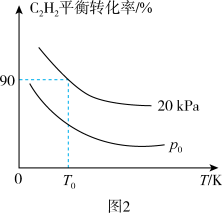
(3)在密闭容器中充入1mol C2H2和2mol H2,发生上述两个反应,测得C2H2平衡转化率与温度、压强的关系如图2所示。在T0 K、20kPa下C2H4的选择性等于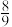 [C2H4选择性=
[C2H4选择性= ]。p0
]。p0_______ 20kPa(填“>”、“<”或“=”)。T0 K下,主反应的平衡常数Kp=_______ kPa-1(Kp为用气体分压计算的平衡常数,气体分压等于气体总压×物质的量分数)。
(4)在恒温刚性密闭容器中通入气体分压比为p(C2H2):p(H2)=1:1的混合气体,已知某反应条件下只发生如下反应(k1、k2为速率常数):
主反应:C2H2(g)+H2(g)=C2H4(g) k1
副反应:C2H4(g)+H2(g)=C2H6(g) k2
实验测得乙烯的净生成速率方程为v(C2H4)=k1p(C2H2)·p(H2)-k2p(C2H4),可推测乙烯的浓度随时间的变化趋势为_______ ,其理由是_______ 。
主反应:C2H2(g)+H2(g)
 C2H4(g) △H1
C2H4(g) △H1副反应:C2H2(g)+2H2(g)
 C2H6(g) △H2
C2H6(g) △H2 (1)已知:a.几种共价键的键能如下表所示:
| 共价键 | H-C | H-H | C=C | C≡C |
| 键能/(kJ·mol-1) | 413.4 | 436 | 615 | 812 |
则△H1=
(2)在刚性密闭容器中充入一定量的C2H2(g)和H2(g),发生反应:C2H2(g)+H2(g)
 C2H4(g)。其他条件相同,在Cat1、Cat2两种催化剂作用下,反应相同时间时C2H2的转化率与温度的关系如图1所示。
C2H4(g)。其他条件相同,在Cat1、Cat2两种催化剂作用下,反应相同时间时C2H2的转化率与温度的关系如图1所示。
①催化效率较高的是
②温度高于300℃,升高温度,b→c的原因可能是
(3)在密闭容器中充入1mol C2H2和2mol H2,发生上述两个反应,测得C2H2平衡转化率与温度、压强的关系如图2所示。在T0 K、20kPa下C2H4的选择性等于
 [C2H4选择性=
[C2H4选择性= ]。p0
]。p0
(4)在恒温刚性密闭容器中通入气体分压比为p(C2H2):p(H2)=1:1的混合气体,已知某反应条件下只发生如下反应(k1、k2为速率常数):
主反应:C2H2(g)+H2(g)=C2H4(g) k1
副反应:C2H4(g)+H2(g)=C2H6(g) k2
实验测得乙烯的净生成速率方程为v(C2H4)=k1p(C2H2)·p(H2)-k2p(C2H4),可推测乙烯的浓度随时间的变化趋势为
您最近一年使用:0次
2022-04-06更新
|
1302次组卷
|
4卷引用:河南省十所名校2021-2022学年高中毕业班阶段性测试(五)理综化学试题
河南省十所名校2021-2022学年高中毕业班阶段性测试(五)理综化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(辽宁地区专用)(已下线)考点23 化学平衡常数-备战2023年高考化学一轮复习考点帮(全国通用)广东省韶关市武江区广东北江实验中学2021-2022学年高三下学期适应性考试(四)化学试题
6 . I.肌红蛋白(Mb)是由肽链和血红素辅基组成的可结合氧的蛋白,广泛存在于肌肉中。肌红蛋白与氧气的结合度(α)与氧分压P(O2)密切相关,存在如下平衡:Mb(aq)+O2(g) MbO2(aq)(a)其中,kA和kD分别是正向和逆向反应的速率常数。37°C,反应达平衡时测得的一组实验数据如图所示。
MbO2(aq)(a)其中,kA和kD分别是正向和逆向反应的速率常数。37°C,反应达平衡时测得的一组实验数据如图所示。

(1)计算37°C下反应(a)的平衡常数K_______ 。
(2)导出平衡时结合度(α)随氧分压变化的表达式_______ 。若空气中氧分压为20.0kPa,计算人正常呼吸时Mb与氧气的最大结合度_______ 。
(3)研究发现,正向反应速率v正=kA(Mb)P(O2);逆向反应速率v逆=kD(MbO2)。已知kD=60s-1,计算速率常数kA=_______ 。当保持氧分压为20.0kPa,计算结合度达50%所需时间_______ 。(提示:对于v逆=kD(MbO2),MbO2分解50%所需时间为t=0.693/kD)
II.Mb含有一个Fe(II),呈顺磁性,与O2结合后形成的MbO2是抗磁性的。MbO2中的铁周围的配位场可近似为八面体场。
(4)这一过程中Fe(II)的价态是否发生改变_______ ,简述原因_______ 。
(5)写出MbO2中铁离子在八面体场中的价电子排布_______ 。
(6)结合O2前后铁离子的半径是不变、变大还是变小_______ ,简述原因_______ 。
(7)O2分子呈顺磁性,它与Mb结合后,价电子排布是否发生变化___ ,简述原因____ 。
 MbO2(aq)(a)其中,kA和kD分别是正向和逆向反应的速率常数。37°C,反应达平衡时测得的一组实验数据如图所示。
MbO2(aq)(a)其中,kA和kD分别是正向和逆向反应的速率常数。37°C,反应达平衡时测得的一组实验数据如图所示。
(1)计算37°C下反应(a)的平衡常数K
(2)导出平衡时结合度(α)随氧分压变化的表达式
(3)研究发现,正向反应速率v正=kA(Mb)P(O2);逆向反应速率v逆=kD(MbO2)。已知kD=60s-1,计算速率常数kA=
II.Mb含有一个Fe(II),呈顺磁性,与O2结合后形成的MbO2是抗磁性的。MbO2中的铁周围的配位场可近似为八面体场。
(4)这一过程中Fe(II)的价态是否发生改变
(5)写出MbO2中铁离子在八面体场中的价电子排布
(6)结合O2前后铁离子的半径是不变、变大还是变小
(7)O2分子呈顺磁性,它与Mb结合后,价电子排布是否发生变化
您最近一年使用:0次
7 . “绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(I)汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:
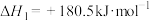

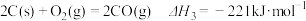
若某反应的平衡常数表达式为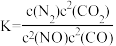 ,则此反应的热化学方程式为
,则此反应的热化学方程式为_______ 。
(2) 在一定条件下可发生分解:
在一定条件下可发生分解: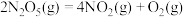 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是
进行该反应,能判断反应已达到化学平衡状态的是_____ (填字母)。
a. 和
和 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化
c.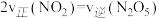 d. 气体的密度保持不变
d. 气体的密度保持不变
(Ⅱ)甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。 CO2(g) + 3H2(g) CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(3)将 和
和 按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成
按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成 ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下 转化率随温度的变化关系。
转化率随温度的变化关系。
①a、b两点化学反应速率分别用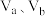 ,表示,则
,表示,则
_____  (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
②列出a点对应的平衡常数表达式K=____________________ 。
(4)在1.0 L恒容密闭容器中投入1 mol 和2.75 mol
和2.75 mol  发生反应:CO2(g) + 3H2(g)
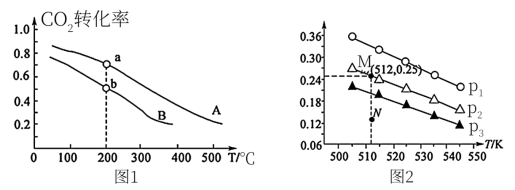
发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________ 。
A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为
D.在 及512 K时,图中N点
及512 K时,图中N点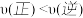
(5) 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)  C2H5OH(g) + 3H2O(g)
C2H5OH(g) + 3H2O(g)  ;m代表起始时的投料比,即
;m代表起始时的投料比,即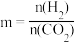 。
。
① 图3中投料比相同,温度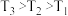 ,则该反应的焓变
,则该反应的焓变
_______ 0(填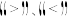 )。
)。
② m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________ (填化学式)。
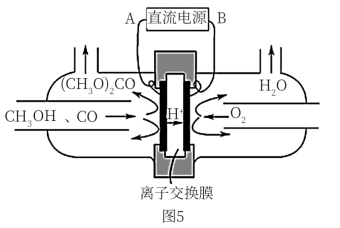
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。离子交换膜a为______ (填“阳膜”、“阴膜”),阳极的电极反应式为_______________________________________
(I)汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:


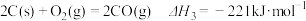
若某反应的平衡常数表达式为
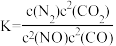 ,则此反应的热化学方程式为
,则此反应的热化学方程式为(2)
 在一定条件下可发生分解:
在一定条件下可发生分解: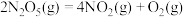 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是
进行该反应,能判断反应已达到化学平衡状态的是a.
 和
和 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化c.
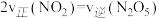 d. 气体的密度保持不变
d. 气体的密度保持不变(Ⅱ)甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。 CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g) (3)将
 和
和 按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成
按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成 ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下 转化率随温度的变化关系。
转化率随温度的变化关系。
①a、b两点化学反应速率分别用
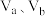 ,表示,则
,表示,则
 (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)②列出a点对应的平衡常数表达式K=
(4)在1.0 L恒容密闭容器中投入1 mol
 和2.75 mol
和2.75 mol  发生反应:CO2(g) + 3H2(g)
发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为

D.在
 及512 K时,图中N点
及512 K时,图中N点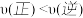

(5)
 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)  C2H5OH(g) + 3H2O(g)
C2H5OH(g) + 3H2O(g)  ;m代表起始时的投料比,即
;m代表起始时的投料比,即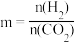 。
。① 图3中投料比相同,温度
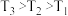 ,则该反应的焓变
,则该反应的焓变
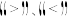 )。
)。② m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。离子交换膜a为

您最近一年使用:0次
8 . 合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1) 氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g) ΔH
N2(g)+3H2(g) ΔH
若:N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ·mol−1)则上述反应的ΔH=________ kJ·mol−1。
(2) 研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(mmol·min−1)。
①不同催化剂存在下,氨气分解反应活化能最大的是________ (填写催化剂的化学式)。
②温度为T,在一体积固定的密闭容器中加入2 mol NH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g) N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=
N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=________ 。[已知:气体分压(p分)=气体总压(p总)×体积分数]
(3) 关于合成氨工艺的理解,下列正确的是________ 。
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量苇
C.合成氨工业采用10 MPa~30 MPa,是因常压下N2和H2的转化率不高
D.采用冷水降温的方法可将合成后混合气体中的氨液化
(4) 在1 L 1 mol·L−1的盐酸中缓缓通入2 mol氨气,请在图中画出溶液中水电离出的OH−浓度随氨气通入变化的趋势图。______________________________

(5) 电化学法也可合成氨。下图是用低温固体质子导体作为电解质,用Pt−C3N4作阴极催化剂电解H2(g)和N2(g)合成NH3的原理示意图:

①Pt−C3N4电极反应产生NH3的电极反应式________ 。
②实验研究表明,当外加电压超过一定值以后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因________ 。
(1) 氨气分解反应的热化学方程式如下:2NH3(g)
 N2(g)+3H2(g) ΔH
N2(g)+3H2(g) ΔH若:N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ·mol−1)则上述反应的ΔH=
(2) 研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(mmol·min−1)。
| 催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
| 初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,氨气分解反应活化能最大的是
②温度为T,在一体积固定的密闭容器中加入2 mol NH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g)
 N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=
N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=(3) 关于合成氨工艺的理解,下列正确的是
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量苇
C.合成氨工业采用10 MPa~30 MPa,是因常压下N2和H2的转化率不高
D.采用冷水降温的方法可将合成后混合气体中的氨液化
(4) 在1 L 1 mol·L−1的盐酸中缓缓通入2 mol氨气,请在图中画出溶液中水电离出的OH−浓度随氨气通入变化的趋势图。

(5) 电化学法也可合成氨。下图是用低温固体质子导体作为电解质,用Pt−C3N4作阴极催化剂电解H2(g)和N2(g)合成NH3的原理示意图:

①Pt−C3N4电极反应产生NH3的电极反应式
②实验研究表明,当外加电压超过一定值以后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因
您最近一年使用:0次
2019-11-18更新
|
1194次组卷
|
4卷引用:本册综合检测(二)——2020-2021学年高二化学选修四同步单元AB卷(人教版)
(已下线)本册综合检测(二)——2020-2021学年高二化学选修四同步单元AB卷(人教版)浙江省宁波市2020年新高考选考适应性考试化学试题(已下线)【新东方】2020-23浙江省温州市环大罗山联盟2020-2021学年高二上学期期中考试化学试题
9 . 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为_______ 。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中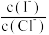 为:
为:_______ ,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) =H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_______ kJ。
(4)Bodensteins研究了下列反应:2HI(g)⇌H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
①根据上述实验结果,该反应的平衡常数K的计算式为:_______ 。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为_______ (以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=_______ min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_______ (填字母)

(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中
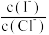 为:
为:(3)已知反应2HI(g) =H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为
(4)Bodensteins研究了下列反应:2HI(g)⇌H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为

您最近一年使用:0次
2019-01-30更新
|
7100次组卷
|
9卷引用:2015年全国普通高等学校招生统一考试化学(新课标I卷)



