1 .  (丙烯)是重要基本有机原料。
(丙烯)是重要基本有机原料。 (丙烷)催化脱氢制
(丙烷)催化脱氢制 过程如下:
过程如下:
Ⅰ.主反应: ;
;
Ⅱ.副反应: 。
。
回答下列问题:
(1)已知断裂 下列化学键所需能量如下表:
下列化学键所需能量如下表:
上述主反应的
___________  。
。
(2)一定条件下, 催化脱氢制
催化脱氢制 发生上述Ⅰ、Ⅱ反应,
发生上述Ⅰ、Ⅱ反应, 和
和 的平衡体积分数与温度、压强的关系如图1所示(图中压强分别为
的平衡体积分数与温度、压强的关系如图1所示(图中压强分别为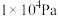 和
和 )。
)。 时,图中表示
时,图中表示 和
和 积分数变化的曲线分别为
积分数变化的曲线分别为___________ 、___________ 。
②提高 催化脱氢制
催化脱氢制 的反应平衡转化率的方法是
的反应平衡转化率的方法是___________ (任写一种)。
(3)在压力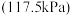 恒定,以
恒定,以 作为稀释气,不同水烃比
作为稀释气,不同水烃比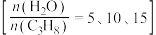 时,
时, 催化脱氢制备
催化脱氢制备 反应(上述反应Ⅰ、Ⅱ)平衡转化率随温度的变化曲线如图2所示。
反应(上述反应Ⅰ、Ⅱ)平衡转化率随温度的变化曲线如图2所示。 平衡转化率相同时,水烃比越高,对应的反应温度越
平衡转化率相同时,水烃比越高,对应的反应温度越___________ (填“高”或“低”)。
②相同温度下,水烃比远大于15:1时,丙烷的消耗速率明显下降,可能的原因是:
ⅰ.丙烷的浓度过低;
ⅱ.___________ 。
③M点对应条件下,若 的选择性为
的选择性为 ,则反应Ⅰ的分压平衡常数
,则反应Ⅰ的分压平衡常数 为
为___________ kPa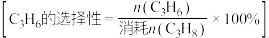 。
。
(4)利用 的弱氧化性,科研人员开发了
的弱氧化性,科研人员开发了 氧化脱氢制
氧化脱氢制 的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图3所示。
的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图3所示。___________ 。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是___________ 。
(5)研究表明, 氧化脱氢制
氧化脱氢制 的催化剂中含有多种元素,如Cr、Zr、Mg、Fe、Ni等。由Mg、Fe、Ni组成的
的催化剂中含有多种元素,如Cr、Zr、Mg、Fe、Ni等。由Mg、Fe、Ni组成的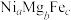 的立方晶胞结构如图4所示。已知晶胞的边长为
的立方晶胞结构如图4所示。已知晶胞的边长为 ,设
,设 为阿伏加德罗常数的值。该晶体密度是
为阿伏加德罗常数的值。该晶体密度是___________  (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
 (丙烯)是重要基本有机原料。
(丙烯)是重要基本有机原料。 (丙烷)催化脱氢制
(丙烷)催化脱氢制 过程如下:
过程如下:Ⅰ.主反应:
 ;
;Ⅱ.副反应:
 。
。回答下列问题:
(1)已知断裂
 下列化学键所需能量如下表:
下列化学键所需能量如下表:| 化学键 |  |  |  |
能量 | 436.0 | 413.4 | 344.7 |

 。
。(2)一定条件下,
 催化脱氢制
催化脱氢制 发生上述Ⅰ、Ⅱ反应,
发生上述Ⅰ、Ⅱ反应, 和
和 的平衡体积分数与温度、压强的关系如图1所示(图中压强分别为
的平衡体积分数与温度、压强的关系如图1所示(图中压强分别为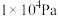 和
和 )。
)。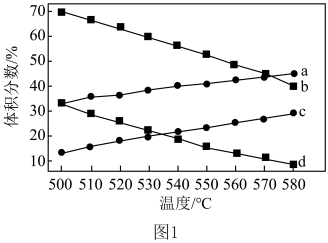
 时,图中表示
时,图中表示 和
和 积分数变化的曲线分别为
积分数变化的曲线分别为②提高
 催化脱氢制
催化脱氢制 的反应平衡转化率的方法是
的反应平衡转化率的方法是(3)在压力
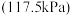 恒定,以
恒定,以 作为稀释气,不同水烃比
作为稀释气,不同水烃比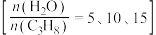 时,
时, 催化脱氢制备
催化脱氢制备 反应(上述反应Ⅰ、Ⅱ)平衡转化率随温度的变化曲线如图2所示。
反应(上述反应Ⅰ、Ⅱ)平衡转化率随温度的变化曲线如图2所示。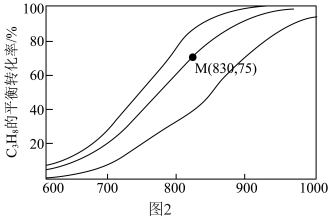
 平衡转化率相同时,水烃比越高,对应的反应温度越
平衡转化率相同时,水烃比越高,对应的反应温度越②相同温度下,水烃比远大于15:1时,丙烷的消耗速率明显下降,可能的原因是:
ⅰ.丙烷的浓度过低;
ⅱ.
③M点对应条件下,若
 的选择性为
的选择性为 ,则反应Ⅰ的分压平衡常数
,则反应Ⅰ的分压平衡常数 为
为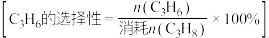 。
。(4)利用
 的弱氧化性,科研人员开发了
的弱氧化性,科研人员开发了 氧化脱氢制
氧化脱氢制 的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图3所示。
的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图3所示。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是
(5)研究表明,
 氧化脱氢制
氧化脱氢制 的催化剂中含有多种元素,如Cr、Zr、Mg、Fe、Ni等。由Mg、Fe、Ni组成的
的催化剂中含有多种元素,如Cr、Zr、Mg、Fe、Ni等。由Mg、Fe、Ni组成的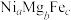 的立方晶胞结构如图4所示。已知晶胞的边长为
的立方晶胞结构如图4所示。已知晶胞的边长为 ,设
,设 为阿伏加德罗常数的值。该晶体密度是
为阿伏加德罗常数的值。该晶体密度是 (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024高三·全国·专题练习
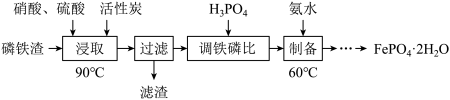
2 . 工业上用磷铁渣(主要含FeP、Fe2P,以及少量Fe2O3、SiO2等杂质)制备磷酸铁的工艺流程如下图。已知:①在密闭的反应釜中,硝酸首先分解生成NO2和O2,O2进一步将磷铁渣中的FeP、Fe2P氧化成Fe2O3和P2O5,继而生成Fe(NO3)3和H3PO4;②FePO4难溶于水,可溶于无机强酸。___________ 。
(2)“浸取”时Fe2P与O2反应的化学方程式为___________ 。
(3)“浸取”时设定反应时间为2h,不同硝酸浓度下磷铁渣的溶解率如图1所示,当硝酸浓度在1.5~2.0mol·L-1时,磷铁渣溶解率呈现降低的趋势,其原因是___________ 。___________ ;“制备”过程中溶液的pH对磷酸铁产品中铁和磷的含量及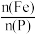 比值的影响如图2所示[考虑到微量金属杂质,在pH=1时,
比值的影响如图2所示[考虑到微量金属杂质,在pH=1时,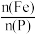 为0.973最接近理论值]。在pH范围为1~1.5时,随着pH增大,
为0.973最接近理论值]。在pH范围为1~1.5时,随着pH增大,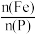 明显增大,其原因是
明显增大,其原因是___________ 。 )为
)为___________ mol·L-1[已知:Ksp(FePO4)=1.3×10-22]。
(2)“浸取”时Fe2P与O2反应的化学方程式为
(3)“浸取”时设定反应时间为2h,不同硝酸浓度下磷铁渣的溶解率如图1所示,当硝酸浓度在1.5~2.0mol·L-1时,磷铁渣溶解率呈现降低的趋势,其原因是

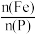 比值的影响如图2所示[考虑到微量金属杂质,在pH=1时,
比值的影响如图2所示[考虑到微量金属杂质,在pH=1时,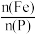 为0.973最接近理论值]。在pH范围为1~1.5时,随着pH增大,
为0.973最接近理论值]。在pH范围为1~1.5时,随着pH增大,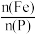 明显增大,其原因是
明显增大,其原因是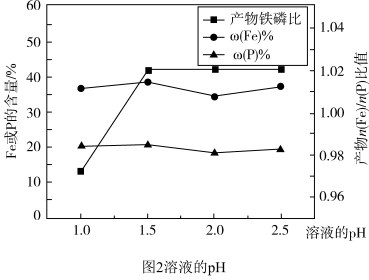
 )为
)为
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
3 . 二甲醚是重要的有机合成原料,工业上常用合成气(主要成分为CO、H2)制备二甲醚,其主要反应如下。
反应ⅰ:CO(g)+2H2(g) CH3OH(g);
CH3OH(g);
反应ⅱ:2CH3OH(g) CH3OCH3(g)+H2O(g);
CH3OCH3(g)+H2O(g);
反应ⅲ:CO(g)+H2O(g) CO2(g)+H2(g)。
CO2(g)+H2(g)。
(1)一定温度下,在体积为2 L的刚性容器中充入4 mol CO(g)和8 mol H2(g)制备二甲醚,4 min时达到平衡,平衡时CO(g)的转化率为80%,c(H2)=1.4 mol·L-1,且c(CH3OH)=2c(CH3OCH3)。反应ⅲ的平衡常数Kc=_______ (保留三位有效数字)。
(2)实际工业生产中,需要在260 ℃、压强恒为4.0 MPa的反应釜中进行上述反应。初始时向反应釜中加入0.01 mol CO(g)和0.02 mol H2(g),为确保反应的连续性,需向反应釜中以n(CO)∶n(H2)=1∶2、进气流量0.03 mol·min-1持续通入原料,同时控制出气流量。①已知出气流量为0.02 mol·min-1,单位时间内CO(g)的转化率为60%,则流出气体中CO2(g)的百分含量为_______ 。②需控制出气流量小于进气流量的原因为_______ 。
(3)在ZnxO催化剂的作用下发生反应ⅰ,其可能反应机理如下图所示。______________ 。
②在合成甲醇过程中,需要不断分离出甲醇的原因为_______ 。
反应ⅰ:CO(g)+2H2(g)
 CH3OH(g);
CH3OH(g);反应ⅱ:2CH3OH(g)
 CH3OCH3(g)+H2O(g);
CH3OCH3(g)+H2O(g);反应ⅲ:CO(g)+H2O(g)
 CO2(g)+H2(g)。
CO2(g)+H2(g)。(1)一定温度下,在体积为2 L的刚性容器中充入4 mol CO(g)和8 mol H2(g)制备二甲醚,4 min时达到平衡,平衡时CO(g)的转化率为80%,c(H2)=1.4 mol·L-1,且c(CH3OH)=2c(CH3OCH3)。反应ⅲ的平衡常数Kc=
(2)实际工业生产中,需要在260 ℃、压强恒为4.0 MPa的反应釜中进行上述反应。初始时向反应釜中加入0.01 mol CO(g)和0.02 mol H2(g),为确保反应的连续性,需向反应釜中以n(CO)∶n(H2)=1∶2、进气流量0.03 mol·min-1持续通入原料,同时控制出气流量。①已知出气流量为0.02 mol·min-1,单位时间内CO(g)的转化率为60%,则流出气体中CO2(g)的百分含量为
(3)在ZnxO催化剂的作用下发生反应ⅰ,其可能反应机理如下图所示。
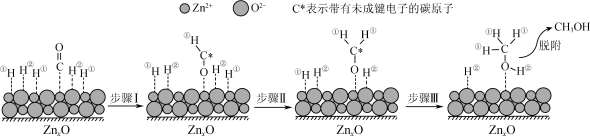
②在合成甲醇过程中,需要不断分离出甲醇的原因为
您最近一年使用:0次
2024·湖南常德·一模
4 . 在 ℃,
℃,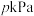 下,向1L的密闭容器中充入1mol
下,向1L的密闭容器中充入1mol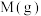 和一定物质的量的
和一定物质的量的 发生反应:
发生反应: ,平衡时
,平衡时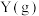 的物质的量分数与初始投料比
的物质的量分数与初始投料比 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
 ℃,
℃,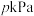 下,向1L的密闭容器中充入1mol
下,向1L的密闭容器中充入1mol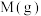 和一定物质的量的
和一定物质的量的 发生反应:
发生反应: ,平衡时
,平衡时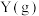 的物质的量分数与初始投料比
的物质的量分数与初始投料比 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
A.随着 的增大, 的增大,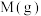 的转化率逐渐增大 的转化率逐渐增大 |
B.e点: |
C.a点时,该反应的平衡常数为 |
D.a点,平衡后再投入1mol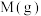 和1mol 和1mol ,达到新平衡时, ,达到新平衡时,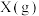 的产率增大 的产率增大 |
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
5 . 天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物 (L为配体)溶于弱碱性的海水中,制成吸收液,将气体
(L为配体)溶于弱碱性的海水中,制成吸收液,将气体 转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①
转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:① 的吸收氧化;②
的吸收氧化;② 的再生。反应原理如下:
的再生。反应原理如下:
①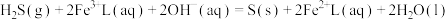

②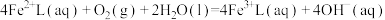
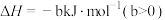
回答下列问题:
(1) 的电离方程式为
的电离方程式为___________ 。25℃时, 溶液中
溶液中 、
、 、
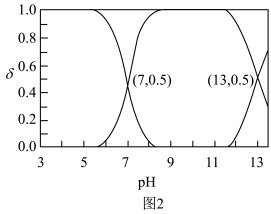
、 在含硫粒子总浓度中所占分数
在含硫粒子总浓度中所占分数 随溶液pH的变化关系如图2,由图2计算,
随溶液pH的变化关系如图2,由图2计算, 的
的
___________ ,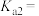
___________ 。再生反应在常温下进行,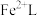 解离出的
解离出的 易与溶液中的
易与溶液中的 形成沉淀。若溶液中的
形成沉淀。若溶液中的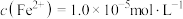 ,
,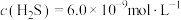 ,为避免有FeS沉淀生成,应控制溶液pH不大于
,为避免有FeS沉淀生成,应控制溶液pH不大于___________ (已知25℃时,FeS的 为
为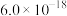 )。
)。
 (L为配体)溶于弱碱性的海水中,制成吸收液,将气体
(L为配体)溶于弱碱性的海水中,制成吸收液,将气体 转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①
转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:① 的吸收氧化;②
的吸收氧化;② 的再生。反应原理如下:
的再生。反应原理如下:①
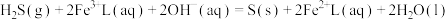

②
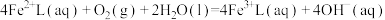
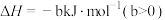
回答下列问题:
(1)
 的电离方程式为
的电离方程式为 溶液中
溶液中 、
、 、
、 在含硫粒子总浓度中所占分数
在含硫粒子总浓度中所占分数 随溶液pH的变化关系如图2,由图2计算,
随溶液pH的变化关系如图2,由图2计算, 的
的
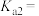
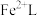 解离出的
解离出的 易与溶液中的
易与溶液中的 形成沉淀。若溶液中的
形成沉淀。若溶液中的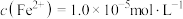 ,
,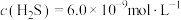 ,为避免有FeS沉淀生成,应控制溶液pH不大于
,为避免有FeS沉淀生成,应控制溶液pH不大于 为
为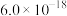 )。
)。
您最近一年使用:0次
2024高三下·全国·专题练习
6 . 丙烯是三大合成材料的基本原料之一,可用于生产多种重要有机化工原料。由丙烷制丙烯的两种方法如下:
I.丙烷无氧脱氢法:
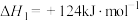
II.丙烷氧化脱氢法: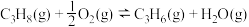

请回答下列问题:
(1)对于反应I,下列条件有利于提高 的平衡转化率的是___________(填字母)
的平衡转化率的是___________(填字母)
(2)某温度下,在刚性密闭容器中充入 发生反应I,起始压强为
发生反应I,起始压强为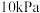 ,平衡时总压强为
,平衡时总压强为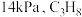 的平衡转化率为
的平衡转化率为___________ 。
(3)一定压强下,向密闭容器中充入一定量的 和
和 ,发生反应
,发生反应
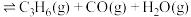 ,
, 的平衡转化率在不同投料比
的平衡转化率在不同投料比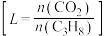 下与温度的关系如图所示,投料比L由小到大的顺序为
下与温度的关系如图所示,投料比L由小到大的顺序为___________ ,判断依据是___________ 。 等副产物,在催化剂的作用下,
等副产物,在催化剂的作用下, 的转化率和
的转化率和 的产率随温度的变化关系如图所示,
的产率随温度的变化关系如图所示, 的选择性:550℃
的选择性:550℃___________ 575℃(填“>”或“<”)。
I.丙烷无氧脱氢法:

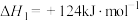
II.丙烷氧化脱氢法:
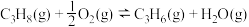

请回答下列问题:
(1)对于反应I,下列条件有利于提高
 的平衡转化率的是___________(填字母)
的平衡转化率的是___________(填字母)| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
 发生反应I,起始压强为
发生反应I,起始压强为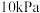 ,平衡时总压强为
,平衡时总压强为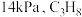 的平衡转化率为
的平衡转化率为(3)一定压强下,向密闭容器中充入一定量的
 和
和 ,发生反应
,发生反应
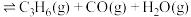 ,
, 的平衡转化率在不同投料比
的平衡转化率在不同投料比 下与温度的关系如图所示,投料比L由小到大的顺序为
下与温度的关系如图所示,投料比L由小到大的顺序为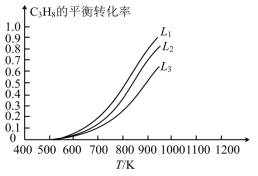
 等副产物,在催化剂的作用下,
等副产物,在催化剂的作用下, 的转化率和
的转化率和 的产率随温度的变化关系如图所示,
的产率随温度的变化关系如图所示, 的选择性:550℃
的选择性:550℃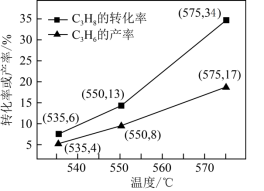
您最近一年使用:0次
2024高三下·全国·专题练习
7 . (2024·吉林·模拟预测)氢能是一种重要的绿色能源,在实现“碳中和”与“碳达峰”目标中起到重要作用。乙醇与水催化重整制氢发生以下反应:
反应I: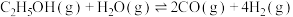

反应Ⅱ:

反应Ⅲ:
回答下列问题:
(1)压强为100 下,1
下,1
 和3
和3
 发生上述反应,平衡时
发生上述反应,平衡时 和
和 的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知:
的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知: 的选择性
的选择性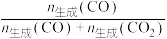 ]
]
___________  。
。
②表示 选择性的曲线是
选择性的曲线是___________ (填标号)。
③573K时,反应Ⅱ的
___________ (保留到小数点后两位)。
反应I:
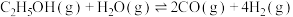

反应Ⅱ:


反应Ⅲ:

回答下列问题:
(1)压强为100
 下,1
下,1
 和3
和3
 发生上述反应,平衡时
发生上述反应,平衡时 和
和 的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知:
的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知: 的选择性
的选择性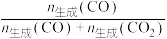 ]
]
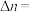
 。
。②表示
 选择性的曲线是
选择性的曲线是③573K时,反应Ⅱ的

您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
8 . 用甲烷制高纯氢气是目前研究热点之一、
(1)工业上常利用甲烷与水蒸气重整制氢,涉及热化学反应方程式如下:
I.

II.

②为提高CH4的平衡转化率,可采取的措施有___________ (写一条)。
③已知830℃时,反应II的平衡常数 。在容积不变的密闭容器中,将
。在容积不变的密闭容器中,将 与
与 加热到830℃,反应达平衡时CO的转化率为
加热到830℃,反应达平衡时CO的转化率为___________ 。
④在常压、600℃条件下,甲烷与水蒸气制备氢气的总反应中H2平衡产率为82%。若加入适量生石灰后H2的产率可提高到95%。应用化学平衡移动原理解释原因___________ 。
(2)利用甲烷与CO2重整制氢的热化学反应方程式如下:
III.
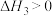 (主反应)
(主反应)
IV.
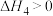 (副反应)
(副反应)
①在恒压条件下,等物质的量的CH4和CO2发生重整反应时,各物质的平衡转化率随温度变化如图所示,则表示CO2平衡转化率的是曲线___________ (填“A”或“B”)。
(1)工业上常利用甲烷与水蒸气重整制氢,涉及热化学反应方程式如下:
I.


II.


②为提高CH4的平衡转化率,可采取的措施有
③已知830℃时,反应II的平衡常数
 。在容积不变的密闭容器中,将
。在容积不变的密闭容器中,将 与
与 加热到830℃,反应达平衡时CO的转化率为
加热到830℃,反应达平衡时CO的转化率为④在常压、600℃条件下,甲烷与水蒸气制备氢气的总反应中H2平衡产率为82%。若加入适量生石灰后H2的产率可提高到95%。应用化学平衡移动原理解释原因
(2)利用甲烷与CO2重整制氢的热化学反应方程式如下:
III.

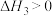 (主反应)
(主反应)IV.

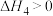 (副反应)
(副反应)①在恒压条件下,等物质的量的CH4和CO2发生重整反应时,各物质的平衡转化率随温度变化如图所示,则表示CO2平衡转化率的是曲线

您最近一年使用:0次
2024高三下·全国·专题练习
9 . 在“碳达峰”“碳中和”的发展背景下, 催化加氢合成甲醇是重要的碳捕获利用与封
催化加氢合成甲醇是重要的碳捕获利用与封
存技术,该过程主要发生下列反应:
反应①

反应②

回答下列问题:
(1)①现向2L恒容密闭容器中加入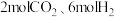 ,在恒温下发生上述反应。10s后反应达到平衡,此时容器内
,在恒温下发生上述反应。10s后反应达到平衡,此时容器内 的浓度为
的浓度为 ,CO为
,CO为 。则前10s内的平均反应速率
。则前10s内的平均反应速率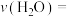
___________ 。
(2)0.5MPa下,将 的混合气体以一定流速通过装有催化剂的反应器,测得
的混合气体以一定流速通过装有催化剂的反应器,测得 的转化率、
的转化率、 或CO的选择性[
或CO的选择性[ ]以及
]以及 的产率(
的产率( 的转化率×
的转化率× 的选择性)随温度的变化如图2所示。
的选择性)随温度的变化如图2所示。___________ (填“ ”或“CO”)的选择性随温度的变化,270℃时,对应
”或“CO”)的选择性随温度的变化,270℃时,对应 的转化率为
的转化率为___________ ;在210~250℃之间, 的产率增大的原因是
的产率增大的原因是___________ 。
 催化加氢合成甲醇是重要的碳捕获利用与封
催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生下列反应:
反应①


反应②


回答下列问题:
(1)①现向2L恒容密闭容器中加入
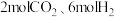 ,在恒温下发生上述反应。10s后反应达到平衡,此时容器内
,在恒温下发生上述反应。10s后反应达到平衡,此时容器内 的浓度为
的浓度为 ,CO为
,CO为 。则前10s内的平均反应速率
。则前10s内的平均反应速率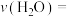
(2)0.5MPa下,将
 的混合气体以一定流速通过装有催化剂的反应器,测得
的混合气体以一定流速通过装有催化剂的反应器,测得 的转化率、
的转化率、 或CO的选择性[
或CO的选择性[ ]以及
]以及 的产率(
的产率( 的转化率×
的转化率× 的选择性)随温度的变化如图2所示。
的选择性)随温度的变化如图2所示。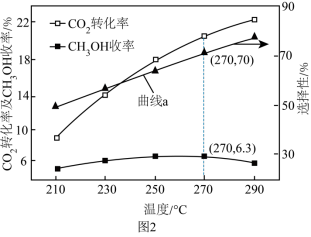
 ”或“CO”)的选择性随温度的变化,270℃时,对应
”或“CO”)的选择性随温度的变化,270℃时,对应 的转化率为
的转化率为 的产率增大的原因是
的产率增大的原因是
您最近一年使用:0次
2024高三下·全国·专题练习
10 . 某科研团队利用 和
和 反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
(1) 均为
均为 的恒容密闭容器,向
的恒容密闭容器,向 容器中充入
容器中充入 和
和 ,向
,向 容器中充入
容器中充入 和
和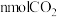 ,在催化剂存在下发生反应:
,在催化剂存在下发生反应: ,测得
,测得 的平衡转化率随温度的变化如图甲所示。
的平衡转化率随温度的变化如图甲所示。 容器中在温度为
容器中在温度为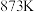 时,
时, 到达
到达 点,用
点,用 表示
表示 内的化学反应速率为
内的化学反应速率为
___________ ,此时的化学平衡常数 为
为___________ (保留两位小数),若在此温度下时向 容器的平衡体系中再充入
容器的平衡体系中再充入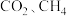 各
各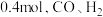 各
各 ,重新达到平衡前,
,重新达到平衡前,
___________  (填“
(填“ “
“ ”或
”或 )。
)。
② 点时该反应的平衡常数为
点时该反应的平衡常数为 ,则
,则
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③ 两点处容器内气体总压强分别是
两点处容器内气体总压强分别是 ,则
,则 的大小顺序为
的大小顺序为___________ 。
 和
和 反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:(1)
 均为
均为 的恒容密闭容器,向
的恒容密闭容器,向 容器中充入
容器中充入 和
和 ,向
,向 容器中充入
容器中充入 和
和 ,在催化剂存在下发生反应:
,在催化剂存在下发生反应: ,测得
,测得 的平衡转化率随温度的变化如图甲所示。
的平衡转化率随温度的变化如图甲所示。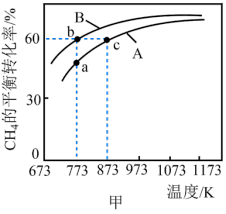
 容器中在温度为
容器中在温度为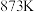 时,
时, 到达
到达 点,用
点,用 表示
表示 内的化学反应速率为
内的化学反应速率为
 为
为 容器的平衡体系中再充入
容器的平衡体系中再充入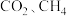 各
各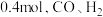 各
各 ,重新达到平衡前,
,重新达到平衡前,
 (填“
(填“ “
“ ”或
”或 )。
)。②
 点时该反应的平衡常数为
点时该反应的平衡常数为 ,则
,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③
 两点处容器内气体总压强分别是
两点处容器内气体总压强分别是 ,则
,则 的大小顺序为
的大小顺序为
您最近一年使用:0次



