解题方法
1 . 回答下列问题。
(1)已知可逆反应: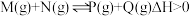 ,请回答下列问题:
,请回答下列问题:
①在某温度下,反应物的起始浓度分别为: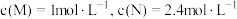 ;达到平衡后,M的转化率为
;达到平衡后,M的转化率为 ,此时N的转化率为
,此时N的转化率为_______ ;平衡常数是多少?(写出计算过程)
②若反应温度升高,M的转化率_______ (填“增大”“减小”或“不变”;)
③若反应温度不变,反应物的起始浓度分别为: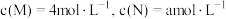 ;达到平衡后,
;达到平衡后,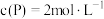 ,则
,则
_______ ;
(2)用酸性 溶液与
溶液与 溶液反应来探究“外界条件对化学反应速率的影响”。
溶液反应来探究“外界条件对化学反应速率的影响”。
实验前先用酸性 标准溶液滴定未知浓度的草酸。
标准溶液滴定未知浓度的草酸。
反应原理: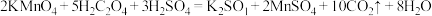 。
。
实验操作:取 待测
待测 溶液放入锥形瓶中,用
溶液放入锥形瓶中,用 酸性
酸性 标准溶液进行滴定。重复上述滴定操作2~3次,并记录数据。
标准溶液进行滴定。重复上述滴定操作2~3次,并记录数据。
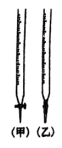
①滴定时,用_______ 滴定管盛装标准酸性 溶液(填“甲”或“乙”滴定终点的现象为
溶液(填“甲”或“乙”滴定终点的现象为_______ 。
②实验时记录的实验数据如下,试计算所测 溶液的浓度为
溶液的浓度为_______  。
。
(1)已知可逆反应:
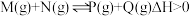 ,请回答下列问题:
,请回答下列问题:①在某温度下,反应物的起始浓度分别为:
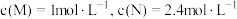 ;达到平衡后,M的转化率为
;达到平衡后,M的转化率为 ,此时N的转化率为
,此时N的转化率为②若反应温度升高,M的转化率
③若反应温度不变,反应物的起始浓度分别为:
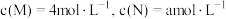 ;达到平衡后,
;达到平衡后,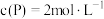 ,则
,则
(2)用酸性
 溶液与
溶液与 溶液反应来探究“外界条件对化学反应速率的影响”。
溶液反应来探究“外界条件对化学反应速率的影响”。实验前先用酸性
 标准溶液滴定未知浓度的草酸。
标准溶液滴定未知浓度的草酸。反应原理:
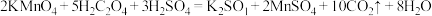 。
。实验操作:取
 待测
待测 溶液放入锥形瓶中,用
溶液放入锥形瓶中,用 酸性
酸性 标准溶液进行滴定。重复上述滴定操作2~3次,并记录数据。
标准溶液进行滴定。重复上述滴定操作2~3次,并记录数据。
①滴定时,用
 溶液(填“甲”或“乙”滴定终点的现象为
溶液(填“甲”或“乙”滴定终点的现象为②实验时记录的实验数据如下,试计算所测
 溶液的浓度为
溶液的浓度为 。
。| 实验次数编号 | 待测液体积 | 滴入的标准液体积 |
| 1 | 20.00 | 16.05 |
| 2 | 20.00 | 15.95 |
| 3 | 20.00 | 16.00 |
您最近一年使用:0次
23-24高二上·全国·期中
解题方法
2 . 已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g) CH3OCH3(g)+H2O(g)△H=23.5kJ•mol﹣1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。请回答下列问题:
CH3OCH3(g)+H2O(g)△H=23.5kJ•mol﹣1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。请回答下列问题:
(1)该条件下反应平衡常数表达式K=___________ ,在T1℃时,该反应的平衡常数为___________ ,达到平衡时n(CH3OH):n(CH3OCH3):n(H2O)=___________ 。
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4mol•L﹣1、c(H2O)=0.6mol•L﹣1、c(CH3OCH3)=1.2mol•L﹣1,此时正、逆反应速率的大小:v (正)___________ v (逆)(填“>”、“<”或“=”),反应向___________ 进行(填“正反应方向”或“逆反应方向”)。

 CH3OCH3(g)+H2O(g)△H=23.5kJ•mol﹣1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。请回答下列问题:
CH3OCH3(g)+H2O(g)△H=23.5kJ•mol﹣1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。请回答下列问题:(1)该条件下反应平衡常数表达式K=
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4mol•L﹣1、c(H2O)=0.6mol•L﹣1、c(CH3OCH3)=1.2mol•L﹣1,此时正、逆反应速率的大小:v (正)

您最近一年使用:0次
名校
3 . 某温度下,向2L恒容密闭容器中充入等物质的量浓度的X(g)和Y(g),同时发生以下两个反应:① ,②
,② 。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示{已知:Z(g)的选择性
。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示{已知:Z(g)的选择性 。下列说法正确的是
。下列说法正确的是
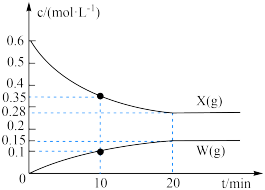
 ,②
,② 。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示{已知:Z(g)的选择性
。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示{已知:Z(g)的选择性 。下列说法正确的是
。下列说法正确的是
A.0~10min内,Y(g)的平均反应速率为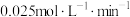 |
| B.相比反应②,反应①的Z(g)的选择性更高 |
C.平衡时,反应①的平衡常数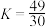 |
| D.当容器内气体的密度不变时,说明反应达到了平衡状态 |
您最近一年使用:0次
2023-07-23更新
|
160次组卷
|
4卷引用:期中考试模拟试题(二)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
(已下线)期中考试模拟试题(二)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)辽宁省葫芦岛市协作校2022-2023学年高二上学期期中考试化学试题广东省广州市铁一中学2023-2024学年高二上学期10月月考化学试题贵州省毕节市金沙县2022-2023学年高二上学期12月月考化学试题
名校
解题方法
4 . 为加快实现“双碳”目标,有效应对全球气候变化、构建低碳社会,CO2资源化利用受到越来越多的关注。
I.利用CO2与CH4制备合成气CO、H2的反应历程如下:
第一步:CH4(g)+CO2(g)→C(ads)+2H2(g)+CO2(g) ΔH1=E1kJ·mol-1;
第二步:C(ads)+2H2(g)+CO2(g)→2CO(g)+2H2(g) ΔH2=E2kJ·mol-1;
说明:ads为吸附型催化剂。
(1)制备合成气总反应的反应热ΔH=___________ kJ·mol-1;
(2)一定条件下ads对CO2也有吸附作用。结合下图分析ads吸附CO2的适宜条件是___________ 。

(3)由甲烷生成乙烷的反应如下:2CH4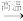 C2H6+H2。在不同反应物浓度时,该反应的反应速率如下表所示:
C2H6+H2。在不同反应物浓度时,该反应的反应速率如下表所示:
该反应的速率方程为:v=___________ mol·L-1·min-1[用含c(CH4)的代数式表示]。
Ⅱ.CO2在固体催化剂表面加氢合成甲烷过程中发生如下反应:
反应1:CO2(g)+4H2(g) CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应2:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
(4)已知温度为T时,向0.5L恒容密闭容器中充入2molCO2和6molH2,一段时间后达到平衡,测得体系中生成2.5molH2O,压强变为原来的75%,反应1的平衡常数K=___________ (用分数表示),CH4选择性=___________ (CH4选择性= ,保留三位有效数字)。
,保留三位有效数字)。
I.利用CO2与CH4制备合成气CO、H2的反应历程如下:
第一步:CH4(g)+CO2(g)→C(ads)+2H2(g)+CO2(g) ΔH1=E1kJ·mol-1;
第二步:C(ads)+2H2(g)+CO2(g)→2CO(g)+2H2(g) ΔH2=E2kJ·mol-1;
说明:ads为吸附型催化剂。
(1)制备合成气总反应的反应热ΔH=
(2)一定条件下ads对CO2也有吸附作用。结合下图分析ads吸附CO2的适宜条件是

(3)由甲烷生成乙烷的反应如下:2CH4
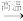 C2H6+H2。在不同反应物浓度时,该反应的反应速率如下表所示:
C2H6+H2。在不同反应物浓度时,该反应的反应速率如下表所示:| 实验编号 | 1 | 2 | 3 | 4 |
| c(CH4)/(mol·L-1) | 0.1000 | 0.2000 | 0.3000 | 0.4000 |
| v/(mol·L-1·min-1) | 0.0076 | 0.0153 | 0.0227 | 0.0306 |
Ⅱ.CO2在固体催化剂表面加氢合成甲烷过程中发生如下反应:
反应1:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)反应2:CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)(4)已知温度为T时,向0.5L恒容密闭容器中充入2molCO2和6molH2,一段时间后达到平衡,测得体系中生成2.5molH2O,压强变为原来的75%,反应1的平衡常数K=
 ,保留三位有效数字)。
,保留三位有效数字)。
您最近一年使用:0次
名校
5 . 化学科学家采用丙烯歧化法制取乙烯和丁烯的反应原理为
 。向恒温
。向恒温 反应器中加入一定量的
反应器中加入一定量的 ,生成
,生成 的物质的量与时间的关系如表所示:
的物质的量与时间的关系如表所示:
(1)
___________ ;容器初始压强为p0 KPa;平衡压强=___________ KPa。 内
内 的平均反应速率为
的平均反应速率为___________ 。
(2)该条件下,任写一个能说明上述反应达到化学平衡状态的证据___________ 。
(3)将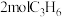 置于体积为
置于体积为 恒容反应器,反应进行
恒容反应器,反应进行 时丙烯的转化率与温度的关系如图:
时丙烯的转化率与温度的关系如图:

①该反应的
___________ 0(填“>”或“<”)。
② 时
时
___________ (保留小数点后两位)。
③ 时若继续加入
时若继续加入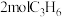 ,再次达到平衡后,乙烯体积分数为
,再次达到平衡后,乙烯体积分数为___________ 。

 。向恒温
。向恒温 反应器中加入一定量的
反应器中加入一定量的 ,生成
,生成 的物质的量与时间的关系如表所示:
的物质的量与时间的关系如表所示:| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
 的物质的量 的物质的量 | 0 | 0.8 | 1.2 | 1.5 |  | 1.5 |

 内
内 的平均反应速率为
的平均反应速率为(2)该条件下,任写一个能说明上述反应达到化学平衡状态的证据
(3)将
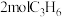 置于体积为
置于体积为 恒容反应器,反应进行
恒容反应器,反应进行 时丙烯的转化率与温度的关系如图:
时丙烯的转化率与温度的关系如图:
①该反应的

②
 时
时
③
 时若继续加入
时若继续加入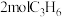 ,再次达到平衡后,乙烯体积分数为
,再次达到平衡后,乙烯体积分数为
您最近一年使用:0次
2023-06-05更新
|
145次组卷
|
3卷引用:专题05 影响化学平衡的因素【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
(已下线)专题05 影响化学平衡的因素【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1) 上海市第二中学2022-2023学年高二下学期5月阶段测试化学试题上海师范大学附属中学宝山分校2023-2024学年高二上学期12月阶段性测试 化学(等级)试题
解题方法
6 . 氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
(1)已知: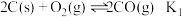

 (其中
(其中 、
、 、
、 为对应化学反应的平衡常数)
为对应化学反应的平衡常数)
①则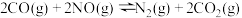 的平衡常数为K,则
的平衡常数为K,则
_______ (用 、
、 、
、 表示)。
表示)。
②在一个恒温恒容的密闭容器中发生反应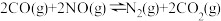 。能表明反应已达到平衡状态的标志有
。能表明反应已达到平衡状态的标志有_______ (填字母)。
A.混合气体的压强保持不变 B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变 D.气体的总质量保持不变
E.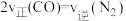 F.
F. 内生成
内生成 同时消耗
同时消耗
(2)向容积为 的密闭容器中加入活性炭(足量)和
的密闭容器中加入活性炭(足量)和 ,发生反应
,发生反应 ,
, 和
和 的物质的量变化如表所示。
的物质的量变化如表所示。
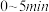 内,以
内,以 表示的平均反应速率
表示的平均反应速率
_______ ,最终达平衡时 的浓度
的浓度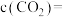
_______ ,平衡时 的转化率
的转化率
_______ ,写出该反应平衡常数的表达式
_______ ,并求该温度 下的平衡常数
下的平衡常数
_______ 。
(1)已知:
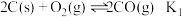

 (其中
(其中 、
、 、
、 为对应化学反应的平衡常数)
为对应化学反应的平衡常数)①则
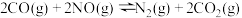 的平衡常数为K,则
的平衡常数为K,则
 、
、 、
、 表示)。
表示)。②在一个恒温恒容的密闭容器中发生反应
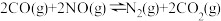 。能表明反应已达到平衡状态的标志有
。能表明反应已达到平衡状态的标志有A.混合气体的压强保持不变 B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变 D.气体的总质量保持不变
E.
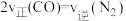 F.
F. 内生成
内生成 同时消耗
同时消耗
(2)向容积为
 的密闭容器中加入活性炭(足量)和
的密闭容器中加入活性炭(足量)和 ,发生反应
,发生反应 ,
, 和
和 的物质的量变化如表所示。
的物质的量变化如表所示。| 条件 | 保持温度为 | ||||||
时间/ | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
物质的量/ | 2.0 | 1.4 | 1.0 | 0.70 | 0.50 | 0.40 | 0.40 |
物质的量/ | 0 | 0.30 | 0.50 | 0.65 | 0.75 | 0.80 | 0.80 |
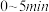 内,以
内,以 表示的平均反应速率
表示的平均反应速率
 的浓度
的浓度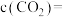
 的转化率
的转化率

 下的平衡常数
下的平衡常数
您最近一年使用:0次
2023-02-18更新
|
135次组卷
|
3卷引用:福建省福州市三校2022-2023学年高二上学期期中联考化学试题
福建省福州市三校2022-2023学年高二上学期期中联考化学试题(已下线)专题04 可逆反应、化学平衡状态、化学平衡常数【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)广西北海市2022-2023学年高二上学期期末考试化学试题
7 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则平衡时c(N2)=
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则平衡时c(N2)=____ 。平衡时H2的转化率为____ %。平衡时NH3的体积分数是____ 。
(2)平衡后,若提高H2的转化率,可以采取的措施有____ 。(填写序号)
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示。请完成下列问题:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示。请完成下列问题:
①写出化学平衡常数K的表达式____ 。
②试比较K1、K2的大小,K1____ K2(填“>”“<”或“=”);
③400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为____ 。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和1 mol时,则该反应的v(N2正)____ v(N2逆)(填“>”“<”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是____ 。(填写序号)
(1)若在一容积为2L的密闭容器中加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则平衡时c(N2)=
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则平衡时c(N2)=(2)平衡后,若提高H2的转化率,可以采取的措施有
| A.加了催化剂 | B.增大容器体积 |
| C.降低反应体系的温度 | D.加入一定量N2 |
 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示。请完成下列问题:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示。请完成下列问题:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②试比较K1、K2的大小,K1
③400℃时,反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是
| A.化学反应速率理论可指导怎样在一定时间内快出产品 |
| B.勒夏特列原理可指导怎样使用有限原料多出产品 |
| C.催化剂的使用是提高产品产率的有效方法 |
| D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益 |
您最近一年使用:0次
名校
解题方法
8 . 将一定量纯净的X置于某10 L容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:X(s) 2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是
2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是
 2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是
2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是| 温度(oC) | 15.0 | 25.0 | 30.0 | 35.0 |
| K/(×10-8mol3·L-3) | 0.205 | 1.64 | 4.68 | 10.8 |
| A.该反应在高温下可能自发 |
| B.若气体密度不再随时间变化时表示反应达平衡状态 |
| C.若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大 |
| D.35℃时,达平衡时,X分解了0.02 mol |
您最近一年使用:0次
名校
解题方法
9 . 在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g)。
M(g)+N(g)。
下列说法正确的是
 M(g)+N(g)。
M(g)+N(g)。| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 800 | 0.10 | 0.15 | b |
| A.实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol/(L·min) |
| B.实验②中,该反应的平衡常数K=2.0 |
| C.实验③中,达到平衡时,Y的转化率为40% |
| D.实验④中,达到平衡时,b>0.06 |
您最近一年使用:0次
2021-09-26更新
|
665次组卷
|
6卷引用:必考点03 化学平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)
(已下线)必考点03 化学平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)四川省成都市郫都区2021-2022学年高二上学期期中考试化学试题河北深州市长江中学2021-2022学年高二上学期10月月考化学(理)试题广东省珠海市第一中学2021-2022学年高二上学期期中考试化学试题吉林省延边第二中学2021-2022学年高二上学期第一次阶段检测化学试题江西省九江市第一中学2021-2022学年高二上学期第一次月考化学试题
名校
10 . 在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
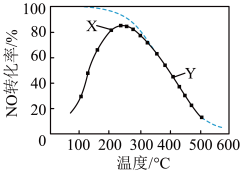

| A.反应2NO(g)+O2(g)=2NO2(g)的ΔH>0 |
| B.图中X点所示条件下,延长反应时间不能提高NO转化率 |
| C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率 |
| D.380℃下,c起始(O2)=5.0×10-4 mol·L-1,NO平衡转化率为50%,则平衡常数K>2000 |
您最近一年使用:0次
2021-06-16更新
|
748次组卷
|
9卷引用:天津市耀华中学2021-2022学年高二上学期期中考试化学试题
天津市耀华中学2021-2022学年高二上学期期中考试化学试题(已下线)必考点04 化学反应的方向和调控-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)黑龙江省哈尔滨工业大学附属中学2020-2021学年度高二下学期期末考试化学试题福建省厦门集美中学2022-2023学年高三上学期期中考试化学试题江苏省昆山市柏庐高级中学、周市高级中学2020-2021学年高二下学期第二次阶段检测化学试题江西省景德镇一中2020-2021学年高二下学期期末考试化学(2班)试题安徽省淮北市树人高级中学2020-2021学年高二下学期期末考试化学试题湖北省应城市第一高级中学2022-2023学年高二上学期10月月考化学试题福建省南平第一中学2023-2024学年高三上学期第二次阶段考化学试题



