1 . I.中国科学家首次实现了二氧化碳到淀粉的全合成,相关成果由国际知名学术期刊《科学》在线发表。CO2的捕集、利用与封存是科学家研究的重要课题,利用CH4与CO2制备“合成气”CO、H2,合成气可直接制备甲醇,反应原理为:CO(g)+2H2(g) CH3OH(g) ΔH=-99 kJ·mol-1。
CH3OH(g) ΔH=-99 kJ·mol-1。
(1)若要该反应自发进行,___________ (填“高温”、“低温”或“任何温度”)更有利。
(2)在恒温、恒容的密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是___________。
(3)把CO2 转化为HCOOH 是降碳并生产化工原料的常用方法,有关反应如下:
①CO(g)+H2O(g) HCOOH(g) ΔH1=-72.6 kJ·mol-1
HCOOH(g) ΔH1=-72.6 kJ·mol-1
②2CO(g)+O2(g) 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1
③O2(g)+2H2(g) 2H2O(g) ΔH3=-483.6 kJ·mol-1
2H2O(g) ΔH3=-483.6 kJ·mol-1
则CO2(g)与 H2(g)合成 HCOOH(g)反应的热化学方程式:___________ 。
(4)还可利用电化学方法可以将CO2有效地转化为HCOO-,后续经酸化转化为HCOOH,原理示意图如图所示,下列说法错误的是___________。
Ⅱ.我国学者结合实验与计算机模拟结果,研究了NO-CO的反应历程。在催化剂作用下, 此反应为2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。
2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。
(5)探究温度、压强(2MPa,5MPa)对反应的影响,如图所示,表示2MPa 的是___________。
(6)一定温度下,向容积1L的恒容密闭容器按体积比3:2的比例充入CO和NO,当反应达到平衡时NO的体积分数为 ,此温度下该反应的平衡常数K=
,此温度下该反应的平衡常数K=___________ =___________ 。(第一空写表达式,第二空保留三位有效数字)
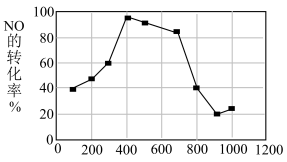
(7)使用相同催化剂,测得相同时间内 NO 的转化率随温度的变化曲线如图,解释 NO 的转化率在 100~900℃范围内随温度升高先上升后下降,且下降由缓到急的主要原因是___________ ;___________ 。
 CH3OH(g) ΔH=-99 kJ·mol-1。
CH3OH(g) ΔH=-99 kJ·mol-1。(1)若要该反应自发进行,
(2)在恒温、恒容的密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是___________。
| A.混合气体中碳元素的质量分数不再改变 | B.混合气体的密度不再变化 |
| C.CO的百分含量不再变化 | D.2v(H2)正=v(CO)逆 |
(3)把CO2 转化为HCOOH 是降碳并生产化工原料的常用方法,有关反应如下:
①CO(g)+H2O(g)
 HCOOH(g) ΔH1=-72.6 kJ·mol-1
HCOOH(g) ΔH1=-72.6 kJ·mol-1②2CO(g)+O2(g)
 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1③O2(g)+2H2(g)
 2H2O(g) ΔH3=-483.6 kJ·mol-1
2H2O(g) ΔH3=-483.6 kJ·mol-1则CO2(g)与 H2(g)合成 HCOOH(g)反应的热化学方程式:
(4)还可利用电化学方法可以将CO2有效地转化为HCOO-,后续经酸化转化为HCOOH,原理示意图如图所示,下列说法错误的是___________。

A.电解池的阴极电极反应式为2CO2+2e-+H2O=HCOO-+HCO |
| B.b为电源正极 |
| C.电解一段时间后,阳极区的KHCO3 溶液浓度降低 |
| D.若以氢氧碱性燃料电池作直流电源,那么负极的电极反应式为H2-2e-+2OH-=2H2O |
Ⅱ.我国学者结合实验与计算机模拟结果,研究了NO-CO的反应历程。在催化剂作用下, 此反应为2CO(g)+2NO(g)
 2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。
2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。(5)探究温度、压强(2MPa,5MPa)对反应的影响,如图所示,表示2MPa 的是___________。

| A.a | B.b | C.c | D.d |
(6)一定温度下,向容积1L的恒容密闭容器按体积比3:2的比例充入CO和NO,当反应达到平衡时NO的体积分数为
 ,此温度下该反应的平衡常数K=
,此温度下该反应的平衡常数K=(7)使用相同催化剂,测得相同时间内 NO 的转化率随温度的变化曲线如图,解释 NO 的转化率在 100~900℃范围内随温度升高先上升后下降,且下降由缓到急的主要原因是
您最近一年使用:0次
解题方法
2 . 氮在自然界中的存在十分广泛。某实验小组对不同含氮物质做了相关研究。请回答下列问题:
(1)氨的用途十分广泛,是制造硝酸和氮肥的重要原料。298K、101kPa条件下。合成氨每产生2molNH3,放出92.2kJ热量。已知:

1molN-H键断裂吸收的能量约等于___________ kJ。
(2)将NH3和NO2以一定的流速,分别通过甲、乙两种催化剂进行反应,相同时间内测量逸出气体中NO2含量,从而确定尾气脱氮率(即NO2的转化率),结果如图所示:

a点________ (填“是”或“不是”)平衡状态;脱氮率a~b段呈现如图变化,原因是_________ 。
(3)一种铁氮化合物具有高磁导率,可用于制电子元件,其晶胞结构如图所示。

①该铁氮化合物的化学式为___________ 。
②该晶体结构的另一种晶胞表示中,N处于顶点位置,则Fe(III)、Fe(II)分别处于___________ 、___________ 位置。
(4)25℃时,将10mL0.03mol/LNH4Cl溶液和10mL0.01mol/LAgNO3溶液混合(忽略溶液混合后的体积变化),混合后溶液中c(Ag+)为____________ [25℃时,Ksp(AgCl)=1.8×10-10]。用数字传感器探究AgCl的沉淀溶解平衡。实验测得悬浊液中溶解的氯化物浓度变化如图所示,其中a点表示AgCl溶于NH4Cl溶液形成的悬浊液,下列说法正确的是___________ (填字母标号)。
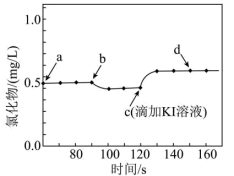
a.b点可能加入了NH4Cl(s) b.c点后无黄色沉淀生成
c.d点c(Ag+)<c(Cl-) d.由图可知:Ksp(AgI)<Ksp(AgCl)
(5)1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为r(NH3)=k1p(N2)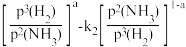 ,k1、k2分别为正反应和逆反应的速率常数;p(N2)、p(H2)、p(NH3)代表各组分的分压(分压=总压×物质的量分数);a为常数,工业上以铁为催化剂时,a=0.5。在一定条件下,向某容器中投入5molN2、15molH2,平衡时氨质量分数占40%,压强为32MPa.由此计算
,k1、k2分别为正反应和逆反应的速率常数;p(N2)、p(H2)、p(NH3)代表各组分的分压(分压=总压×物质的量分数);a为常数,工业上以铁为催化剂时,a=0.5。在一定条件下,向某容器中投入5molN2、15molH2,平衡时氨质量分数占40%,压强为32MPa.由此计算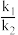 =
=___________ MPa-2(写出计算式即可)。
(1)氨的用途十分广泛,是制造硝酸和氮肥的重要原料。298K、101kPa条件下。合成氨每产生2molNH3,放出92.2kJ热量。已知:

1molN-H键断裂吸收的能量约等于
(2)将NH3和NO2以一定的流速,分别通过甲、乙两种催化剂进行反应,相同时间内测量逸出气体中NO2含量,从而确定尾气脱氮率(即NO2的转化率),结果如图所示:

a点
(3)一种铁氮化合物具有高磁导率,可用于制电子元件,其晶胞结构如图所示。

①该铁氮化合物的化学式为
②该晶体结构的另一种晶胞表示中,N处于顶点位置,则Fe(III)、Fe(II)分别处于
(4)25℃时,将10mL0.03mol/LNH4Cl溶液和10mL0.01mol/LAgNO3溶液混合(忽略溶液混合后的体积变化),混合后溶液中c(Ag+)为

a.b点可能加入了NH4Cl(s) b.c点后无黄色沉淀生成
c.d点c(Ag+)<c(Cl-) d.由图可知:Ksp(AgI)<Ksp(AgCl)
(5)1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为r(NH3)=k1p(N2)
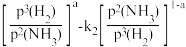 ,k1、k2分别为正反应和逆反应的速率常数;p(N2)、p(H2)、p(NH3)代表各组分的分压(分压=总压×物质的量分数);a为常数,工业上以铁为催化剂时,a=0.5。在一定条件下,向某容器中投入5molN2、15molH2,平衡时氨质量分数占40%,压强为32MPa.由此计算
,k1、k2分别为正反应和逆反应的速率常数;p(N2)、p(H2)、p(NH3)代表各组分的分压(分压=总压×物质的量分数);a为常数,工业上以铁为催化剂时,a=0.5。在一定条件下,向某容器中投入5molN2、15molH2,平衡时氨质量分数占40%,压强为32MPa.由此计算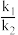 =
=
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
3 . 甲烷-CO2重整反应可以得到用途广泛的合成气 ,已知化学方程式如下:
CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH>0
(1)相关物质的燃烧热数据如下表所示:
①ΔH=___________ kJ·mol-1
②用Ni基双金属催化,反应的活化能降低,ΔH___________ (填“变大”“变小”或“不变”)
(2)控制其他条件不变,改变温度对合成气中甲烷质量分数的影响如图1。

若充入a mol CH4,经过2小时后达到如图1中 A点,2小时内用CH4表示的平均反应速率为___________ mol·h-1(用a表示);假设A为平衡态,此时压强为2 MPa,平衡常数Kp=___________ (用平衡分压代替平衡浓度,分压=总压×物质的量分数,保留2位小数)
(3)甲烷的重整反应速率可以表示为η=k·p(CH4)[p(CH4)是指甲烷的分压],其中k为速率常数。下列说法正确的是___________ 。
a.增加甲烷的浓度,η增大 b.增加CO2浓度,η增大
c.及时分离合成气,η增大 d.通过升高温度,提升k
(4)已知在高温的条件下,会发生如下副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.0 kJ·mol-1,且温度越高副反应的转化率越高,化学上称之为“温度的选择性”。不同 配比随温度变化对平衡时
配比随温度变化对平衡时 配比的影响如图2所示
配比的影响如图2所示

按 =2.5的配比进料,随温度升高,合成气
=2.5的配比进料,随温度升高,合成气 配比“先增加后减小”。增加是因为高温有利于甲烷分解的积碳反应,请解释“减小”的可能原因
配比“先增加后减小”。增加是因为高温有利于甲烷分解的积碳反应,请解释“减小”的可能原因___________
CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH>0
(1)相关物质的燃烧热数据如下表所示:
| 物质 | CH4(g) | CO(g) | H2(g) |
| 燃烧热/(kJ·mol-1) | 890.3 | 283.0 | 285.8 |
②用Ni基双金属催化,反应的活化能降低,ΔH
(2)控制其他条件不变,改变温度对合成气中甲烷质量分数的影响如图1。

若充入a mol CH4,经过2小时后达到如图1中 A点,2小时内用CH4表示的平均反应速率为
(3)甲烷的重整反应速率可以表示为η=k·p(CH4)[p(CH4)是指甲烷的分压],其中k为速率常数。下列说法正确的是
a.增加甲烷的浓度,η增大 b.增加CO2浓度,η增大
c.及时分离合成气,η增大 d.通过升高温度,提升k
(4)已知在高温的条件下,会发生如下副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.0 kJ·mol-1,且温度越高副反应的转化率越高,化学上称之为“温度的选择性”。不同
 配比随温度变化对平衡时
配比随温度变化对平衡时 配比的影响如图2所示
配比的影响如图2所示
按
 =2.5的配比进料,随温度升高,合成气
=2.5的配比进料,随温度升高,合成气 配比“先增加后减小”。增加是因为高温有利于甲烷分解的积碳反应,请解释“减小”的可能原因
配比“先增加后减小”。增加是因为高温有利于甲烷分解的积碳反应,请解释“减小”的可能原因
您最近一年使用:0次
名校
4 . 1,2-二甲基环丙烷的顺反异构体可相互转化: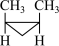 (顺式)
(顺式)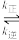
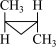 (反式)
(反式)  ,该反应的速率方程为:
,该反应的速率方程为: (顺)和
(顺)和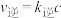 (反),
(反), 和
和 分别为正、逆反应速率常数。
分别为正、逆反应速率常数。 ℃时,加入顺式异构体发生反应,两种异构体的质量分数w随时间t的变化如图所示。下列说法正确的是
℃时,加入顺式异构体发生反应,两种异构体的质量分数w随时间t的变化如图所示。下列说法正确的是

 (顺式)
(顺式)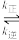
 (反式)
(反式)  ,该反应的速率方程为:
,该反应的速率方程为: (顺)和
(顺)和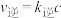 (反),
(反), 和
和 分别为正、逆反应速率常数。
分别为正、逆反应速率常数。 ℃时,加入顺式异构体发生反应,两种异构体的质量分数w随时间t的变化如图所示。下列说法正确的是
℃时,加入顺式异构体发生反应,两种异构体的质量分数w随时间t的变化如图所示。下列说法正确的是
A.反应速率: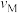 (正) (正)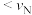 (逆) (逆) |
| B.L点:转化率为50%,Q(浓度商)>K |
C.升高温度, 、 、 增大倍数: 增大倍数: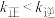 |
D. ℃时发生反应,测得 ℃时发生反应,测得 ,则 ,则 |
您最近一年使用:0次
2023-06-03更新
|
852次组卷
|
4卷引用:重庆市巴蜀中学校2023学年高三模拟预测化学试题
重庆市巴蜀中学校2023学年高三模拟预测化学试题考点巩固卷08 化学反应速率与化学平衡(3大考点45题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)第28讲化化学平衡的移动及反应进行的方向(已下线)选择题11-14
名校
解题方法
5 . 从分金渣(主要成分为AgCl、 、
、 、
、 )中获取高纯银的流程如图所示:
)中获取高纯银的流程如图所示:
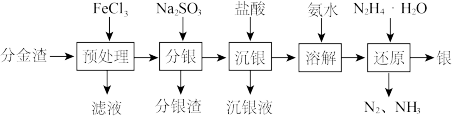
已知:在上述反应的温度下 ,
,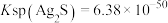
(1)“预处理”加入 溶液将
溶液将 转化为AgCl,反应的化学方程式为
转化为AgCl,反应的化学方程式为___________ 。
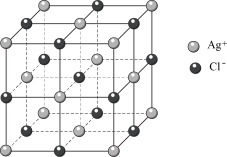
(2)氯化银的晶胞如图, 周围最近且等距离的
周围最近且等距离的 数目为
数目为___________ 。
(3)已知: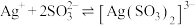 ,
,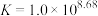 ,“分银”时,AgCl与
,“分银”时,AgCl与 反应生成
反应生成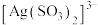 ,该反应的平衡常数
,该反应的平衡常数
___________ 。
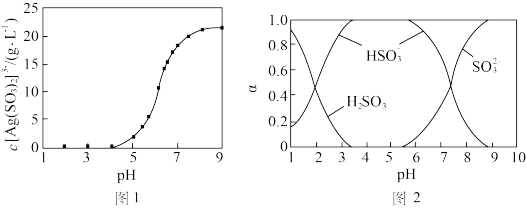
(4)“分银”时,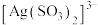 的浓度与溶液pH的关系如图1;
的浓度与溶液pH的关系如图1; 及其与
及其与 形成的微粒的浓度分数
形成的微粒的浓度分数 随溶液pH变化的关系如图2。“分银”时,终点pH需控制的范围及原因为
随溶液pH变化的关系如图2。“分银”时,终点pH需控制的范围及原因为___________ 。
(5)“还原”时发生反应的离子方程式为___________ 。
(6)已如 (白色),测定所制银样品纯度的过程为(杂质不反应):
(白色),测定所制银样品纯度的过程为(杂质不反应):
①称取制备的银样品1.0800g,加适量稀硝酸溶解,定容到100mL容量瓶中。
②准确量取25.00mL溶液于锥形瓶中,酸化后滴入几滴 溶液作指示剂,再用
溶液作指示剂,再用 标准溶液滴定,滴定终点时溶液变为血红色。
标准溶液滴定,滴定终点时溶液变为血红色。
③重复②的操作2次,所用 标准溶液的平均体积为24.00mL。
标准溶液的平均体积为24.00mL。
计算样品中银的质量分数(写出计算过程)___________ 。
 、
、 、
、 )中获取高纯银的流程如图所示:
)中获取高纯银的流程如图所示:
已知:在上述反应的温度下
 ,
,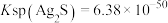
(1)“预处理”加入
 溶液将
溶液将 转化为AgCl,反应的化学方程式为
转化为AgCl,反应的化学方程式为(2)氯化银的晶胞如图,
 周围最近且等距离的
周围最近且等距离的 数目为
数目为
(3)已知:
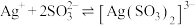 ,
,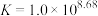 ,“分银”时,AgCl与
,“分银”时,AgCl与 反应生成
反应生成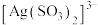 ,该反应的平衡常数
,该反应的平衡常数
(4)“分银”时,
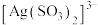 的浓度与溶液pH的关系如图1;
的浓度与溶液pH的关系如图1; 及其与
及其与 形成的微粒的浓度分数
形成的微粒的浓度分数 随溶液pH变化的关系如图2。“分银”时,终点pH需控制的范围及原因为
随溶液pH变化的关系如图2。“分银”时,终点pH需控制的范围及原因为
(5)“还原”时发生反应的离子方程式为
(6)已如
 (白色),测定所制银样品纯度的过程为(杂质不反应):
(白色),测定所制银样品纯度的过程为(杂质不反应):①称取制备的银样品1.0800g,加适量稀硝酸溶解,定容到100mL容量瓶中。
②准确量取25.00mL溶液于锥形瓶中,酸化后滴入几滴
 溶液作指示剂,再用
溶液作指示剂,再用 标准溶液滴定,滴定终点时溶液变为血红色。
标准溶液滴定,滴定终点时溶液变为血红色。③重复②的操作2次,所用
 标准溶液的平均体积为24.00mL。
标准溶液的平均体积为24.00mL。计算样品中银的质量分数(写出计算过程)
您最近一年使用:0次
2023-05-31更新
|
616次组卷
|
3卷引用:专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)
2022高三·全国·专题练习
解题方法
6 . 顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化:

该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题:
(1)已知:t1温度下,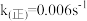 ,
,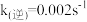 ,该温度下反应的平衡常数值K1=
,该温度下反应的平衡常数值K1=_______ 。
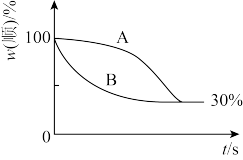
(2)t2温度下,下图中能表示顺式异构体的质量分数随时间变化的曲线是_______ (填曲线编号),平衡常数值K2=_______ 。

该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题:
(1)已知:t1温度下,
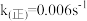 ,
,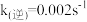 ,该温度下反应的平衡常数值K1=
,该温度下反应的平衡常数值K1=(2)t2温度下,下图中能表示顺式异构体的质量分数随时间变化的曲线是

您最近一年使用:0次
2024高三·全国·专题练习
解题方法
7 . 二甲醚是重要的有机合成原料,工业上常用合成气(主要成分为CO、H2)制备二甲醚,其主要反应如下。
反应ⅰ:CO(g)+2H2(g) CH3OH(g);
CH3OH(g);
反应ⅱ:2CH3OH(g) CH3OCH3(g)+H2O(g);
CH3OCH3(g)+H2O(g);
反应ⅲ:CO(g)+H2O(g) CO2(g)+H2(g)。
CO2(g)+H2(g)。
(1)一定温度下,在体积为2 L的刚性容器中充入4 mol CO(g)和8 mol H2(g)制备二甲醚,4 min时达到平衡,平衡时CO(g)的转化率为80%,c(H2)=1.4 mol·L-1,且c(CH3OH)=2c(CH3OCH3)。反应ⅲ的平衡常数Kc=_______ (保留三位有效数字)。
(2)实际工业生产中,需要在260 ℃、压强恒为4.0 MPa的反应釜中进行上述反应。初始时向反应釜中加入0.01 mol CO(g)和0.02 mol H2(g),为确保反应的连续性,需向反应釜中以n(CO)∶n(H2)=1∶2、进气流量0.03 mol·min-1持续通入原料,同时控制出气流量。①已知出气流量为0.02 mol·min-1,单位时间内CO(g)的转化率为60%,则流出气体中CO2(g)的百分含量为_______ 。②需控制出气流量小于进气流量的原因为_______ 。
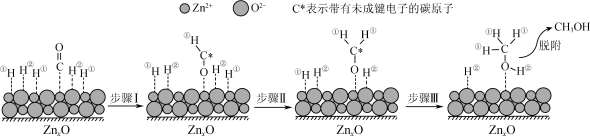
(3)在ZnxO催化剂的作用下发生反应ⅰ,其可能反应机理如下图所示。______________ 。
②在合成甲醇过程中,需要不断分离出甲醇的原因为_______ 。
反应ⅰ:CO(g)+2H2(g)
 CH3OH(g);
CH3OH(g);反应ⅱ:2CH3OH(g)
 CH3OCH3(g)+H2O(g);
CH3OCH3(g)+H2O(g);反应ⅲ:CO(g)+H2O(g)
 CO2(g)+H2(g)。
CO2(g)+H2(g)。(1)一定温度下,在体积为2 L的刚性容器中充入4 mol CO(g)和8 mol H2(g)制备二甲醚,4 min时达到平衡,平衡时CO(g)的转化率为80%,c(H2)=1.4 mol·L-1,且c(CH3OH)=2c(CH3OCH3)。反应ⅲ的平衡常数Kc=
(2)实际工业生产中,需要在260 ℃、压强恒为4.0 MPa的反应釜中进行上述反应。初始时向反应釜中加入0.01 mol CO(g)和0.02 mol H2(g),为确保反应的连续性,需向反应釜中以n(CO)∶n(H2)=1∶2、进气流量0.03 mol·min-1持续通入原料,同时控制出气流量。①已知出气流量为0.02 mol·min-1,单位时间内CO(g)的转化率为60%,则流出气体中CO2(g)的百分含量为
(3)在ZnxO催化剂的作用下发生反应ⅰ,其可能反应机理如下图所示。
②在合成甲醇过程中,需要不断分离出甲醇的原因为
您最近一年使用:0次
2024高三·全国·专题练习
8 . 工业上用磷铁渣(主要含FeP、Fe2P,以及少量Fe2O3、SiO2等杂质)制备磷酸铁的工艺流程如下图。已知:①在密闭的反应釜中,硝酸首先分解生成NO2和O2,O2进一步将磷铁渣中的FeP、Fe2P氧化成Fe2O3和P2O5,继而生成Fe(NO3)3和H3PO4;②FePO4难溶于水,可溶于无机强酸。___________ 。
(2)“浸取”时Fe2P与O2反应的化学方程式为___________ 。
(3)“浸取”时设定反应时间为2h,不同硝酸浓度下磷铁渣的溶解率如图1所示,当硝酸浓度在1.5~2.0mol·L-1时,磷铁渣溶解率呈现降低的趋势,其原因是___________ 。___________ ;“制备”过程中溶液的pH对磷酸铁产品中铁和磷的含量及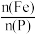 比值的影响如图2所示[考虑到微量金属杂质,在pH=1时,
比值的影响如图2所示[考虑到微量金属杂质,在pH=1时,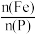 为0.973最接近理论值]。在pH范围为1~1.5时,随着pH增大,
为0.973最接近理论值]。在pH范围为1~1.5时,随着pH增大,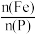 明显增大,其原因是
明显增大,其原因是___________ 。 )为
)为___________ mol·L-1[已知:Ksp(FePO4)=1.3×10-22]。
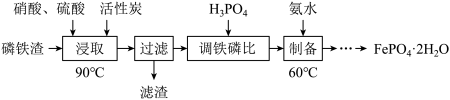
(2)“浸取”时Fe2P与O2反应的化学方程式为
(3)“浸取”时设定反应时间为2h,不同硝酸浓度下磷铁渣的溶解率如图1所示,当硝酸浓度在1.5~2.0mol·L-1时,磷铁渣溶解率呈现降低的趋势,其原因是

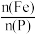 比值的影响如图2所示[考虑到微量金属杂质,在pH=1时,
比值的影响如图2所示[考虑到微量金属杂质,在pH=1时,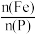 为0.973最接近理论值]。在pH范围为1~1.5时,随着pH增大,
为0.973最接近理论值]。在pH范围为1~1.5时,随着pH增大,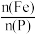 明显增大,其原因是
明显增大,其原因是
 )为
)为
您最近一年使用:0次
真题
解题方法
9 . 含结晶水的无机物可应用在吸波材料、电极材料和相变储能材料等领域。胆矾(CuSO4·5H2O)是一种重要的结晶水合物。
(1)硫酸铜参比电极具有电位稳定的优点,可用于土壤环境中钢质管道的电位监测。测量的电化学原理如图所示。回答下列问题:
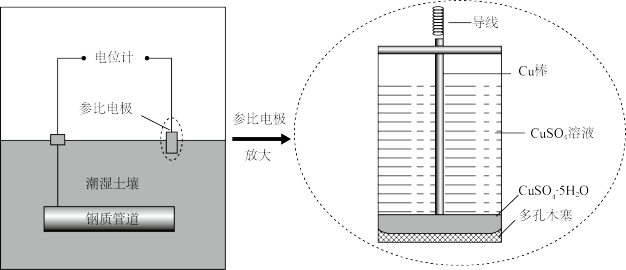
①负极的电极反应式为_______ 。
②测量后参比电极中CuSO4溶液的浓度_______ (填"变大”,“变小”或“不变")。
(2)把胆矾放到密闭容器内,缓缓抽去其中的水气,胆矾分三次依次脱水,各步脱水过程为一系列的动态平衡,反应式如下(脱水过程为吸热反应)。
反应I:CuSO4·5H2O (s) CuSO4·3H2O (s) + 2H2O(g)
CuSO4·3H2O (s) + 2H2O(g)
反应II:CuSO4·3H2O (s) CuSO4·H2O (s) + 2H2O(g)
CuSO4·H2O (s) + 2H2O(g)
反应III:CuSO4·H2O (s) CuSO4(s) + H2O(g)
CuSO4(s) + H2O(g)
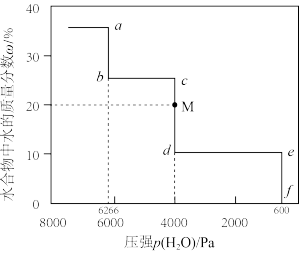
如图为50°C时水合物中水的质量分数 w与压强p(H2O)的关系图,回答下列问题:
①用无水CuSO4检验乙醇中含有微量水的现象是_______ 。
②反应Ⅰ对应的线段为_______ (填“ab”、“ed”或“ef”)。
③反应Ⅱ的平衡常数Kp=_______ Pa2。
④反应III在60°C和50°C的平衡压强p(H2O)分别为p1和p2,则p1_______ p2 (填*>”、“<”或“=”)。
⑤当样品状态c点下网到M点,体系存在的固体有_______ ; 转化率为_______ % (保留小数点后两位)。
⑥25°C时为了保持CuSO4·H2O晶体纯度,可将其存在盛有大量Na2CO3· H2O晶体(平衡压强p(H2O)=706Pa)的密闭容器中,简述其理由_______ 。
已知:25℃时反应I、II、III的平衡压强p(H2O)分别为1040、747和107Pa。
(1)硫酸铜参比电极具有电位稳定的优点,可用于土壤环境中钢质管道的电位监测。测量的电化学原理如图所示。回答下列问题:

①负极的电极反应式为
②测量后参比电极中CuSO4溶液的浓度
(2)把胆矾放到密闭容器内,缓缓抽去其中的水气,胆矾分三次依次脱水,各步脱水过程为一系列的动态平衡,反应式如下(脱水过程为吸热反应)。
反应I:CuSO4·5H2O (s)
 CuSO4·3H2O (s) + 2H2O(g)
CuSO4·3H2O (s) + 2H2O(g)反应II:CuSO4·3H2O (s)
 CuSO4·H2O (s) + 2H2O(g)
CuSO4·H2O (s) + 2H2O(g)反应III:CuSO4·H2O (s)
 CuSO4(s) + H2O(g)
CuSO4(s) + H2O(g)如图为50°C时水合物中水的质量分数 w与压强p(H2O)的关系图,回答下列问题:

①用无水CuSO4检验乙醇中含有微量水的现象是
②反应Ⅰ对应的线段为
③反应Ⅱ的平衡常数Kp=
④反应III在60°C和50°C的平衡压强p(H2O)分别为p1和p2,则p1
⑤当样品状态c点下网到M点,体系存在的固体有
⑥25°C时为了保持CuSO4·H2O晶体纯度,可将其存在盛有大量Na2CO3· H2O晶体(平衡压强p(H2O)=706Pa)的密闭容器中,简述其理由
已知:25℃时反应I、II、III的平衡压强p(H2O)分别为1040、747和107Pa。
您最近一年使用:0次
名校
10 . Al3+与F-具有很强的亲和性,当F-的浓度过大时,还会形成AlF 。AlF3在一定溶剂中存在分步电离,常温下向某浓度的AlF3溶液中加入NaF,实验测定Al3+、AlF2+、AlF
。AlF3在一定溶剂中存在分步电离,常温下向某浓度的AlF3溶液中加入NaF,实验测定Al3+、AlF2+、AlF 、AlF3在所有含铝元素微粒中的百分含量随pF[
、AlF3在所有含铝元素微粒中的百分含量随pF[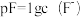 ]的变化如图所示,下列说法错误的是
]的变化如图所示,下列说法错误的是
 。AlF3在一定溶剂中存在分步电离,常温下向某浓度的AlF3溶液中加入NaF,实验测定Al3+、AlF2+、AlF
。AlF3在一定溶剂中存在分步电离,常温下向某浓度的AlF3溶液中加入NaF,实验测定Al3+、AlF2+、AlF 、AlF3在所有含铝元素微粒中的百分含量随pF[
、AlF3在所有含铝元素微粒中的百分含量随pF[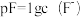 ]的变化如图所示,下列说法错误的是
]的变化如图所示,下列说法错误的是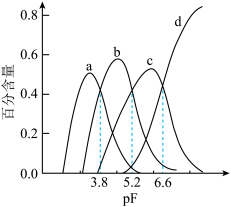
A.曲线b表示AlF |
B.pF=4时, |
C.Pf= 6.6时, 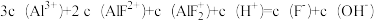 |
D.常温下, 的化学平衡常数为1015.6 的化学平衡常数为1015.6 |
您最近一年使用:0次



